К химической символики относят символы химических элементов, химические формулы и уравнения.
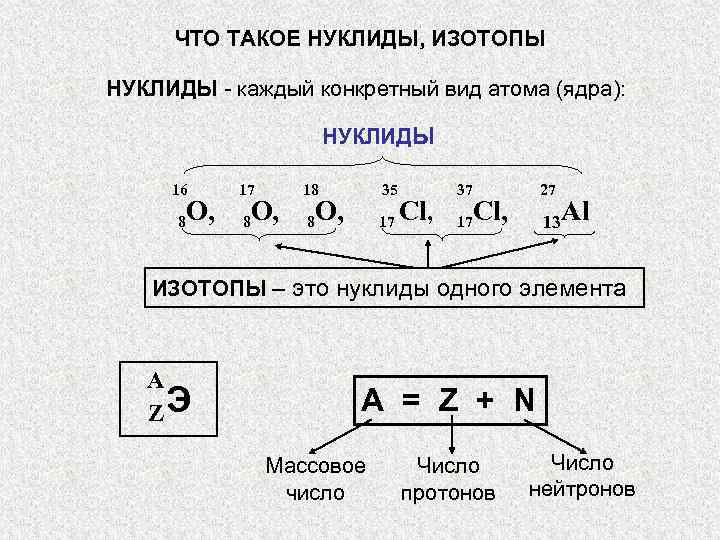
Символы химических элементов состоят из одной или двух букв латинского алфавита с числа тех, которые входят в состав латинского названия элемента. Большинство названий и, соответственно, символов химических элементов сложились исторически и присваивались первооткрывателями этих элементов. В последнее время в Периодической системе можно встретить такие символы, как Unn . Подобные символы присваивают недавно открытым элементам, для которых еще не утверждено название международным обществом фундаментальной и прикладной химии ( IUPAC ). Для таких элементов в названии и символе зашифровывают порядковый номер элемента на основании латинского названия цифр. Например, элемент с порядковым номером 110 будет иметь название унуннілій (ун — 1, нил — 0) и символ Uun , а элемент с порядковым номером 118 — название унуноктий (ун — 1, окта — 8) и символ Uuo .
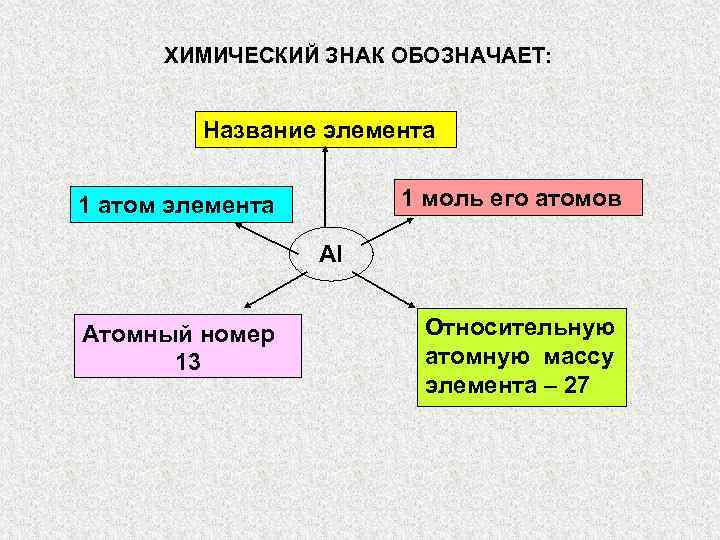
Химическими символами обозначают: химический элемент; простое вещество с атомной или металлической кристаллической решеткой ( Al , Fe , С, Si ); один атом химического элемента.
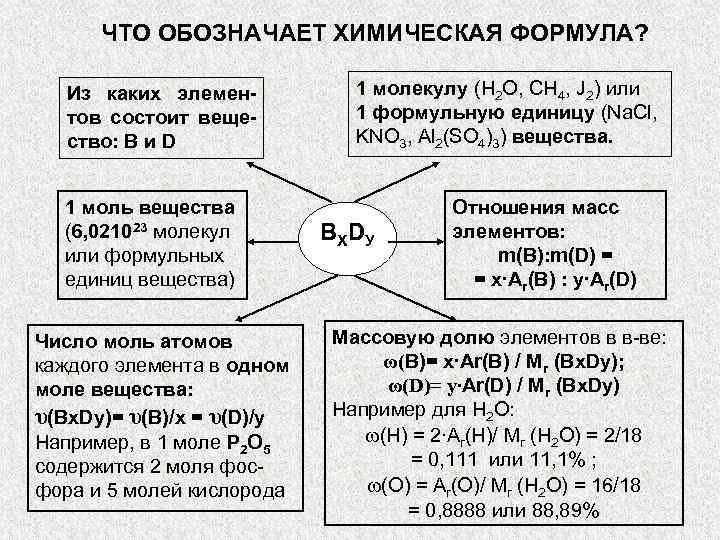
Химические формулы — это обозначение состава вещества с помощью знаков химических символов и индексов.
Индекс — это цифра, которую располагают справа внизу от символа химического элемента, он указывает на число атомов этого элемента в молекуле вещества.
Различают несколько видов химических формул (по рекомендациям IUPAC ): эмпирические, молекулярные, электронные, структурные и дисплейные.
Молекулярные формулы отражают качественный (из атомов каких элементов состоит вещество) и количественный состав молекулы вещества. Например, запись СО2 означает, что:
— в состав углекислого газа входят атомы элементов Углерода и Кислорода;
— одна молекула углекислого газа состоит из одного атома Углерода и двух атомов Кислорода.
Молекулярные формулы можно применять только для веществ молекулярного строения. У веществ ионной или атомной строения нельзя выделить отдельные молекулы, поэтому для них применяют эмпирические формулы.
Эмпирические формулы отражают качественный состав вещества и количественное соотношение между атомами элементов в веществе (стехиометрическое соотношение).
Эмпирические формулы применяют для веществ ионной или атомной строения, а также для отображения результатов элементного анализа вещества.
Например, натрий хлорид имеет ионное строение. Кристалл (надмолекула) натрий хлорида состоит из большого количества положительно заряженных ионов Натрия и отрицательно заряженных ионов Хлора. Причем в кристаллической решетке каждый ион Натрия окружен шестью ионами Хлора, а каждый ион Хлора окружен шестью ионами Натрия, поэтому отдельную частицу, которую можно назвать молекулой натрий хлорида, выделить невозможно. Однако в целом в кристалле соотношение между ионами Натрия и Хлора равно 1:1. Следовательно, надмолекулу натрий хлорида необходимо записать так: m . Но вместо этого удобнее пользоваться эмпирической формулой NaCl .
Эмпирические формулы используют также для отражения элементного анализа. Например, если по результатам анализа вещество состоит из атомов Углерода и Водорода с соотношением 1:1, то для этого вещества можно записать эмпирическую формулу СН. Однако без дополнительных данных сказать, что это за вещество, невозможно, ведь такая эмпирическая формула справедлива для ацетилена (молекулярная формула С2Н 2 ), бензену (молекулярная формула С6Н6), циклодекапентаену (С10Н10) и т.д. Или же эмпирическая формула СН2 характерна для всех этиленовых углеводородов (например, этилен С2Н4 или бутен С4Н8), а также и для всех циклоалканів (например, циклопропан С3Н6 или циклогексан С6Н12).
Электронные формулы схематично отражают механизм образования химических связей в молекулах. их записывают с помощью символов химических элементов и точек, которые обозначают электроны внешнего электронного уровня. Например:
Структурные формулы отражают порядок соединения атомов или групп атомов в молекулах. Чаще всего структурные формулы используют для изображения молекул органических веществ. Например:
В структурных формулах черточкой обозначают химическую связь, то есть одна общая электронная пара. Структурные формулы используют только для отображения соединения атомов, но не пространственного строения. Структурные формулы невозможно использовать для изображения ионных соединений, поскольку в них отсутствуют общие электронные пары. Структурными формулами пользуются для изображения молекул или групп атомов, в которых атомы связаны ковалентними связями.
Дисплейные формулы напоминают структурные формулы, однако в дисплейных формулах все связи обозначают черточкой. Кроме того, часто в дисплейных формулах отражают валентные углы между связями, поэтому с их помощью можно отображать пространственную строение молекул.
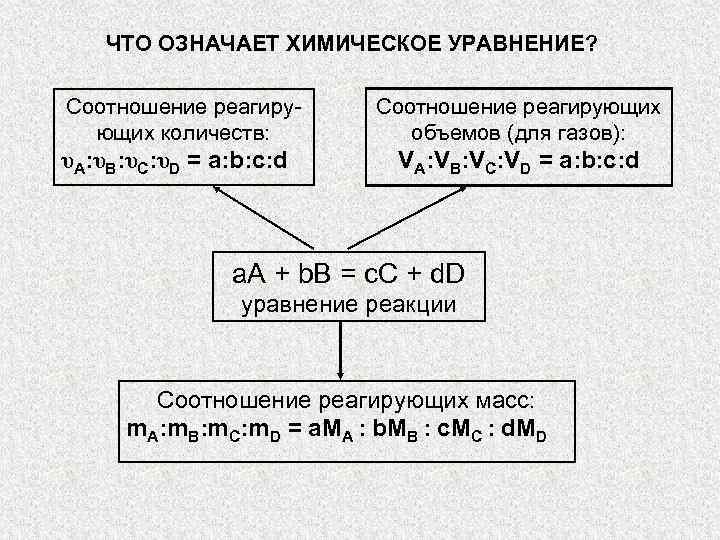
Химические уравнение — это условное изображение химической реакции с помощью химических символов, формул и коэффициентов.
Например, 2 Na O H + H 2 S → Na 2 S + 2 H 2 О.
Коэффициенты обозначают большой цифрой слева от формулы вещества. Коэффициент принадлежит формуле только того вещества, рядом с которой он стоит. Коэффициент показывает число отдельных атомов или молекул (или число молей вещества атомов или молекул), которые участвуют в химической реакции.
При записи уравнений химических реакций используют также следующие обозначения:
• символы → или = разделяют исходные вещества и продукты реакции;
• символ 
• символ ↑ — вещество выделяется в виде газа с конденсированной системы (смеси твердых или жидких веществ);
• символ ↓ — вещество выпадает в осадок из раствора или смеси газов.
Иногда еще указывают агрегатное состояние исходных веществ и продуктов реакции или концентрацию раствора какой-либо исходного вещества: «тв» — твердое вещество, «г» — жидкость, «г» — газ, «конц» — концентрированный раствор, «решения» — разведенный раствор.
Уравнение химических реакций разделяют на:
молекулярные (для всех веществ записаны молекулярные или эмпирические формулы),
ионные (записывают только ионы, которые участвуют в реакции),
электронные и электронно-ионные уравнения напівреакцій (описывают процесс окисления или восстановления),
термохимические (в молекулярных уравнениях указывают тепловой эффект реакции).
Молекулярные уравнение реакции:
Соответствующие им ионные уравнения реакций:
В ионных и электронно-ионных уравнениях реакций указывают заряды ионов в растворах. При записи заряда ионов сначала записывают величину заряда (арабской цифрой), а потом знак заряда: 2-, 3+ и т.д.
Электронные уравнение напівреакцій для уравнения (2):
В электронных уравнениях реакции указывают степень окисления атомов элементов. При записи степени окисления сначала указывают знак, а затем значение степени окисления: -2, +5 и т.д.
Электронно-ионные уравнение напівреакцій для уравнения (3):
Также часто используют термохимические уравнения реакций. Это обычные уравнения, в которых указывают еще и тепловой эффект реакции, т.е. количество теплоты, которое поглощается или выделяется в результате реакции. Примеры термохимических уравнений реакций:


Уравнение химических реакций отражают количественные (мольные) соотношение веществ, вступают в реакцию и образуются в результате реакции. Поэтому иногда такие уравнения и коэффициенты в них называют стехиометрическими уравнениями и коэффициентами.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

ХИМИЧЕСКИЕ ЗНАКИ, ФОРМУЛЫ И УРАВНЕНИЯ Для
ЛЕК. 01 Химич.знаки,формулы, уравнения.ppt
ХИМИЧЕСКИЕ ЗНАКИ, ФОРМУЛЫ И УРАВНЕНИЯ Для обозначения элементов используют химические знаки, которые» src=»https://present5.com/presentation/3/-101361182_420222222.pdf-img/-101361182_420222222.pdf-1.jpg» alt=»> ХИМИЧЕСКИЕ ЗНАКИ, ФОРМУЛЫ И УРАВНЕНИЯ Для обозначения элементов используют химические знаки, которые» /> ХИМИЧЕСКИЕ ЗНАКИ, ФОРМУЛЫ И УРАВНЕНИЯ Для обозначения элементов используют химические знаки, которые состоят из первой или первой и одной из последующих букв латинских названий элементов: алюминий – Aluminium …. Al железо – Ferrum …………. . Fe водород – Hydrogenium …. H кислород – Oxygenium ……O и т. д. ЧТО ОБОЗНАЧАЕТ ХИМИЧЕСКИЙ ЗНАК?
ХИМИЧЕСКИЙ ЗНАК ОБОЗНАЧАЕТ: Название элемента 1 атом элемента 1″ src=»https://present5.com/presentation/3/-101361182_420222222.pdf-img/-101361182_420222222.pdf-2.jpg» alt=»> ХИМИЧЕСКИЙ ЗНАК ОБОЗНАЧАЕТ: Название элемента 1 атом элемента 1″ /> ХИМИЧЕСКИЙ ЗНАК ОБОЗНАЧАЕТ: Название элемента 1 атом элемента 1 моль его атомов Al Атомный номер Относительную 13 атомную массу элемента – 27
ЧТО ТАКОЕ НУКЛИДЫ, ИЗОТОПЫ НУКЛИДЫ — каждый конкретный вид атома (ядра): » src=»https://present5.com/presentation/3/-101361182_420222222.pdf-img/-101361182_420222222.pdf-3.jpg» alt=»> ЧТО ТАКОЕ НУКЛИДЫ, ИЗОТОПЫ НУКЛИДЫ — каждый конкретный вид атома (ядра): » /> ЧТО ТАКОЕ НУКЛИДЫ, ИЗОТОПЫ НУКЛИДЫ — каждый конкретный вид атома (ядра): НУКЛИДЫ 16 17 18 35 37 27 O, 8 8 O, O, 8 17 Cl, 17 13 Al ИЗОТОПЫ – это нуклиды одного элемента A ZЭ A = Z + N Массовое Число число протонов нейтронов
ЧТО ОБОЗНАЧАЕТ ХИМИЧЕСКАЯ ФОРМУЛА? Из каких элемен- 1 молекулу (Н 2 О,» src=»https://present5.com/presentation/3/-101361182_420222222.pdf-img/-101361182_420222222.pdf-4.jpg» alt=»> ЧТО ОБОЗНАЧАЕТ ХИМИЧЕСКАЯ ФОРМУЛА? Из каких элемен- 1 молекулу (Н 2 О,» /> ЧТО ОБОЗНАЧАЕТ ХИМИЧЕСКАЯ ФОРМУЛА? Из каких элемен- 1 молекулу (Н 2 О, СН 4, J 2) или тов состоит веще- 1 формульную единицу (Na. Cl, ство: В и D KNO 3, Al 2(SO 4)3) вещества. 1 моль вещества Отношения масс (6, 021023 молекул ВХ DУ элементов: или формульных m(B): m(D) = единиц вещества) = х∙Аr(B) : y∙Аr(D) Число моль атомов Массовую долю элементов в в-ве: каждого элемента в одном ω(В)= х∙Аr(B) / Mr (Bx. Dy); моле вещества: ω(D)= y∙Аr(D) / Mr (Bx. Dy) υ(Bx. Dy)= υ(B)/x = υ(D)/y Например для Н 2 О: Например, в 1 моле Р 2 О 5 ω(Н) = 2∙Аr(Н)/ Mr (Н 2 О) = 2/18 содержится 2 моля фос- = 0, 111 или 11, 1% ; фора и 5 молей кислорода ω(О) = Аr(О)/ Mr (Н 2 О) = 16/18 = 0, 8888 или 88, 89%
ЧТО ОЗНАЧАЕТ ХИМИЧЕСКОЕ УРАВНЕНИЕ? Соотношение реагиру- Соотношение реагирующих количеств: » src=»https://present5.com/presentation/3/-101361182_420222222.pdf-img/-101361182_420222222.pdf-5.jpg» alt=»> ЧТО ОЗНАЧАЕТ ХИМИЧЕСКОЕ УРАВНЕНИЕ? Соотношение реагиру- Соотношение реагирующих количеств: » /> ЧТО ОЗНАЧАЕТ ХИМИЧЕСКОЕ УРАВНЕНИЕ? Соотношение реагиру- Соотношение реагирующих количеств: объемов (для газов): υA: υB: υC: υD = a: b: c: d VA: VB: VC: VD = a: b: c: d a. А + b. B = c. C + d. D уравнение реакции Соотношение реагирующих масс: m. A: m. B: m. C: m. D = a. MA : b. MB : c. MC : d. MD
ПРИМЕР РАССЧЕТА ПО ХИМИЧЕСКОМУ УРАВНЕНИЮ Задача. Какая масса Ba. Cl 2 израсходуется при» src=»https://present5.com/presentation/3/-101361182_420222222.pdf-img/-101361182_420222222.pdf-6.jpg» alt=»> ПРИМЕР РАССЧЕТА ПО ХИМИЧЕСКОМУ УРАВНЕНИЮ Задача. Какая масса Ba. Cl 2 израсходуется при» /> ПРИМЕР РАССЧЕТА ПО ХИМИЧЕСКОМУ УРАВНЕНИЮ Задача. Какая масса Ba. Cl 2 израсходуется при реакции с 10 г Fe 2(SO 4)3 ? Решение: Согласно уравнению реакции: Fe 2(SO 4)3 + 3 Ba. Cl 2 = 3 Ba. SO 4↓ + 2 Fe. Cl 3 1 моль 3 моля 2 моля отношение реагирующих масс: m(Fe 2(SO 4)3) : m(Ba. Cl 2) = 1 M(Fe 2(SO 4)3) : 3 M(Ba. Cl 2) отсюда находим массу хлорида бария: 3∙ 208, 24∙ 10 3 M(Ba. Cl 2) x m(Fe 2(SO 4)3) m(Ba. Cl 2) = = 15, 62 г 1 M(Fe 2(SO 4)3) 399, 88
ГАЗОВЫЕ ЗАКОНЫ Индивидуальное вещество в газообразном состоянии характеризуется следующими величинами: Р» src=»https://present5.com/presentation/3/-101361182_420222222.pdf-img/-101361182_420222222.pdf-7.jpg» alt=»> ГАЗОВЫЕ ЗАКОНЫ Индивидуальное вещество в газообразном состоянии характеризуется следующими величинами: Р» /> ГАЗОВЫЕ ЗАКОНЫ Индивидуальное вещество в газообразном состоянии характеризуется следующими величинами: Р – давлением; Т , или t – температурой; V – объемом; m – массой всего газа; М – молярной массой. Взаимосвязь между этими величинами устанавливают газовые законы. При этом обычно используют модель идеального газа , которая основана на следующих допущениях: 1) между частицами газа отсутствуют силы взаимодействия; 2) сами частицы представляют собой материальные точки.
1. ЗАКОН БОЙЛЯ-МАРИОТТА При Т = const (изотермический процесс): PV = const или P» src=»https://present5.com/presentation/3/-101361182_420222222.pdf-img/-101361182_420222222.pdf-8.jpg» alt=»>1. ЗАКОН БОЙЛЯ-МАРИОТТА При Т = const (изотермический процесс): PV = const или P» /> 1. ЗАКОН БОЙЛЯ-МАРИОТТА При Т = const (изотермический процесс): PV = const или P 1 V 1 = P 2 V 2 2. ЗАКОН ГЕЙ-ЛЮССАКА При Р = const (изобарический процесс): V/Т = const или V 1/Т 1 = V 2/Т 2 3. ЗАКОН ШАРЛЯ При V = const (изохорический процесс) Р/Т = const или Р 1/Т 1 = Р 2/Т 2
4. УРАВНЕНИЕ КЛАПЕЙРОНА Объединенный газовый закон P 1 V 1 P» src=»https://present5.com/presentation/3/-101361182_420222222.pdf-img/-101361182_420222222.pdf-9.jpg» alt=»> 4. УРАВНЕНИЕ КЛАПЕЙРОНА Объединенный газовый закон P 1 V 1 P» /> 4. УРАВНЕНИЕ КЛАПЕЙРОНА Объединенный газовый закон P 1 V 1 P 2 V 2 PV = или = const Т 1 Т 2 Т 5. УРАВНЕНИЕ КЛАПЕЙРОНА- МЕНДЕЛЕЕВА PV = n. RT, где n = m/M или PV = m. RT/М , где R = 8, 31 Дж/(моль∙К) = 0, 82 л∙атм/(моль∙К) P – давление, Па; Т – температура, К
УРАВНЕНИЕ КЛАПЕЙРОНА- МЕНДЕЛЕЕВА (следствия) Из уравнения Клапейрона-Менделеева следуют два » src=»https://present5.com/presentation/3/-101361182_420222222.pdf-img/-101361182_420222222.pdf-10.jpg» alt=»> УРАВНЕНИЕ КЛАПЕЙРОНА- МЕНДЕЛЕЕВА (следствия) Из уравнения Клапейрона-Менделеева следуют два » /> УРАВНЕНИЕ КЛАПЕЙРОНА- МЕНДЕЛЕЕВА (следствия) Из уравнения Клапейрона-Менделеева следуют два важных результата: Следствие 1. V = n. RT/Р = n∙(RT/Р) Отсюда, при Р = const и Т = const V 1 / n 1 = V 1 / n 1 или V
n Следовательно, объём газа прямо пропорционален числу молей (и числу молекул), причем коэффициент пропорциональности ( RT /Р) одинаков для всех газов и зависит только от давления и температуры. Это есть не что иное, как закон Авогадро.
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Мир науки
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Рефераты и конспекты лекций по географии, физике, химии, истории, биологии. Универсальная подготовка к ЕГЭ, ГИА, ЗНО и ДПА!
Видео:Решение задач по уравнениям реакций, если одно из реагирующих веществ взято в избытке. 1 ч. 9 класс.Скачать

Химия — рефераты, шпаргалки, семинары, конспекты, лекции
Видео:Как составлять ХИМИЧЕСКИЕ УРАВНЕНИЯ | 4 лайфхака - 95 ВСЕХ РЕАКЦИЙ в химии!Скачать

Химическая символика
К химической символики относятся символы химических элементов, химические формулы и уравнения.
Символы химических элементов состоят из одной или двух букв латинского названия элемента. Большинство названий и, соответственно, символов сложились исторически и присваивались непосредственно первооткрывателями этих элементов. Для недавно открытых элементов, официальное название которых еще не утвержден, используют порядковый номер элемента в Периодической системе элементов и латинские названия цифр. Так, например, элемент с порядковым номером 118 будет называться унуноктий (ун — 1 окта — 8) и символ Uuo, а элемент с порядковым номером 115 — название унунпентий (ун — 1, пента — 5) и символ Uup. Химическими символами обозначают: химический элемент; простое вещество с атомными или металлическими кристаллическими решетками (например, Al, Fe, C, Si), один атом химического элемента.
Химические формулы — это обозначение состава вещества химическими символами и индексами.
Индексы — это цифры, которые расположены справа внизу от символа химического элемента. Индекс указывает число атомов этого элемента в молекуле вещества (или ионе).
Различают несколько видов химических формул: молекулярные, эмпирические, электронные и структурные.
Молекулярные формулы (истинные формулы) отражают качественный (из атомов каких элементов состоит вещество) и количественный состав молекулы вещества.
Например, запись СО2 означает:
— В составе углекислого газа содержатся атомы углерода и кислорода;
— Одна молекула углекислого газа состоит из одного атома углерода и двух атомов Окси-гена;
— Одна молекула углекислого газа. Молекулярные формулы можно применять
только для веществ молекулярного строения. У веществ ионной или атомной строения нельзя выделить отдельные молекулы, поэтому для них применяют эмпирические формулы.
Эмпирические формулы (простые формулы) отражают качественный состав вещества и соотношение между числом атомов элементов в веществе (стехиометрические соотношения).
Эмпирические формулы применяют для веществ ионной или атомной строения, а также для отображения результатов элементного анализа веществ.
Известно, что натрий хлорид обладает ионную строение. Кристалл хлорида натрия состоит из большого количества положительно заряженных ионов натрия и отрицательно заряженных ионов хлора. Причем в кристаллической решетке каждый ион натрия окружен шестью ионами хлора, а каждый ион хлора окружен шестью ионами натрия, поэтому отдельных частиц, можно назвать молекулой натрий хлорида, выделить невозможно. Однако в кристалле соотношение между числом ионов натрия и хлора составляет 1: 1. Итак, состав хлорида натрия следует записать следующим образом: m. Но удобнее использовать эмпирическую формулу NaCl.
Эмпирические формулы также используют для отображения результатов элементного анализа. Так, если по результатам анализа ве-
вина состоит из атомов углерода и водорода в соотношении 1: 1, то для этого вещества можно записать эмпирическую формулу СН, но вещества с такой молекулярной формуле нет. Без дополнительных сведений определить, что это за вещество, невозможно, поскольку такое соотношение характерно для етину (молекулярная формула С2Н2), бензола (молекулярная формула С0Н0), циклодекапентаену (С10Н10) и т.д.. Так же эмпирическая формула СН2 характерна для всех етенових углеводородов (этен С2Н4 или бутен С4Н8), а также и для всех циклоалканов (циклопропан СаН0 или циклогексан С0Н12).
🎬 Видео
Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

8 класс. Составление уравнений химических реакций.Скачать

Уравнения химический реакций на ОГЭ: как составлять без ошибок?Скачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

ХИМИЧЕСКИЕ УРАВНЕНИЯ | Как составлять уравнения реакций | Химия 8 классСкачать

Как УРАВНИВАТЬ химические уравнения | Расстановка коэффициентов в химических реакцияхСкачать

Закон сохранения массы веществ. 8 класс.Скачать

Химические Цепочки — Решение Цепочек Химических Превращений // Химия 8 классСкачать

Химия. 8 класс. Формулы веществ и уравнения химических реакций. Сравнение активности металловСкачать

Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

Расчеты по уравнениям химических реакций. 1 часть. 8 класс.Скачать

Химические элементы и их символы. 7 класс.Скачать

Химическая связь. Формулы Льюиса. 8 класс.Скачать

Химия | Тепловой эффект химической реакции (энтальпия)Скачать