Видео:Составление уравнений реакций горения. 11 класс.Скачать

Вы здесь
Видео:Горение. 7 класс.Скачать

Пиролиз древесины
Воспламенение и горение древесины есть следствие её нагрева до высоких температур в воздухе. В холодном состоянии древесина воздухом не окисляется. При нагреве древесина термически разрушается с образованием легкогорючих веществ, которые могут воспламеняться и поддерживать дальнейшее горение древесины. Поэтому для правильного понимания процессов горения необходимо знать как термически разрушается древесина.
Первичное термическое разрушение древесины происходит внутри полена, а значит без доступа воздуха (ввиду слабой газопроницаемости древесины). Термическое разрушение древесины в инертной среде (без доступа кислорода воздуха или иных окислителей) называется термической деструкцией, термическим разложением или пиролизом. В дальнейшем мы будем для краткости пользоваться термином «пиролиз», хотя сразу оговоримся, что «pyr» по-гречески означает огонь, и поэтому точнее было бы понимать под термином «пиролиз» разрушение в огне (то есть при горении в кислороде), а не разрушение в инертном газе. Так, например, в лесоведении «пирологией» называют науку о лесных пожарах и и вызываемых ими изменениях в лесу.
При нагревании древесины без доступа воздуха (такой процесс называется «сухой перегонкой») сначала при температурах 100-150°С происходит полное испарение всей свободной и связанной (гигроскопической) воды, затем при 150-275°С происходит начальный пиролиз с потреблением теплоты. При температурах 275-450°С происходят главные реакции распада веществ древесины, причём с бурным выделением тепла (с саморазогревом древесины). Наконец, при 450-550°С происходит последняя стадия пиролиза, требующая подвода теплоты извне и заканчивающаяся образованием древесного угля, сохраняющего анатомическое строение древесины. Промышленный древесный уголь по ГОСТ 7657-84 имеет «кажущуюся» (в воде) плотность 370 кг/м³, насыпную плотность после размола 210 кг/м³, температуру воспламенения 340°С, НКПВ пыли 128 г/м³, ПДК пыли 6 мг/м³. Древесный уголь в форме реальных «углей» (в виде обугленного слоя на древесине) имеет плотность 190 кг/м³, насыпную плотность (104-180) кг/м³, коэффициент теплопроводности 0,074 Вт/м•град. В результате всего цикла пиролиза образуется древесный уголь, жижка и горючие газы. Жижка при отстаивании разделяется на два слоя — верхний водный и нижний смоляной. Из водного слоя впоследствии выделяют уксусную кислоту, метиловый спирт, ацетон и другие продукты. Из смоляной части выделяют дёготь, жидкие топлива, антисептик креозот, которым пропитывают железнодорожные шпалы. Выход углей, жижки и газов составляет по массе соответственно 33%, 52% и 15% для берёзы и 38%, 44% и 18% для сосны.
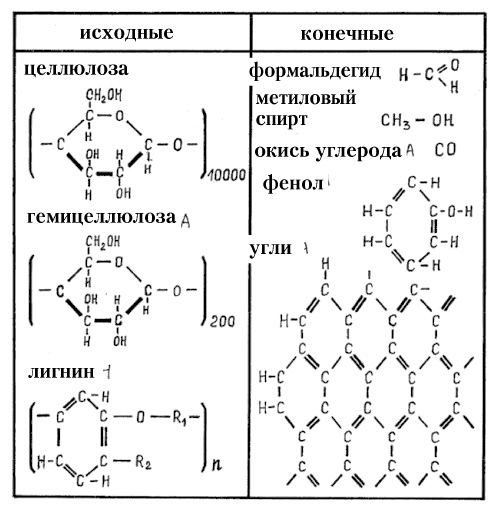 |
| Рис. 92. Химическая структура древесины и некоторых продуктов пиролиза (исходные и конечные продукты пиролиза древесины). Состав гимицеллюлозы приведён для гексозной части (пентозная часть содержит в кольце 5 углеродных атомов). |
Древесина состоит из трёх типов натуральных полимеров — длинноцепной целлюлозы, короткоцепных гемицеллюлоз (пентоз из пятичленных колец и гексоз из шестичленных колец) и лигнина, состоящего из бензольных колец (рис. 92). Пиролиз любых органических соединений идёт через разукрупнение (дробление, деление, разрыв, крекинг) молекул (и цепей молекул) с отделением кислородных соединений углерода, летучих углеводородов, молекул водорода и воды. Одновременно идёт агрегация углеводородных остатков в углерод через формирование бензольных колец C 6 H 6 (рис. 92), которые объединяются в двойные бензольные кольца (нафталиновые), затем в тройные (антраценовые) и так далее вплоть до сеток колец (микрокристаллов графита, а также высших непредельных углеводородов CnHm). При пиролизе твёрдых углеводородов образуется кокс (в случае каменного угля) или древесный уголь (в случае древесины). При пиролизе углеводородных газов (метана, пропана и т. п.) и паров углеводородных жидкостей (бензина, керосина, бензола и т. п.) образуется газовзвесь мелких углеродных частиц (чёрный дым), при осаждении дающая сажу (копоть). В любом случае образуется углерод в так называемой аморфной форме — в виде микрокристаллического (рентгеноаморфного) графита, имеющего связи с С-Н, а потому легковоспламеняющегося. Наибольшее дымление даёт лигнин (которого очень много в коре берёзы), но лигнин даёт и в 1,5 раза больше тепла при сгорании, чем целлюлоза.
Считается, что пиролиз начинается с пентозной части гемицеллюлоз и лигнина. Наибольшую вероятность обугливания имеет лигнин, поскольку он уже содержит в своём составе бензольные кольца (рис. 92). В этом легко убедиться. Достаточно положить на разогревающуюся чугунную плиту дровяной печи (или комфорку кухонной электроплиты) оразец древесины (например, обычную осиновую спичку без головки) и образец материала из практически чистой целлюлозы — хлопка, льна, бумаги (непроклееных сортов, например, туалетной). Хлопок (в виде ваты или марли) начинает буреть при 220-240°С (именно поэтому максимальная стандартная температура утюгов устанавливается равной 220°С). Выделяющихся горячих газов глазами не видно, поскольку они абсолютно прозрачны и бесцветны (как воздух) вплоть до плазменных температур 5000-7000°С, а химических реакций горения, которые могли бы окрасить газ, пока нет (температуры самовоспламенения газов превышают 450°С). При температурах 320-340°С хлопок начинает чернеть и комкуется (сжимается), над хлопком появляется белый дымок — это пары выделяющихся труднокипящих жидкостей конденсируются в холодном воздухе, превращаясь в туман. Самовоспламенение в виде появления тления обугленного остатка наблюдается при температуре выше 440°С. Древесина (осиновая спичка) начинает буреть уже при температурах 180-190°С, начинает выделяться белый дымок (туман жидкостей) при 230-250°С, а при 300°С становится абсолютно чёрной с полным сохранением исходной формы спички. Это указывает, что сажа от разложения лигнина оседает на каркасе целлюлозы. Поскольку именно лигнин вызывает раннее выделение горючих газов и сажи, удаление лигнина гидролизом снижает пожароопасность и дымление древесины. Так. известно, что некоторые народы в древности для обогрева курных помещений использовали именно вымоченный в реке, а затем тщательно высушенный хворост.
Процессы пиролиза, как правило, завершаются при нагреве древесины до 500-600°С. Но если продукты пиролиза заключить в герметичную ёмкость (бомбу) и нагреть их до более высоких температур, то состав продуктов пиролиза изменится. Этот факт очень важен для анализа процессов горения, поэтому вкратце остановимся на основных особенностях вторичного пиролиза. Во-первых, жидкие и газообразные продукты первичного пиролиза разрушаются до простейших соединений (Н₂O,СO₂, СО, Н₂ и т. п.) и добавочного количества углерода как в форме древесного угля, так и в виде сажи (в том числе и в виде дыма). При этом даже метан образует сажу именно через бензольные кольца. Во-вторых, древесный уголь (углерод) начинает газифицироваться — реагировать с водяными парами С+Н₂О ↔ CO+H₂. Количество воды в продуктах пиролиза очень велико, что видно хотя бы из того, что балансовую химическую формулу целлюлозы и гемицеллюлозы (С6Н10О5) можно представить в виде (С6(Н20)5)n, то есть комбинации (смеси) углерода и воды (поэтому целлюлозу называют углеводом). Приведём расчётный состав продуктов реакции газификации углерода в синтез-газ С+Н₂О→СО+Н₂ в условиях атмосферного давления газовой фазы рₒ=р(Н₂О)+р(СО)+р(Н₂) =1 атм, где р(Н₂О), р(СО) и р(Н₂) — парциальные давления водяных паров, окиси углерода (угарного газа) и водорода соответственно:
| Температура, °С | 700 | 800 | 900 | 1000 | 1100 |
| Температура, °K | 973 | 1073 | 1173 | 1273 | 1373 |
| р(Н₂О) в % об. (10⁻² атм) | 90,66 | 65,94 | 29,38 | 8,1 | 2,08 |
| р(СО) в % об. (10⁻² атм) | 4,67 | 17,03 | 35,31 | 45,95 | 48,96 |
| р(Н₂) в % об. (10⁻² атм) |
Приведённые численные данные могут быть легко перечитаны на другие давления газовой среды рₒ, исходя из соотношений равновесия p(C) •p(H₂O) = K₁(T) •p(CO) •p(H₂0), где р(С) — давление паров углерода (зависит только от температуры), K₁(T) — коэффициент равновесия реакции (зависит только от температуры), р(СО) = р(H₂O). При этом можно показать, что p(H₂O)/p(CO) = A₁(f₁(T)pₒ)¹/², где f₁(T) = K₁(T)/p(C), A₁ — коэффициент пропорциональности. Таким образом, снижение давления ро (то есть уменьшение количества воды) приводит к сдвигу реакции вправо (то есть к более высокому преобразованию Н₂О в СО).
В-третьих, древесный уголь (углерод) начинает газифицироваться в ходе реакции С+СО₂ ↔ 2СО. Приведём расчётный состав продуктов реакции при давлении газовой среды рₒ = р(СО₂)+(СО)=1 атм:
| Температура, °С | 600 | 700 | 800 | 900 | 1000 | 1100 | 1200 |
| Температура, °K | 873 | 973 | 1073 | 1173 | 1273 | 1373 | 1473 |
| р(CO₂) в % об. (10⁻² атм) | 99,86 | 98,38 | 90,05 | 64,7 | 27,2 | 8 | 2 |
| р(СО) в % об. (10⁻² атм) | 0,14 | 1,62 | 9,95 | 35,3 | 72,8 | 92 | 98 |
Пересчёт на другие давления ведётся по соотношениям р(С)р(СО₂)=K₂(Т)р²(СО), f₂(T)=K₂(T)/p(C). При этом р(СО₂)/р(СО) =A₂(f₂(T)pₒ)¹/², то есть снижение давления рₒ сдвигает реакцию вправо. В целом, реакция углерода с СО₂ (углекислым газом) начинается примерно при температурах на 100°С выше, чем реакция с Н₂О (водой), а учитывая, что воды в продуктах пиролиза намного больше, чем углекислого газа, то реакция газификации водой является ведущей.
Продукты высокотемпературного «вторичного» пиролиза, состоящие преимущественно из СО и Н₂, называются синтез-газом или газогенераторными газами. Такие газы вырабатывались в первой половине XX века в огромных масштабах для лесохимических производств, отопления, а также для использования в качестве топлива в двигателях внутреннего сгорания. До сих пор часто вспоминают довоенные советские грузовики-полуторки с бортовыми газогенераторами, вырабатывавшими для своего двигателя горючий синтез-газ из древесных чурок длиной сантиметров десять, которые по государственному план-заказу (разнарядке) заготавливались колхозами в огромных количествах.
Характер термического разрушения древесины при температурах ниже 300-350°С практически не зависит от того, в инертной среде или воздушной ведётся нагрев древесины. При более высоких температурах уже возможны процессы дополнительного окисления свободным кислородом C n H m O k +O₂ ® СО₂+Н₂О, в том числе аморфного углерода по реакции С+О₂ ® CO₂. Пиролиз называется окислительным в том случае, когда количество вводимого кислорода настолько мало, что теплота окисления остаётся намного меньшей, чем подвод тепла для пиролиза извне. Если же количество подводимого кислорода уже начинает обеспечивать большую величину теплового эффекта окисления, то окислительный пиролиз приобретает название горения.
В заключение напомним, что сухая безводная окись углерода СО (угарный газ) практически не реагирует с кислородом О₂ до температуры 700°С. Выше 700°С протекает медленная гетерогенная реакция, то есть реакция идёт не в объёме, а с первоначальной сорбцией СО на поверхности твёрдых материалов. Причём некоторые вещества способны существенно снизить температуру окисления СО (например, в составе катализаторов для очистки выхлопных газов автомобилей от угарного газа). На скорость окисления углерода сильно влияет присутствие даже небольших количеств водяного пара или водорода, при этом реакция может стать даже гомогенной (в объёме) вне поверхностей твёрдых материалов.
Видео:Уравнивание реакций горения углеводородовСкачать

Строим русскую баню по уму
Видео:Реакции горенияСкачать

Как горят дрова
Просмотров: 6 652

Понимание того, что из себя представляет процесс горения дров и возможность регулирования величины извлекаемого при этом тепла и наиболее эффективного его использования, позволяет осознанно делать выбор в пользу той или иной модели банной печи.
Итак, рассмотрим химические и физические основы процесса горения древесного топлива, который происходит в топливнике любой банной печи.
Но сначала кратко коснемся вопроса строения древесины как топлива.
Древесина представляет собой комбинацию углеводородных соединений (полимеров-полисахаридов) целлюлозы, гемицеллюлозы и лигнина. В зависимости от породы и условий произрастания дерева содержание этих компонентов колеблется в следующих пределах: целлюлоза 39-58%, гемицеллюлоза 15-38%, лигнин 17-34%.
Любая абсолютно сухая (не содержащая воды) древесина состоит из углерода С (49-50%), кислорода О (43-44%), водорода Н (
6%), азота N (0,1-0,3%) и ряда неорганических веществ (кальция Са, натрия Na, магния Mg, кремния Si, калия K и др.) в количестве 0,1-1%, дающих при сжигании древесины золу.
Общую химическую формулу древесины, условно, можно представить в виде (СnНmОk)r, где С, Н и О – совокупность молекул и атомов углерода С, водорода Н и кислорода О.
Если древесину начать нагревать, то составляющие ее органические полимеры разрушаются на более простые компоненты. Такими компонентами являются:
— газы (кислородные соединения углерода (СnОm): углекислый газ СО2, окись углерода СО (угарный газ), различные летучие углеводороды СnНm (в т.ч. метан СН4, этилен С2Н4), молекулы водорода Н2 и кислорода О2;
— углерод С в виде древесного угля или сажи. Древесный уголь образуется в виде углеродной кристаллической сетки с сохранением анатомического первоначального строения древесины. Сажа представляет собой разновидность углерода С, образующегося при неполном сгорании углеводородов (в нашем случае древесины). Частицы сажи образованы из слоев углеродных атомов, подобных слоям углерода в графите. Однако в данном случае слои, состоящие из атомов углерода, имеют не плоскую как в графите, а сферическую форму. Эти слои состоят из шестиугольников, в вершинах которых находятся атомы углерода С, некоторые из которых имеют связи с атомами водорода Н (С-Н), а потому легковоспламеняющиеся;
— жидкий субстрат, получивший название «жижки».
Жижка – это смесь различных жидких органических веществ, основными компонентами которого являются вода Н2О, уксусная кислота СН3СООН, древесный (метиловый) спирт СН3ОН и различные смолы, альдегиды, фенолы и кетоны (деготь, креозот, формальдегид, фенол и т.д.).
Так, например, выход углей, жижки и газов составляет по массе соответственно 33%, 52% и 15% для березы и 38%, 44% и 18% для сосны.
Отметим тот факт, что характер термического разрушения древесины, состав и количество образующихся при этом компонентов при температурах ниже 300-350ºС не зависит от того происходит ли нагрев древесины в присутствии кислорода или нет.
Однако, при температурах нагрева более 400ºС количественный и качественный (по теплотворной способности) состав образующихся соединений уже будет определяться температурой нагрева древесины.
Этот факт демонстрируют данные Табл.2.32 , отражающие состав образующихся газов в результате термического распада древесины в условиях отсутствия воздуха (при пиролизе).
Из таблицы видно, что с повышением температуры нагрева древесины выход горючих компонентов (Н2, СН4 и СО) увеличивается. Возрастает и теплотворная способность продуктов термического распада древесины.
Все эти химические соединения (кроме углекислоты СО2, азота N2 и воды Н2О) имеют способность к горению, то есть способность при определенных условиях (концентрации, температуре) вступать в реакцию с кислородом О2, содержащимся либо в других продуктах термического распада древесины, либо в воздухе.
По своей сути процесс горения дерева как твердого топлива, состоящего из молекул углерода С, водорода Н2 и кислорода О2 представляет собой совокупность реакций окисления кислородом воздуха О2 твердой, жидкой и газообразной составляющих древесины, выделяемых древесиной при ее термическом распаде.
Процесс горения (окисления) сопровождается выделением тепла и лучистой энергии.
Вначале при нагреве древесины до температур 100-150ºС происходит испарение всей содержащейся в древесине воды. На этом этапе дерево активно поглощает теплоту извне. Процесс горения отсутствует.
При температурах 150-275ºС начинается процесс распада исходной структуры древесины на более простые твердые, жидкие и газообразные составляющие (окись углерода СО, углекислый газ СО2, метан СН4, древесный спирт (метанол) СН3ОН, уксусную кислоту СН3СООН, креозот-смесь фенолов и ароматических углеводородов). Дерево продолжает активно поглощать тепло. Горение отсутствует.
При температурах 275-450ºС начинается процесс активного разложения и упрощения структуры древесины с бурным выделением тепла, газообразных горючих и саморазогревом древесины. Начинается распад целлюлозы и лигнина. На этом этапе становится возможным вступление в реакцию продуктов термического разложения древесины с кислородом. Начинается окислительный процесс, который визуально может проявляться либо в виде тления обугливающейся древесины, либо в виде пламенного горения выделяемых древесиной газообразных летучих веществ.
С дальнейшим повышением температуры нагрева древесины от 450ºС до 550ºС процесс разрушения ее начальной структуры продолжается, но тепло при этом уже не выделяется, а поглощается.
К температуре 600ºС, в основном, заканчивается процесс термического разложения древесины на твердую, жидкую и газообразную составляющие.
Теперь перейдем к рассмотрению процесса горения дров.
Сущностью процесса горения является соединение горючих компонентов вещества с кислородом, сопровождающееся интенсивным выделением тепла и резким повышением температуры продуктов сгорания.
Соединение горючих компонентов древесины с кислородом происходит только при вполне определенных температурах, как правило, превышающих 300-350ºС.
Горючими веществами при термическом распаде древесины являются углерод C (в виде древесного угля или сажи), различные углеводородные соединения СnНm (например, метан СН4, этилен С2Н4), окись углерода СО (угарный газ), углекислый газ СО2 и водород в виде Н и Н2.
Продуктами полного сгорания веществ (в дальнейшем теряющих способность к окислению кислородом О2) являются двуокись углерода (углекислый газ) СО2 и вода Н2О.
Все горючие вещества могут вступать в реакцию с кислородом с выделением большого количества тепла.
Кислород для окисления продуктов термического распада древесины берется не только из окружающего воздуха, но и из самих продуктов распада, содержащих кислород. Такими продуктами, поставляющими кислород для горения, являются углекислота СО2 и вода Н2О.
Как уже упоминалось выше, древесина состоит из различных по длинне полимерных цепочек целлюлозы, гемицеллюлозы и лигнина. Условно балансовую химическую формулу целлюлозы и гемицеллюлозы можно записать в виде [С6Н10О5]n. Ее же, условно, можно представить в виде [С6(Н2О)5]n, то есть комбинации углерода С и воды Н2О. Поэтому целюлозу часто называют углеводом.
Образование основных горючих (С, СО, Н2) при нагреве древесины происходит следующим образом.
Процесс горения рассмотрим на примере горения одиночной деревянной доски (некрупного полена).
Начнем нагревать доску (полено) с какой-то одной стороны, например, положив ее (его) на слой тлеющих углей.
По мере нагрева, подвергающаяся тепловому воздействию сторона доски (полена) начнет буреть, а затем и темнеть (обугливаться). Обугливание начинается с мелких заусениц на поверхности доски (полена).
Однако устойчивого пламени еще не наблюдается. Только изредка местами начинают наблюдаться небольшие язычки пламени голубого цвета.
Это свидетельствует о том, что начинается процесс выделения из нагретой древесины горючих газов и вступление их в реакцию с кислородом воздуха. Такими газами являются простейшие вещества: окись углерода СО, различные спирты (например, метиловый (древесный) спирт СН3ОН), пары формальдегида СНОН в небольшом количестве и в смеси с воздухом.
При дальнейшем нагреве обугливающийся слой на нагреваемой стороне доски (полена) начинает тлеть. Из торцов доски (полена) начинает выделяться бело-бурый дым. Этот дым является конденсатом в воздухе начавшегося выделения древесиной паров жижки (смеси паров креозота, фенола, уксусной кислоты).
Наконец на границе с кромкой доски (полена) бело-бурый дым воспламеняется и возникает светло-желтое пламя. Это пламя устойчиво и не пропадает. Появление пламени свидетельствует о том, что в реакцию окисления с кислородом воздуха вступили газообразные горючие компоненты термического распада древесины.
И если доску (полено) перестать греть внешним источником тепла, то процесс начала горения древесины не прервется.
Горение может попеременно переходить то в тлеющий режим, то в пламенный.
Данные режимы горения дерева тесно связаны между собой, но отличаются протекающими при этом процессами.
В режиме тления древесины ведущим является процесс горения углей (углерода С).
В режиме пламенного горения ведущим является горение газообразных летучих продуктов термического разложения древесины.
В режиме тления газообразные горючие продукты выделяются медленно и в малых количествах. Они не могут создать необходимую для воспламенения концентрацию летучих веществ. Поэтому охлаждаются и конденсируются в воздухе в виде бело-бурого дыма.
Таким образом, горение древесины обычно начинается с тления – возгорания углей (углерода С) обугленного слоя.
При формировании на поверхности древесины угольного слоя толщиной 1-3 мм и повышения температуры слоя до 300-350ºС поверхность углей самовоспламеняется.
Это говорит о том, что угли вступили в реакцию окисления кислородом воздуха (С+О2=СО2) с выделением энергии и нагревом поверхности углей до 1000—1200ºС.
В результате этого обугленная поверхность доски начинает светиться и разрушаться под действием выделяемого тепла.
При этом возникает мощный тепловой поток внутрь древесины.
Внутренние слои древесины доски начинают разлагаться под действием высокой температуры.
При этом начинается процесс образования газообразных горючих продуктов (летучих: Н2, СО, СnНm) и их выход наружу горящей древесины.
Если горючие летучие проходят через тлеющий угольный слой, то они там и сгорают (превращаются в СО2 и Н2О).
Если же летучие выходят через не обугленные поверхности доски, тогда они проявляются в виде бело-бурого дыма.
Скорость сгорания углей в режиме тления ограничивается скоростью диффузии молекул кислорода воздуха в зону горения.
Если на тлеющую поверхность углей подуть, то угли начнут разгораться за счет поступления большего количества кислорода в зону горения. При этом скорость потребления кислорода горящими углями уже будет определяться не скоростью подвода (диффузии) молекул кислорода в зону горения, а скоростью протекания реакции С+О2=СО2.
Скорость горения угля возрастает многократно и сопровождается огромным количеством выделяемого тепла и количеством выделяемых еще необуглившейся древесиной летучих.
Эти летучие не успевают сгореть внутри обугленного слоя, выходят наружу древесины и сгорают в виде пламени.
Поверхность обугленного слоя древесины оказывается полностью окутанной выходящими газами (СО, СО2, Н2О), в которых нет избытка свободного кислорода.
Поэтому процесс окисления угольного слоя прекращается (прекращается реакция С+О2=СО2), а только продолжается процесс термического разрушения новых слоев древесины вплоть до того момента, пока вся доска полностью не превратиться в целый кусок древесного угля. При этом продолжается процесс выхода летучих, окисление их кислородом воздуха в виде ярко-желтого пламени.
Если же на тлеющий слой углей подуть очень сильно, то вместо перевода тлеющего режима в режим пламенного горения мы можем получить противоположный результат, то есть потушить тлеющую древесину.
Объясняется это тем, что увеличивая поток воздуха, мы не только увеличиваем подачу кислорода в зону горения, но и охлаждаем одновременно сами угли. Происходит это ввиду как невысокой температуры подаваемого воздуха, так и снижение температуры горючих газов при избытке подаваемого для горения воздуха.
Количество необходимого для горения воздуха принято характеризовать так называемым стехиометрическим коэффициентом ά=Gп/Gт, где Gп и Gт – подаваемый в топку и требуемый для реакции горения объем воздуха, соответственно. В случае, когда α=1 количество подаваемого для горения воздуха Gп равно количеству требуемого для проведения реакций полного окисления дров воздуха Gт.
В этом случае получается самая высокая температура продуктов горения порядка 2000ºС.
Чем больше значение α>1 (чем больше относительно требуемого количества количество подаваемого для горения воздуха), тем ниже температура продуктов сгорания топлива. Так при α=2 температура продуктов сгорания понижается до
1500ºС, при α=3 температура продуктов сгорания понижается до
900ºС, а при α=5 температура продуктов сгорания понижается уже до
Поэтому для ускорения перевода режима тления в режим пламенного горения древесины мы должны плавно повышать не только количество, но и скорость воздушного потока так, чтобы температура поверхности углей непрерывно повышалась.
В любом случае при достижении режима, когда скорость горения определяется скоростью протекания реакции окисления (например, С+О2=СО2), а не скоростью подвода к зоне прохождения реакции кислорода О2 воздуха, увеличение концентрации кислорода уже не способствует ускорению реакции окисления. В этой ситуации уже необходимо повышать температуру углей, то есть уменьшать тепловые потери зоны горения.
Одним из способов, которым можно повысить температуру в зоне горения, является размещение рядом с горящей доской (поленом) еще пару-тройку таких же горящих досок (поленьев).
В этом случае эти доски (полешки) будут греть друг дружку в местах соприкосновения, повышая в этих местах температуру и снижая тепловые потери.
Но вернемся вновь к процессу горения одиночной доски (полена).
После того как доска полностью превратится в кусок древесного угля (т.е. в чистый углерод С с сохранением начальной анатомической структуры древесины), прекратиться и выход летучих веществ.
Окрашенное летучими в желтоватый цвет пламя исчезает.
Раскаленная поверхность древесного угля вновь может контактировать с кислородом воздуха и горение углей продолжается (возобновляется протекание реакции С+О2=СО2), но без пламени.
Этот режим очень похож на режим тления, но отличается тем, что в этом режиме пламени не возникает, так как все летучие горючие древесиной уже выделены и сгорели в воздухе в виде пламени.
На этом этапе скорость сгорания углей вновь определяется скоростью диффузии кислорода из воздуха во внутрь углей в зону горения.
Начиная с этапа пламенного горения летучих температура нагрева древесины, как правило, уже достигает температур порядка 600ºС.
При нагреве до температур Т≥600ºС углерод обугленного слоя C вступает в реакцию с водой Н2О, которая в избытке образуется, как при термическом разложении древесины (см. условную формулу целлюлозы выше), так и при испарении содержащейся в древесине воды. Начинается газификация углерода C древесины парами воды Н2О с образованием смеси газов СО2, СО и Н2 (С+2Н2О —› СО2+2Н2 и С+Н2О —› СО+Н2), часть из которых горючи (СО, Н2). Смесь газов СО+Н2 получила название синтез-газа («водяного» газа).
Количественный выход окиси углерода СО (угарного газа) и водорода Н2 в результате такой реакции зависит от температуры, при которой проходит реакция. С повышением температуры выход СО и Н2 повышается. Так, если при температуре 700ºС выход СО и Н2 составляет по 4,67% об. (объемных процента), то при Т=900ºС выход СО и Н2 составляет уже по 35,31% об., а при Т=1100ºС – по 49% об.
Помимо воды углерод С может вступать также в реакцию и с углекислотой СО2 с образованием горючего угарного газа СО: С + СО2 —› СО. Проходит обратная реакция восстановления углекислого газа СО2, который гореть не может, в окись углерода (угарный газ) СО. Окись углерода СО способна вновь окисляться кислородом воздуха, т.е. гореть. Однако, реакция С + СО2 —› СО, в основном, может протекать только при наличии в зоне горения температуры порядка 1100—1150ºС. При более низкой температуре выход окиси углерода является очень незначительным. Так при Т=700ºС количественный выход окиси углерода СО в результате протекания такой реакции составляет лишь 1,62% об., тогда как при Т=1100ºС выход СО составляет 92% об.
Образующиеся при термическом нагреве древесины горючие газы сгорают по-разному, в зависимости от того смешаны ли они с воздухом предварительно или не смешаны.
Горючие летучие газообразные углеводороды (метан СН4, этилен С2Н4 и другие газы СnНm), и углеводороды в виде капельно-жидкой фракции (фенолы, смолы, масла, кислоты) при предварительном смешении с воздухом и температурах Т>400ºС вступают в реакцию с кислородом воздуха с бурным выделением тепла при этом. В результате последовательных превращений эти горючие летучие через ряд своих промежуточных окисленных форм в конце концов превращаются в углекислый газ СО2 и воду Н2О. Температура в зоне горения при этом, как правило, превышает 1200ºС.
Реакция сопровождается выделением большого количества тепла и наблюдается в виде прозрачного пламени голубоватого цвета. Цвет пламени придают, находящиеся в зоне горения молекулы углерода С2, излучающие на длинах волн 0,5-0,52 мкм и частицы СН, излучающие на длине волны 0,43 мкм.
Однако если кислорода воздуха не хватает для полного окисления выделяемых термически разлагающейся древесиной газообразных летучих (углеводородов вида Н(С-Н)) в этом случае данные горючие углеводороды покидают горящую древесину в виде сажистых частиц Н(С-Н). Раскалившись до 1200ºС эти частицы придают пламени светло-желтый цвет. Причем, чем больше таких частиц, тем краснее цвет пламени.
Именно такое светящееся пламя мы наблюдаем в печах при горении дров.
Если же сажистые частицы по каким-либо причинам не сгорают до конца (ввиду нехватки кислорода, охлаждение зоны горения), тогда в этом случае они укрупняются и превращаются из светящихся языков пламени в черный дым (поток дымовых газов с большим содержанием сажистых частиц Н(С-Н)).
Но помимо газообразных летучих, из нагреваемой древесины выделяются летучие в виде капельно-жидкой фракции (различные фенолы, масла, кислоты, смолы, креозота). Данные летучие, если они не успели испариться (перейти в газообразное состояние в виду пониженной температуры в местах их выхода из древесины), термически разложиться до элементарных состояний (С, Н, СО) и окислиться кислородом воздуха (в виду его не хватки), то в этом случае такие летучие выходят в трубу в виде бело-бурого дыма.
Физика этого явления такова.
Например, при температурах нагрева 150-300ºС выделяемые древесиной пары креозота (ввиду малой своей концентрации) не могут воспламеняться, конденсируются в воздухе в виде тумана (капелек) и аэрозолей (твердых частиц с размерами 0,3-5,0 мкм) и в виде белого дыма покидают зону нагрева.
Но может быть случай, когда пары креозота разлагаются от термического нагрева другими горючими газами, выделяемые горящей древесиной, с образованием сажи.
В этом случае сконденсированные пары креозота вперемешку с частицами сажи черного цвета окрашивают белый дым в бурый цвет.
Другими словами, при нехватке кислорода прозрачное голубое пламя, образующееся при полном сгорании летучих углеводородов, начинает светиться желтым цветом разных оттенков, а при определенных условиях и коптить.
Копоть указывает на наличие (появление) в воздухе неокисленного углерода (вида С и Н(С-Н)).
Чем больше несгоревших сажистых частиц, тем больше красного оттенка в желтом цвете пламени.
Вне зоны пламени сажистые частицы проявляются в виде черного дыма.
Само пламя представляет собой оконтуренную свечением внешнюю оболочку, создаваемую в пространстве горящими летучими при горении древесины.
Внутри этой оболочки находятся раскаленные летучие, а вне оболочки – воздух.
Реакции окисления летучих (СО, Н2) кислородом воздуха происходит в тонком граничном слое, ограничивающем светящуюся область.
Скорость протекания реакций окисления в этом слое лимитируется скоростью диффузии кислорода воздуха к этой зоне снаружи.
Поэтому крайне важно для обеспечения полного сгорания летучих обеспечить подачу в область, граничащую с пламенем, необходимое количество кислорода.
Другими словами, если наблюдается факел пламени, это значит, что горючие газы и воздух разделены оболочкой, и в эту оболочку факела кислород из воздуха поступает ограниченно, со скоростью, лимитируемой скоростью диффузии атомов кислорода.
Процессы горения могут быть выражены с помощью химических уравнений, показывающих, в каких соотношениях и как взаимодействуют отдельные вещества.
Горение древесины, условно, можно представить в виде уравнения:
[С6Н10О5]n+bO2= dС(атомарный углерод, сажа)+kСО(угарный газ)+lCO2(углекислый газ) + qH2O(водяной пар)+тепло. (1)
Заметим, что для поддержания реакции горения необходимо, чтобы выделяющегося из горящей порции дров тепла (как минимум) хватало бы как для завершения полноты сгорания выделяющихся из дерева газов, так и для нагрева до температуры выделения горючих газов из следующей закладки дров.
При горении древесины протекают следующие реакции.
Контактируя с раскаленным углем, нагретым до температур Т≥400ºС, пары воды газифицируют уголь с образованием горючих смесей СО2+2Н2 и СО+Н2 (2Н2О+С —› СО2+2Н2 и Н2О+С —› СО+Н2). Причем реакция Н2О+С —› СО+Н2 протекает при температурах более 600ºС.
Данные реакции сопровождаются поглощением тепла:
С + Н2О = СО+Н2 – тепло (реакция протекает при Т>600ºС); (2)
С + 2Н2О = СО2+2Н2 – тепло (реакция протекает при Т>400ºС). (3)
При температурах Т>700ºС начинается реакция восстановления углекислого газа СО2 в окись углерода СО — вещество, способное гореть, т.е. вступать в реакцию с кислородом. Тепло при этом также поглощается:
С + СО2 = 2СО — тепло (реакция протекает при Т>700ºС). (4)
Напомним, что глубина преобразования СО2 в СО в уравнении (4) повышается с повышением температуры и при 1100ºС достигает глубины 92% об.
Все перечисленные реакции (2), (3), (4) сопровождаются поглощением тепла.
При температурах Т
320-350ºС начинается процесс горения (окисления кислородом воздуха О2) углерода с выделением большого количества тепла. Углерод С, содержащийся в древесине, может сгорать либо полностью с образованием углекислоты СО2
С + О2 = СО2 + 8080 ккал/кг С, (5)
либо сгорать не полностью с образованием окиси углерода СО
С + 0,5О2 = СО +2410 ккал/кг С. (6)
При температурах Т=320 — 700ºС преобладает реакция (5), а при Т>700ºС преобладает реакция (6). При температурах Т>1000ºС взаимодействие углерода С древесины с кислородом О2 протекает только по реакции неполного сгорания углерода (6).
Помимо этого идут реакции:
Н + Н = Н2 +104 ккал/моль Н (7)
О + О = O2 +117 ккал/моль О (8)
Образовавшиеся синтез-газ СО+Н2 (уравнение (2)) и углекислота СО (уравнение (6)), вступая в реакцию с кислородом воздуха O2, в свою очередь, дают:
2CO+O2 = 2CO2+3018 ккал/м³СО
(реакция протекает при Т>700ºС, в присутствии катализатора, например паров воды), (9)
2H2 +O2 = 2H2O + 2579 ккал/м³Н2 (реакция протекает при Т>300ºС). (10)
Надо отметить, что скорость реакции (6) выше скорости реакций (7) и (8). А это приводит к избытку свободного водорода Н2 и недостатку кислорода O2 для завершения процесса полного сгорания (окисления) всех образовавшихся при этом компонентов (в т.ч. и синтез-газа).
Чтобы значительно увеличить скорость реакций (8) и (9) необходимо в зону горения подвести дополнительный объем кислорода воздуха. К тому же, очень желательно, чтобы этот дополнительный («вторичный») воздух был предварительно нагрет с целью недопущения снижения температуры в зоне горения, при которой протекание реакций окисления горючих газов может прекратиться.
В условиях нехватки кислорода протекание реакции (6) так же становится не возможной. Это влечет за собой образование частиц сажи Н(С-Н), оседание их на внутренних поверхностях печи, снижение теплопроводности и теплоотдачи этих поверхностей, закоксовывание дымовых каналов, повышение пожароопасности печи.
В идеале, через печную трубу в атмосферу должны выбрасываться только азот N2, как основная составляющая подаваемого в топку печи воздуха вместе с кислородом, но не принимающего участия в горении, углекислый газ СО2 и водяные пары Н2О.
Как уже упоминалось ранее продуктами реакции полного сгорания дров являются углекислота СО2 от сгорания углерода и водяные пары Н2О от сгорания водорода.
В качестве же балластных газов выступают водяные пары топлива Н2О, выделяемые древесиной при нагреве, азот N2, а также избыточный воздух.
Продукты реакции горения и балластные газы участия в горении не принимают. Они только нагреваются за счет теплоты сгорания выделившихся из нагретых дров углерода С и водорода Н. Или, если сказать другими словами, эти газы играют при горении отрицательную роль. Они охлаждают зону горения, препятствуют полноте протекания реакций окисления горючих компонентов древесины до превращения их в конечные продукты СО2 и Н2О, снижают нагрев печи, в конечном итоге определяют теплосодержание продуктов сгорания топлива.
Итак, подведем черту.
Мы рассмотрели физические и химические основы процесса горения углеводородного топлива, каковым является древесина.
Определили, что основной целью сжигания дров в печи является полнота их сжигания и максимальное использование выделившийся тепловой и лучевой энергии. Другими словами, с целью улучшения процесса горения топлива в печи, требуется достичь таких условий его горения, при которых обеспечивается полнота протекания всех перечисленных рассмотренных в настоящей статье реакций и нейтрализация вредного воздействия балластных газов и продуктов горения.
Достижение таких условий возможно только в печах, внутреннее пространство по сжиганию дров и движению дымовых газов которых спроектировано и исполнено с учетом вышеизложенных особенностей процессов горения древесины.
Всем, кому показалась интересной и полезной изложенная здесь информация, а также тем, кто интересуется кирпичными банными печами, предлагаю совершенно бесплатно получить в свое распоряжение электронную книгу, посвященную азам кладки двух моделей кирпичных банных печей, разработки Игоря Кузнецова. Кликайте СЮДА и забирайте книгу!
Ну а тем, кто хочет самостоятельно и со знанием дела сложить в своей персональной семейной бане хорошую, апробированную практикой современную кирпичную банную печь, рекомендую заглянуть СЮДА. Там вы в обязательном порядке подберете для себя кирпичную банную печь, которая полностью удовлетворит ваши возлагаемые на банную печь надежды! 🙂
Всего доброго!
До новой встречи на страницах этого блога!
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Горение древесины
В процессе горения древесины наблюдаются следующие явления.
При поднесении пламени древесина воспринимает теплоту и нагревается, а при температуре 110° происходит высушивание ее и незначительное выделение летучих веществ. Около 130° начинается разложение древесины. Интенсивное разложение ее с изменением цвета происходит при температуре более 150°. При 200° и более начинает разлагаться главная составная часть древесины — клетчатка. Образующиеся при этом газы являются горючими, так как они содержат большое количество окиси углерода, углеводороды, водород и пары органических веществ. Если нагрев производится пламенем, то получающиеся газообразные продукты разложения воспламеняются при соприкосновении с ним, и с этого момента начинается процесс горения древесины. Таким образом, при нагревании древесины пламенем горение начинается с воспламенения газообразных продуктов разложения.
Горение древесины состоит из двух стадий: пламенное горение газообразных продуктов разложения и беспламенное горение угля. Решающей в развитии пожара является стадия пламенного горения древесины. Она занимает более короткий промежуток времени и связана с выделением большого количества тепла. Температура продуктов горения при ней более высокая, чем в стадии горения угля. Уголь, образующийся на поверхности древесины в период пламенного горения, не горит, хотя и находится в накаленном состоянии, так как его горению в этот период препятствует горение газообразных продуктов разложения, в результате чего кислород не имеет доступа к поверхности угля. Последний горит тогда, когда завершается пламенное горение при значительном выделении газообразных продуктов.
Небольшой период времени оба вида горения древесины протекают одновременно. Затем выделение газообразных продуктов прекращается, и горит только уголь. Скорость выгорания древесины зависит от объемного веса, влажности, температуры среды, количества кислорода и отношения поверхности древесины к ее объему. Более плотная древесина (дуб) горит медленнее, чем менее плотная (осина). Объясняется это тем, что более плотная древесина имеет большую теплопроводность и, следовательно, больше теплопотерь от нагреваемого слоя древесины. При горении влажной древесины значительное количество тепла расходуется на испарение влаги, поэтому на разложение древесины идет меньше тепла. Таким образом, скорость выгорания влажной древесины меньше, чем сухой.
Скорость горения древесины значительно изменяется от величины отношения поверхности к объему. Чем больше это отношение, тем больше скорость горения. Например, древесный брус сечением 10 см 2 , длиной 5 м имеет поверхность (без учета торцовых поверхностей) 0,1x5x4 = 2 м 2 , а объем 0,1×0,1×5 = 0,05 м 3 . На 1 м 3 древесины приходится поверхность горения, равная 2:0,05 = 40 м 2 . Если этот брус распилить на 4 части сечением 5×5 см, то их общий объем останется прежним, а поверхность будет 0,05x5x4 = 4 м 2 . Теперь поверхность горения 1 м 3 древесины будет 4 : 0,05 = 80 м 2 , т. е. она возросла в 2 раза, следовательно, и скорость сгорания четырех брусков сечением 5×5 см будет больше, чем одного бруска сечением 10×10 см.
По данным ЦНИИПО, скорость выгорания древесины равна 45—50 кг на 1 м 2 в час. Такая скорость в сушильной камере может наблюдаться при полном горении, т. е. при открытых дверных проемах и открытых каналах вентиляционной системы.
При относительной герметичности камеры (плотно закрытые ворота, перекрытые каналы вентиляционной сети) горение будет затухать, а скорость выгорания древесины резко снижаться. Температура, получаемая при проведении процесса горения в адиабатических условиях, т. е. при полном отсутствии потерь тепла, называется теоретической температурой горения, до которой нагреваются продукты горения, когда все тепло, выделившееся при горении, идет на их нагревание. Действительно же достигаемые при горении древесины температуры всегда ниже теоретических, так как часть выделяемого тепла теряется в окружающую среду. Разница между действительной и теоретической температурами горения зависит от скорости сгорания и условий теплоотдачи.
Температура горения не зависит от количества древесины, так как количество тепла, приходящееся на единицу объема продуктов горения, остается постоянным. Температура горения древесины в сушилках зависит от полноты сгорания (полное, неполное горение), величины избытка воздуха, от скорости горения, температуры древесины и воздуха. Величина температуры горения сильно влияет на развитие пожара в сушилках. Чем она выше, тем больше тепла излучается в окружающую среду и, следовательно, быстрее идет подготовка древесины к горению.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
🌟 Видео
29. Общая реакция горения для всех углеводородов. Как расставить коэффициенты реакции легкоСкачать

Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Горение магния - химическая реакция.Скачать

Решение задач на термохимические уравнения. 8 класс.Скачать

Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

25. Схема реакции и химическое уравнениеСкачать

Проклятая химическая реакция 😜 #shortsСкачать

Типы химических реакций. 1 часть. 8 класс.Скачать

Химия | Тепловой эффект химической реакции (энтальпия)Скачать

Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать

ВСЕ ПРО АЛКАНЫ за 8 минут: Химические Свойства и ПолучениеСкачать

Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

Экзо- и эндотермические реакции. Тепловой эффект химических реакций. 8 класс.Скачать

Химия 46. Реакция горения. Флогистон — Академия занимательных наукСкачать

