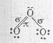Задача 837.
Описать электронное строение молекулы O3, сравнить химическую активность озона и молекулярного кислорода O2. Как получить озон из молекулярного кислорода?
Решение:
Электронное строение трёхатомной молекулы озона можно представить схемой:
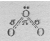
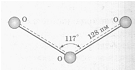
Установлено, что все связи центрального атома кислорода с двумя другими атомами кислорода одинаковы (равноценны) как по длине, так и по энергии. Значит σ- связь, образованная негибридизированными р-орбиталями, является трёхцентровой ковалентной, т.е. электронная — пара делокализована и принадлежит в равной степени всем трём атомам кислорода. Молекула О3 построена в форме равнобедренного треугольника, угол при вершине треугольника 117 0 , что указывает на то, что, центральный атом кислорода находится в состоянии sp 2 – гибридизации. Гибридная sp 2 – орбиталь, содержащая один электрон в центральном атоме, перекрывается с негибридной рх – орбиталью одного из крайних атомов кислорода, образуя σ — связь. Не участвующая в гибридизации рz – орбиталь центрального атома перекрывается с рz – орбиталью другого атома кислорода, образуя σ — связь. Наконец, выступая в качестве донора электронной пары центральный атом кислорода, образует с другим атомом кислорода σ — связь по донорно-акцепторному механизму. Структуру молекулы О3 можно представить схемой:
Рис.3. Структура молекулы О3
Озон как и кислород является сильнейшим окислителем. Он окисляет все металлы, кроме золота и платины. Озон переводит низшие оксиды в высшие, а сульфаты металлов – в их сульфиты. В ходе этих реакций молекула озона теряет один атом кислорода, переходит в молекулу кислорода.
Из раствора иодида калия озон выделяет йод (качественная реакция на О3):
Таким образом, озон более сильный окислитель, чем кислород.
Озон можно получить из молекулярного кислорода действием на последний тихих электрических разрядов:
В природе озон образуется под действием электрических разрядов.
Задача 838.
Может ли при комнатной температуре протекать реакция взаимодействия кислорода: а) с водородом; б) с азотом? Ответ мотивировать, используя табличные данные стандартных значений энергии Гиббса образования веществ, участвующих в процессах.
Решение:
Уравнение реакции взаимодействия водорода с кислородом имеет вид:
Реакция протекает с большим выделением теплоты. Энергия Гиббса образования Н2О имеет отрицательное значение (-228,8 кДж/моль),
ΔG 0 0 С реакция протекает со скоростью в несколько дней, а при 500 0 С кислород и водород полностью прореагируют за несколько часов, при 700 0 С происходит быстрый подъём температуры и реакция заканчивается взрывом. Поэтому, чтобы вызвать взрыв смеси водорода с кислородом, нужно подогреть её хотя бы в одном месте до 700 0 С.
б) При обычных условиях кислород и азот не реагируют друг с другом. Объяснить это можно тем, что энергия Гиббса всех оксидов азота имеет положительное значение, ΔG 0 > 0. Из табличных данных следует, что энтальпия образования всех оксидов азота тоже положительна, т. е. данные реакции являются эндотермическими. Малая скорость взаимодействия кислорода с азотом объясняется высокой энергией активации этих процессов. Молекулы кислорода и азота очень прочны, поэтому чтобы сделать кинетическую энергию сталкивающихся молекул большой необходимо очень сильно повысить температуру системы. И только при достаточно высокой температуре некоторые соударения молекул кислорода и азота становятся эффективными и приводят к образованию активных центров. Так кислород и азот взаимодействуют при температуре электрической дуги (3000 – 4000 0 С):
N2 + O2 
Это эндотермическая реакция, поэтому наблюдается тенденция к уменьшению внутренней энергии, что способствует протеканию данного процесса в обратном направлении, а тенденция к увеличению вероятности состояния вызывает её частичное протекание в прямом направлении. Поэтому, чтобы система N2 + O2 = 2NO достигла наиболее вероятного состояния, необходима высокая температура. Поэтому все оксиды азота получают косвенным путём.
Задача 839.
После озонирования при постоянной температуре некоторого объема кислорода установлено, что объем газа, приведенный к исходному давлению, уменьшился на 500 мл. Какой объем озона образовался? Какое количество теплоты поглотилось при его образовании, если для озона ΔН 0 298о = 144,2 кДж/моль?
Решение:
Уравнение реакции:
Из уравнения реакции следует, что из 3 моль кислорода образуется 2 моль озона, т.е. объём системы уменьшается на 1 моль. Можно записать соотношение, показывающее зависимость от образовавшегося объёма озона и уменьшением объёма системы, получим:
2 : 1 = х : 0,5; х = (2 . 0,5)/1 = 1л.
Находим ΔН 0 реакции:
ΔН 0 х.р. = 2 ΔН 0 (O3) — 3 ΔН 0 (O2) = (2 . 144,2) – 3 . 0 = 288,4 кДж.
Количество теплоты рассчитаем из пропорции:
2 : 22,4 : 288,4 = 1 : х; х = (288,4 . 1)/ (2 . 22,4) = 6,44 кДж.
Ответ: 1л О3; 6,44 кДж.
- Температура горения водорода: описание и условия реакции, применение в технике
- Что такое водород?
- Химическая реакция горения
- Механизм процесса горения водорода
- Инициация реакции
- Процентное содержание газов в горючей смеси
- Безопасность горения
- Температура реакции горения
- Количество выделяемой теплоты
- Применение водородной горючей смеси в технике: проблемы
- Газ озон: химические, физические свойства, формула, отличия и другое
- Содержание:
- Получение озона
- Физические свойства озона
- Химические свойства озона
- Токсичность озона
- Озоновый слой в верхних слоях атмосферы
- Дыры в озоновом слое
- Защита озонового слоя
- 📸 Видео
Видео:Горение водородаСкачать

Температура горения водорода: описание и условия реакции, применение в технике
Одной из актуальных проблем является загрязнение окружающей среды и ограниченность энергетических ресурсов органического происхождения. Многообещающим способом решения этих проблем является использование водорода в качестве источника энергии. В статье рассмотрим вопрос горения водорода, температуру и химию этого процесса.
Видео:Озон. Вред. Свойства. Озоновые дыры. Химия – ПростоСкачать

Что такое водород?
Прежде чем рассматривать вопрос, какая температура сгорания водорода, необходимо вспомнить, что собой представляет это вещество.
Водород — это самый легкий химический элемент, состоящий всего из одного протона и одного электрона. При нормальных условиях (давление 1 атм., температура 0 o C) он присутствует в газообразном состоянии. Его молекула (H2) образована 2 атомами этого химического элемента. Водород является 3-м по распространенности элементом на нашей планете, и 1-м во Вселенной (около 90 % всей материи).
Водородный газ (H2) не имеет запаха, вкуса и цвета. Он не токсичен, однако, когда содержание его в атмосферном воздухе составляет несколько процентов, то человек может испытывать удушье, по причине недостатка кислорода.
Любопытно отметить, что хотя с химической точки зрения все молекула H2 идентичны, физические свойства их несколько отличаются. Дело все в ориентации спинов электронов (они ответственны за появление магнитного момента), которые могут быть параллельными и антипараллельными, такую молекулу называют орто- и параводородом, соответственно.
Видео:Химия 8 класс (Урок№12 - Озон. Аллотропия кислорода. Состав воздуха. Горение.)Скачать

Химическая реакция горения
Рассматривая вопрос, температуры горения водорода с кислородом, приведем химическую реакцию, которая описывает этот процесс: 2H2 + O2 => 2H2O. То есть в реакции участвуют 3 молекулы (две водорода и одна кислорода), а продуктом являются две молекулы воды. Эта реакция описывает горение с химической точки зрения, и по ней можно судить, что после ее прохождения остается только чистая вода, которая не загрязняет окружающую среду, как это происходит при сгорании органического топлива (бензина, спирта).
С другой стороны, эта реакция является экзотермической, то есть помимо воды она выделяет некоторое количества тепла, которое можно использовать для приведения в движение машин и ракет, а также для его перевода в другие источники энергии, например, в электричество.
Видео:Озон. Аллотропия. 8 класс.Скачать

Механизм процесса горения водорода
Описанная в предыдущем пункте химическая реакция известна любому школьнику старших классов, однако она является очень грубым описанием того процесса, который происходит в действительности. Отметим, что до середины прошлого века человечество не знало, как происходит горение водорода в воздухе, а в 1956 году за ее изучение была присуждена Нобелевская премия по химии.
В действительности, если столкнуть молекулы O2 и H2, то никакой реакции не произойдет. Обе молекулы являются достаточно устойчивыми. Чтобы горение происходило, и образовывалась вода, необходимо существование свободных радикалов. В частности, атомов H, O и групп OH. Ниже приводится последовательность реакций, которые происходят в действительности при горении водорода:
Что видно из этих реакций? При горении водорода образуется вода, да, верно, но происходит это только, когда группа из двух атомов OH встречается с молекулой H2. Кроме того, все реакции происходят с образованием свободных радикалов, это означает, что запускается процесс самоподдержания горения.
Таким образом, ключевой момент в запуске этой реакции заключается в образовании радикалов. Они появляются, если поднести к кислород-водородной смеси горящую спичку, либо если нагреть эту смесь выше определенной температуры.
Видео:Горение водорода (2H2+O2=2H2O) под увеличением в 100,000,000 разСкачать

Инициация реакции
Как было отмечено, сделать это можно двумя способами:
- С помощью искры, которая должна предоставить всего 0,02 мДж теплоты. Это очень маленькое значение энергии, для сравнения скажем, что аналогичное значение для бензиновой смеси составляет 0,24 мДж, а для метановой — 0,29 мДж. С уменьшением давления энергия инициации реакции растет. Так, при 2 кПа она составляет уже 0,56 мДж. В любом случае, это очень маленькие значения, поэтому водород-кислородная смесь считается легко воспламеняющейся.
- С помощью температуры. То есть кислород-водородную смесь можно просто нагревать, и выше некоторой температуры она сама воспламенится. Когда это произойдет, зависит от давления и процентного соотношения газов. В широком интервале концентраций при атмосферном давлении реакция самовозгорания происходит при температурах выше 773-850 К, то есть выше 500-577 o C. Это достаточно высокие значения по сравнению с бензиновой смесью, которая начинает самовоспламеняться уже при температурах ниже 300 o C.
Видео:Водород. 8 класс.Скачать

Процентное содержание газов в горючей смеси
Говоря о температуре горения водорода в воздухе, следует отметить, что не всякая смесь этих газов будет вступать в рассматриваемый процесс. Экспериментально установлено, что если количество кислорода меньше 6% по объему, либо если количество водорода меньше 4% по объему, то никакой реакции не будет. Тем не менее, пределы существования горючей смеси являются достаточно широкими. Для воздуха процентное содержание водорода может составлять от 4,1 % до 74,8 %. Отметим, что верхнее значение как раз соответствует необходимому минимуму по кислороду.
Если же рассматривается чистая кислород-водородная смесь, то здесь пределы еще шире: 4,1-94 %.
Уменьшение давления газов приводит к сокращению указанных пределов (нижняя граница поднимается, верхняя — опускается).
Также важно понимать, что в процессе горения водорода в воздухе (кислороде), возникающие продукты реакции (вода) приводят к уменьшению концентрации реагентов, что может привести к прекращению химического процесса.
Видео:Водород и кислород. 1 часть. 8 класс.Скачать

Безопасность горения
Это важная характеристика воспламеняющейся смеси, поскольку она позволяет судить о том, происходит реакция спокойно, и можно ее контролировать, либо процесс имеет взрывной характер. От чего зависит скорость горения? Конечно же, от концентрации реагентов, от давления, а также от количества энергии «затравки».
К большому сожалению, водород в широком интервале концентраций способен к взрывному горению. В литературе приводятся следующие цифры: 18,5-59 % водорода в воздушной смеси. Причем на краях этого предела в результате детонации выделяется наибольшее количество энергии на единицу объема.
Отмеченный характер горения представляет большую проблему для использования этой реакции в качестве контролируемого источника энергии.
Видео:Будет ли дерево гореть в ОЗОНЕ?Скачать

Температура реакции горения
Теперь мы подошли непосредственно к ответу на вопрос, какая низшая температура сгорания водорода. Она составляет 2321 К или 2048 o C для смеси с 19,6 % H2. То есть температура горения водорода в воздухе выше 2000 o C (для других концентраций она может достигать 2500 o C), и в сравнении с бензиновой смесью — это огромная цифра (для бензина около 800 o C). Если сжигать водород в чистом кислороде, то температура пламени будет еще выше (до 2800 o C).
Столь высокая температура пламени представляет еще одну проблему в использовании этой реакции в качестве источника энергии, поскольку не существует в настоящее время сплавов, которые могли бы работать длительное время в таких экстремальных условиях.
Конечно, эта проблема решается, если использовать хорошо продуманную систему охлаждения камеры, где происходит горение водорода.
Видео:Галилео. Эксперимент. Взрыв водородаСкачать

Количество выделяемой теплоты
В рамках вопроса температуры горения водорода любопытно также привести данные о количестве энергии, которая выделяется во время этой реакции. Для разных условий и составов горючей смеси получили значения от 119 МДж/кг до 141 МДж/кг. Чтобы понять, насколько это много, отметим, что аналогичное значение для бензиновой смеси составляет около 40 МДж/кг.
Энергетический выход водородной смеси намного выше, чем для бензина, что является огромным плюсом для ее применения в качестве топлива для двигателей внутреннего сгорания. Однако, и здесь не все так просто. Все дело в плотности водорода, она слишком низка при атмосферном давлении. Так, 1 м 3 этого газа весит всего 90 грамм. Если сжечь этот 1 м 3 H2, то выделится около 10-11 МДж теплоты, что уже в 4 раза меньше, чем при сжигании 1 кг бензина (чуть больше 1 литра).
Приведенные цифры говорят о том, что для использования реакции горения водорода необходимо научиться хранить этот газ в баллонах с высоким давлением, что создает уже дополнительные сложности, как в технологическом вопросе, так и с точки зрения безопасности.
Видео:Химия 8 класс (Урок№11 - Кислород: получение, физические и химические свойства,применение. Оксиды.)Скачать

Применение водородной горючей смеси в технике: проблемы
Сразу необходимо сказать, что в настоящее время водородная горючая смесь уже используется в некоторых сферах человеческой деятельности. Например, в качестве дополнительного топлива для космических ракет, в качестве источников для выработки электрической энергии, а также в экспериментальных моделях современных автомобилей. Однако масштабы этого применения являются мизерными, по сравнению с таковыми для органического топлива и, как правило, носят экспериментальных характер. Причиной этому являются не только трудности в контроле самой реакции горения, но также в хранении, транспортировке и добыче H2.
Водород на Земле практически не существует в чистом виде, поэтому его необходимо получать из различных соединений. Например, из воды. Это достаточно популярный способ в настоящее время, который осуществляется с помощью пропускания электрического тока через H2O. Вся проблема заключается в том, что при этом расходуется больше энергии, чем потом можно получить путем сжигания H2.
Еще одна важная проблема — транспортировка и хранение водорода. Дело в том, что этот газ, ввиду маленьких размеров его молекул, способен «вылетать» из любых контейнеров. Кроме того, попадая в металлическую решетку сплавов, он вызывает их охрупчивание. Поэтому наиболее эффективным способом хранения H2 является использование атомов углерода, способных прочно связывать «неуловимый» газ.
Таким образом, применение водорода в качестве топлива в более-менее широких масштабах возможно, только если его использовать в качестве «сохранения» электричества (например, переводить ветровую и солнечную энергию в водород с помощью электролиза воды), либо если научиться доставлять H2 из космоса (где его очень много) на Землю.
Видео:94. Превращение кислорода в озонСкачать

Газ озон: химические, физические свойства, формула, отличия и другое
Содержание:
Кислород – элемент VIA группы. Для него свойственны две аллотропные модификации с разными химическими формулами – кислород О2 и озон О3. Они отличаются не только составом молекул, но и различными характеристиками.
В конце XVIII века ученый Мартин Ван Марум провел эксперимент, в результате которого получил озон. Он через воздушное пространство пропускал электричество. Таким образом, образовался озон – это голубоватый газ с необычным запахом. Ученый предполагал, что полученный газ представляет собой электрическую материю.
В 1840 году ученый Кристиан Фридрих Шенбейн раскрыл структуру и свойства озона. Полученный газ он назвал «озоном» (с греч. языка «пахнуть»). Кристиан Фридрих Шенбейн провел эксперимент, где озон вытеснил йод из иодида калия.
Видео:Озон. Аллотропия кислорода. Состав воздуха. Горение.Скачать

Получение озона
Существует несколько способов получения молекул озона.
- Из кислорода воздуха при электрическом разряде
- 3О2 = 2О3 – 284 кДж
В промышленных условиях газ получают в озонаторах и отделяют фракционной перегонкой.
- 3О2 = 2О3 – 284 кДж
- Взаимодействие охлажденной концентрированной серной кислоты и пероксида бария
- 3H2SO4 + 3BaO2 = 3BaSO4 + O3 + 3H2O
Данной реакцией синтезируют озон в лабораториях.
- 3H2SO4 + 3BaO2 = 3BaSO4 + O3 + 3H2O
Видео:Взаимодействие кислорода с водородомСкачать

Физические свойства озона
Озон – бесцветный (в толстых слоях голубоватый) газ. Он почти в два раза тяжелее воздуха. Озон обладает специфическим запахом свежести.
- Температура сжижения -112˚С (газ приобретает оттенок индиго).
- Температура плавления -197˚С.
- Молярная масса озона – 48 г/моль.
Озон растворим в воде. Примеси позволяют растворяться еще быстрее. Если озон находится в состоянии газа, то он выступает в роли диамагнетика. Если озон – это жидкость, то проявляет свойства слабого парамагнетика.
Озон ядовит и губителен для бактерий. Его используют при обеззараживании воздуха и воды.
Видео:Свойства и применение водорода. 8 класс.Скачать

Химические свойства озона
Озон обладает сильными окислительными свойствами по сравнению с кислородом. Он реагирует с рядом веществ.
Если озон находится в состоянии газа, то реакция с сероводородом выглядит следующим образом:
H2S + O3 = SO2 + H2O
Озон способен взаимодействовать со ртутью при обычных условиях. В результате металл теряет блеск и способность липнуть к стеклу.
Видео:Воздух. Состав воздуха. 7 класс.Скачать

Токсичность озона
При умеренных концентрациях озон безвреден. Реакции с озоном характеризуются формированием свободных радикалов кислорода, которые губительны для организма при высоком содержании. Чрезмерное воздействие озона часто приводит к гибели. Озон особенно губителен для органов дыхания.
Видео:Галилео. Эксперимент. Разложение перекиси водородаСкачать

Озоновый слой в верхних слоях атмосферы
Озоновый слой – слой в верхней части атмосфера Земли, который состоит из бесцветного нестабильного газа. Он располагается на высоте 15-20 км над поверхностью планеты. Стратосфера – слой атмосферы, в котором содержится много озона.
Озон образуется в результате воздействия ультрафиолета на кислород. Слой газа задерживает все формы поступающей ультрафиолетовой коротковолновой радиации.
Озоновый экран защищает от вредного излучения, длина волн которого 290-320 нм. Это излучение может спровоцировать рак кожи. Озоновый слой появился на Земле около 600 млн лет назад в результате процесс фотосинтеза. Благодаря озоновому слою первые живые организмы смогли выйти из океана на сушу.
Видео:Кислород и озон сравнительная характеристикаСкачать

Дыры в озоновом слое
Озоновые дыры – локальное истощение озонового слоя. Самая большая озоновая дыра находится над Антарктидой. Если озоновый слой полностью исчезнет, то все живое на планете погибнет.
Озоновые дыры возникают по многим причинам, главная из которых – загрязнение окружающей среды. Озоновый слой разрушается под воздействием хлора, водорода, кислорода, брома и других продуктов сгорания. Выбросы фабрик, заводов и различных производств негативно влияют на выработку озона в верхних слоях атмосферы.
Озоновый слой может разрушить война. При испытании ядерного оружия выделяется огромное количество энергии и образуются окислы азота, которые разрушают озон. В период с 1952 по 1971 года при ядерных взрывах в атмосферу попало около 3 млн т окислов азота.
Реактивные самолеты выбрасывают окислы азота. Чем выше мощность турбореактивного двигателя, тем больше разрушающего вещества попадает в атмосферу. Ежегодно в воздух выбрасывается более 1 млн т соединений азота, из которых треть выбрасывают самолеты.
Видео:Коронный разряд и получение озона / Corona discharge and ozoneСкачать

Защита озонового слоя
До 1989 года на производствах часто применялись галогенированные углеводороды, которые разрушают озоновый слой. Монреальская конвенция разработала программу по сокращению использования хлорфторуглеродов, которые быстро испарялись и достигали стратосферы. Они разлагаются на компоненты и разрушают озоновый слой. Из этих соединений раньше изготавливали аэрозоли, растворители и др.
Озоновые дыры произвольно создаются и исчезают. Это связано с некоторыми природными явлениями и даже климатическими особенностями. Газ озон образуется в результате воздействия ультрафиолета на кислород. Во время полярной ночи дыры образуются из-за того, что солнце не заходит несколько недель и ультрафиолет постоянно влияет на кислород. Во время полярного дня озоновый слой восстанавливается и воздействие ультрафиолета на живые организмы снижается.
Дыры могут формироваться в период активности Солнца. В результате этого они появляются и пропадают. Иногда это занимает несколько дней, реже растягивается на несколько месяцев.
📸 Видео
Горение озона в пламени O3 flame burning O3Скачать

Кислород. 8 класс.Скачать