| 🎓 Заказ №: 22175 |
| ⟾ Тип работы: Задача |
| 📕 Предмет: Химия |
| ✅ Статус: Выполнен (Проверен преподавателем) |
| 🔥 Цена: 153 руб. |
👉 Как получить работу? Ответ: Напишите мне в whatsapp и я вышлю вам форму оплаты, после оплаты вышлю решение.
➕ Как снизить цену? Ответ: Соберите как можно больше задач, чем больше тем дешевле, например от 10 задач цена снижается до 50 руб.
➕ Вы можете помочь с разными работами? Ответ: Да! Если вы не нашли готовую работу, я смогу вам помочь в срок 1-3 дня, присылайте работы в whatsapp и я их изучу и помогу вам.
⚡ Условие + 37% решения:
Горение формальдегида HCOH протекает по уравнению HCOH(г) O2(г) СO2(г) H2O(ж) ; Hр 560 кДж . Вычислите теплоту образования формальдегида.
Решение: Согласно следствию из закона Гесса тепловой эффект химической реакции равен сумме теплот образования продуктов реакции за вычетом суммы теплот образования исходных веществ, с учетом коэффициентов перед формулами этих веществ в уравнении реакции. Используя значение термохимического эффекта реакции и табличные значения стандартных теплот образования кислорода, оксида углерода (IV) и воды, вычисляем теплоту образования формальдегида.
Научись сам решать задачи изучив химию на этой странице:
|
Услуги:
|
Готовые задачи по химии которые сегодня купили:




















































Образовательный сайт для студентов и школьников
Копирование материалов сайта возможно только с указанием активной ссылки «www.lfirmal.com» в качестве источника.
© Фирмаль Людмила Анатольевна — официальный сайт преподавателя математического факультета Дальневосточного государственного физико-технического института
Видео:Химия 8 класс (Урок№11 - Кислород: получение, физические и химические свойства,применение. Оксиды.)Скачать

ЗАДАЧИ ПО ФИЗИЧЕСКОЙ ХИМИИ
| получить счет |
| N | Условия задач | Цена, руб |
| F41 | Какое устройство называют гальваническим элементом? Чем химические элементы отличаются от концентрационных? Приведите примеры гальванических элементов обоих типов. | |
| F42 | Рассчитать энтальпию реакции: 2HI(г) + Cl2(г)—>2HCl(г)+ I2(к), если ΔH0обр.HCl= -92 кДж/моль; ΔH0обр.HI =+25 кДж/моль. | |
| F43 | Горение формальдегида протекает по уравнению: HCOOH(г) + O2(г) = CO2(г) + H2O(ж) + 563кДж. Вычислить энтальпию образования формальдегида, если энтальпия образования CO2=-393 кДж/моль и энтальпия образования H2O=-286 кДж/моль. Исходя из знака ΔG0обр следующих реакций: PbO2(к) + Pb(к)=2PbO(к); ΔG0298 0. Сделать вывод о том, какие степени окисления более характерны для свинца и олова: а) Pb+2, Sn+2 б)Pb+2, Sn+4 в) Pb+4, Sn+2 г) Pb+4, Sn+4. При какой температуре приведенная реакция может протекать самопроизвольно: I2(к)+H2S(г)=2HI(г)+S(к) ΔH°обр.H2S =-21,0кДж/моль, ΔH°обр.HI =+26,6 кДж/моль; S°HI =206 дж/моль*К; S°H2S=206 Дж/моль*К; S°I2=117 Дж/моль*К; S°S=32 Дж/моль*К. | |
| F46 | Для какого вещества энтальпия образования равна нулю? а) H2O2 б) H2SO4 в) O2 г) CaCO3 д) O3. | |
| F47 | Запишите уравнение Гиббса-Гельмгольца и перечислите возможные пути его использования в расчетах. | |
| F48 | ||
| F49 | Объясните физический смысл химического потенциала и его использование при термодинамическом описании систем. | |
| F50 | Запишите соотношения, позволяющие определить тепловой эффект химической реакции при стандартных условиях по справочным значениям теплот образования и теплот сгорания участников реакции. |
Решаю задачи по химии: физической, коллоидной, общей и неорганической, аналитической, органической химии. Оперативно
Видео:Как уравнивать реакции по органической химии?Скачать

Химические свойства и способы получения муравьиного альдегида
Задача 4.
Опишите химические свойства муравьиного альдегида. Приведите промышленные и лабораторные способы получения этого соединения.
Решение:
Атом углерода в карбонильной группе находится в состоянии sp 2 -гибридизации и образует 3 сигма-связи (две связи С-Н и одну связь С-О). Сигма-связь образована р-электронами атомов углерода и кислорода. Двойная связь С = О является сочетанием пи- и сигма-связей. Электронная плотность смещена в сторону атома кислорода.
В молекулах альдегидов имеется несколько реакционных центров: электрофильный центр (карбонильный атом углерода), участвующий в реакциях нуклеофильного присоединения; основный центр – атом кислорода с неподеленными электронными парами; Н-С(О)-Н кислотный центр, отвечающий за реакции конденсации; связь С-Н, разрывающаяся в реакциях окисления.
Реакции присоединения
1. Присоединение водорода (восстановление):
Н-CH=O + H2 (t,Ni) → Н-CH2-OH (метиловый спирт);
2. Присоединение аммиака:
3. Присоединение бисульфита натрия:
4. Присоединение циановодородной кислоты (синильной):
Н-CH=O + H-CN → H-CH(CN)-OH;
5. Присоединение гидразина с образованием гидразона:
6. Присоединение аминов с образованием N-замещенного имина:
7. Присоединение тиола с образованием дитиоацеталя (в кислой среде):
8. Присоединение воды с образованием гем-диола:
Н-CH=O + Н-ОН → Н-CH(OH)-OH.
При действии щелочи на формалин получаются метиловый спирт и муравьиная кислота:
2Н-CH=O + Н-ОН → СН3-ОН + Н-СООН.
В присутствии щелочей в водном растворе может идти и другая реакция: формальдегид конденсируется, причем в числе прочих продуктов получается один из простейших сахаров, или гексоз:
6Н-CH=O → C6H12O6 (Реакция Бутлерова: 2Н-CH → O + RbOH = -CH=O);
9. Присоединение спирта с образованием полуацеталя:
10. При взаимодействии формальдегида с ацетальдегидом в газовой фазе в присутствии катализаторов (окись алюминия, ацетат свинца на силикагеле и др.) образуется акролеин:
В водном растворе при большом избытке формальдегида под влиянием гидроокиси кальция конденсация с ацетальдегидом приводит к пентаэритриту:
Высшие алифатические альдегиды дают в этих условиях окси-или диоксиальдегиды (в зависимости от числа H-водородных атомов):
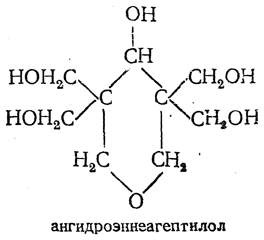
Формальдегид при взаимодействии с ацетоном образует ангидроэннеагептилол:
Реакции окисления
1. Альдегиды – довольно сильные восстановители, и поэтому легко окисляются различными окислителями, например: KMnO4, K2Cr2O7, [Ag(NH3)2]OH, Cu(OH)2. Все реакции идут при нагревании:
Реакции полимеризации
1. Реакция с фенолом с образованием фенолформальдегидных смол:
Получение формальдегида:
Промышленные методы получения формальдегида
1. Окисление метанола.
Реакция проводится в присутствии серебряного катализатороа и при нагревании (около 650—720 °C) или при 400 °C в присутствиии железо-никилиевых катализаторов:
2. Реакция дегидрирования метанола.
Процесс проводится на цинк-медных катализаторах при 600 °C:
3. Окисление метана.
Реакцию проводят при температуре 450 °C и давлении 1—2 МПа на катализаторе AlPO4.
Лабораторные способы получения формальдегида
1. Восстановление метанола:
Реакцию проводят, опуская раскаленную медную проволоку в пробирку с метанолом, образуется резкий запах альдегида. Если процесс окисления повторить несколько раз, то можно получить значительную концентрацию формальдегида.
2. Реакция метанола с перманганатом калия:
Смесь слабого раствора марганцовки и метанола нагревают до кипения. Появляется запах формальдегида, а фиолетовая окраска перманганата исчезает.
3. Реакция метанола с бихроматом калия:
В насыщенный раствор бихромата калия К2Сг2О7 добавляют такой же объем концентрированной серной кислоты. Затем по каплям вводят метанол. Очень осторожно подогревают смесь (отверстие пробирки направляют в сторону!). Реакция идет с выделением тепла. Желтая окраска хромовой смеси исчезает, и появляется зеленая окраска сульфата хрома.
📺 Видео
How to balance CH4 + O2 = CO2 + H2O (METHANE COMBUSTION REACTION)Скачать

How to balance C2H6H12 + O2 = CO2 + H2OСкачать

How to Balance C3H8+O2=CO2+H2OСкачать

Взаимодействие углекислого газа с известковой водой (CO2 + Ca(OH)2 = CaCO3 + H2O)Скачать

How to Balance: CH4 + O2 = CO2 + H2O (Methane Combustion Reaction)Скачать

How to balance C3H7CHOHCH(C2H5)CH2OH + O2 → CO2 + H2OСкачать

How to Balance C20H42 + O2 = CO2 + H2OСкачать

How to Balance C3H8 + O2 = CO2 + H2O (Propane Combustion Reaction)Скачать

How to balance: C2H2 + O2 = CO2 + H2OСкачать

How to balance: C3H8 + O2 = CO2 + H2O || propane combustion reactionСкачать

How to balance C2H6 + O2 = CO2 + H2O(ETHANE COMBUSTION REACTION)Скачать

How to Balance C7H6O2 + O2 = H2O + CO2Скачать

How to balance CH4 + O2 = CO2 + H2OСкачать

How to Balance CH4 + O2 → CO2 + H2O (Methane Combustion Reaction) | Easy WayСкачать

How to balance: C2H6 + O2 = CO2 + H2OСкачать

Is CH4 + O2 = CO2 + H2O a Redox Reaction?Скачать

Горение водорода (2H2+O2=2H2O) под увеличением в 100,000,000 разСкачать

Получение и превращения гидроксидов железа Fe(OH)2 и Fe(OH)3Скачать