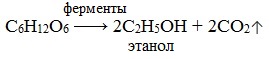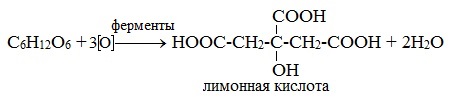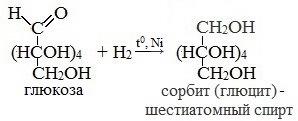Химические свойства глюкозы, как и других альдоз, обусловлены присутствием в ее молекуле: а)альдегидной группы; б) спиртовых гидроксилов; в) полуацетального (гликозидного) гидроксила.
- Специфические свойства
- Реакции с участием альдегидной группы глюкозы (свойства глюкозы как альдегида)
- Реакции глюкозы с участием гидроксильных групп (свойства глюкозы как многоатомного спирта)
- Реакции с участием полуацетального гидроксила
- Реакции окисления
- Свойства глюкозы как альдегидоспирта
- 1) Взаимодействие глюкозы с гидроксидом меди (II)
- 2) Реакция глюкозы с оксидом серебра (I)
- Строение и химические свойства угдеводов
- 🔍 Видео
Специфические свойства
1. Брожение (ферментация) моносахаридов
Важнейшим свойством моносахаридов является их ферментативное брожение, т.е. распад молекул на осколки под действием различных ферментов. Брожению подвергаются в основном гексозы в присутствии ферментов, выделяемых дрожжевыми грибками, бактериями или плесневыми грибками. В зависимости от природы действующего фермента различают реакции следующих видов:
1) Спиртовое брожение
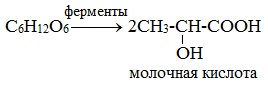
2) Молочнокислое брожение
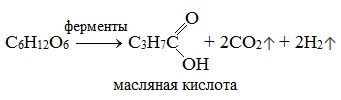
3) Маслянокислое брожение
4) Лимоннокислое брожение
Реакции с участием альдегидной группы глюкозы (свойства глюкозы как альдегида)
1. Восстановление (гидрирование) с образованием многоатомного спирта
В ходе этой реакции карбонильная группа восстанавливается и образуется новая спиртовая группа:
Cорбит содержится во многих ягодах и фруктах, особенно много сорбита в плодах рябины.
2. Окисление
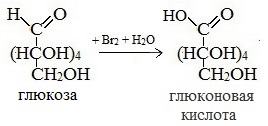
1) Окисление бромной водой
Качественные реакции на глюкозу как альдегид!
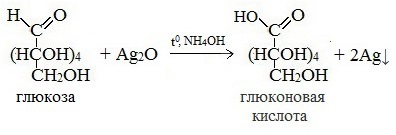
Протекающие в щелочной среде при нагревании реакции с аммиачным раствором Ag2O (реакция серебряного зеркала») и с гидроксидом меди (II) Cu (OH)2 приводят к образованию смеси продуктов окисления глюкозы.
2) Реакция серебряного зеркала
Соль этой кислоты – глюконат кальция – известное лекарственное средство.
Видеоопыт «Качественная реакция глюкозы с аммиачным раствором оксида серебра (I)»
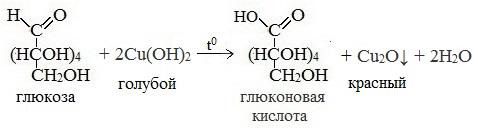
3) Окисление гидроксидом меди (II)
В ходе этих реакций альдегидная группа – СНО окисляется до карбоксильной группы – СООН.
Реакции глюкозы с участием гидроксильных групп (свойства глюкозы как многоатомного спирта)
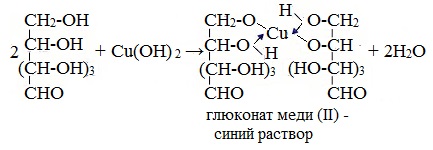
1. Взаимодействие с Cu (ОН)2 с образованием глюконата меди (II)
Качественная реакция на глюкозу как многоатомный спирт!
Подобно этиленгликолю и глицерину, глюкоза способна растворять гидроксид меди (II), образуя растворимое комплексное соединение синего цвета:
Прильём к раствору глюкозы несколько капель раствора сульфата меди (II) и раствор щелочи. Осадка гидроксида меди не образуется. Раствор окрашивается в ярко-синий цвет.
В данном случае глюкоза растворяет гидроксид меди (II) и ведет себя как многоатомный спирт, образуя комплексное соединение.
Видеоопыт «Качественная реакция глюкозы с гидроксидом меди (II)»
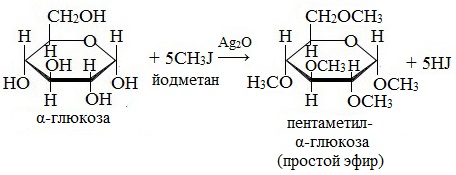
2. Взаимодействие с галогеналканами с образованием простых эфиров
Являясь многоатомным спиртом, глюкоза образует простые эфиры:
Реакция происходит в присутствии Ag2O для связывания выделяющегося при реакции НI.
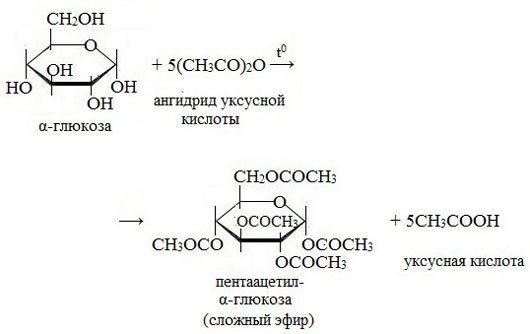
3. Взаимодействие с карбоновыми кислотами или их ангидридами с образованием сложных эфиров.
Например, с ангидридом уксусной кислоты:
Реакции с участием полуацетального гидроксила
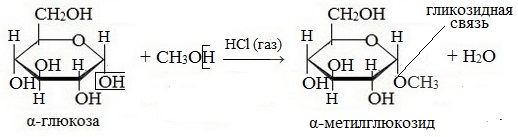
1. Взаимодействие со спиртами с образованием гликозидов
Гликозиды – это производные углеводов, у которых гликозидный гидроксил замещен на остаток какого-либо органического соединения.
Содержащийся в циклических формах глюкозы полуацетальный (гликозидный) гидроксил является очень реакционноспособным и легко замещается на остатки различных органических соединений.
В случае глюкозы гликозиды называются глюкозидами. Связь между углеводным остатком и остатком другого компонента называется гликозидной.
Гликозиды построены по типу простых эфиров.
При действии метилового спирта в присутствии газообразного хлористого водорода атом водорода гликозидного гидроксила замещается на метильную группу:
В данных условиях в реакцию вступает только гликозидный гидроксил, спиртовые гидроксильные группы в реакции не участвуют.
Гликозиды играют чрезвычайно важную роль в растительном и животном мире. Существует огромное число природных гликозидов, в молекулах которых с атомом С (1) глюкозы остатки самых различных соединений.
Реакции окисления
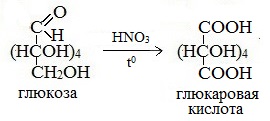
Более сильный окислитель – азотная кислота НNO3 – окисляет глюкозу до двухосновной глюкаровой (сахарной) кислоты:
В ходе этой реакции и альдегидная группа – СНО и первичная спиртовая группа — СН2ОН окисляются до карбоксильных – СООН.
Видеоопыт «Окисление глюкозы кислородом воздуха в присутствии метеленового голубого»
Видео:Опыты по химии. Взаимодействие глюкозы с гидроксидом меди (II) при нагреванииСкачать

Свойства глюкозы как альдегидоспирта
1) Взаимодействие глюкозы с гидроксидом меди (II). Налейте в пробирку 2-3 мл раствора глюкозы и столько же разбавленного раствора гидроксида натрия (NaOH должен быть в избытке). Затем добавьте несколько капель раствора сульфата меди (II).
Что представляет собой раствор синего цвета? Что доказывает данный опыт?
Пробирку с полученным раствором нагрейте. Почему при нагревании в пробирке появляется сначала жёлтый, а затем красный осадок? Напишите уравнения соответствующих реакций.
2) Реакция глюкозы с оксидом серебра (I). В две пробирки налейте по 1 мл раствора нитрата серебра (I) и добавляйте по каплям разбавленный раствор аммиака. Образующийся осадок оксида серебра (I) растворяется в избытке водного раствора аммиака. Затем в одну пробирку прилейте 1-1,5 мл раствора, в котором массовая доля глюкозы равна 0,1, в другую – столько же раствора фруктозы. Обе пробирки поместите в сосуд с горячей водой.
Почему «серебряное зеркало» появляется только в пробирке с раствором глюкозы? Напишите уравнение реакции.
Видео:Качественная реакция глюкозы с гидроксидом меди (II)Скачать

1) Взаимодействие глюкозы с гидроксидом меди (II)
В результате взаимодействия гидроксида натрия с сульфатом меди (II) образуется гидроксид меди (II), который вступает во взаимодействие с гидроксильными группами глюкозы, поэтому раствор окрашивается в синий цвет.
При нагревании пробирки с полученным раствором появляется сначала жёлтый осадок гидроксида меди (I), в результате окисления альдегидной группы глюкозы:
 | + | 2Cu(OH)2 | t ⟶ |  | + | 2CuOH | + | H2O |
Жёлтый осадок гидроксида меди (I) при дальнейшем нагревании превращается в красный оксид меди (I):
2CuOH t ⟶ Cu2O + H2O
Видео:Реакция глюкозы с гидроксидом меди (II)Скачать

2) Реакция глюкозы с оксидом серебра (I)
Глюкоза реагирует с аммиачным раствором оксида серебра (I), а фруктоза – нет. Это связано с тем, что глюкоза имеет альдегидную группу, которая проявляет восстановительные свойства, а фруктоза – нет.
Видео:Опыты по химии. Взаимодействие глюкозы с гидроксидом меди (II) на холодуСкачать

Строение и химические свойства угдеводов
Опыт 1. Действие аммиачного раствора гидроксида серебра на глюкозу
Условия выполнения работы:
В пробирку налили немного раствора глюкозы и аммиачного раствора оксида серебра. Пробирку нагрели. Наблюдаем осаждение серебра на дне пробирки и стенках пробирки:
В реакцию серебряного зеркала вступает только линейная форма глюкозы.
Опыт 2. Действие гидроксида меди (II) на глюкозу
Условия выполнения работы:
а) В пробирку налили немного раствора глюкозы, 2 мл раствора гидроксида натрия и 1 мл медного купороса. Наблюдаем образование голубого осадка гидроксида меди (II), который сразу растворяется и раствор окрашивается в ярко-синий цвет. Далее раствор в пробирке нагревается. Реакция глюкозы с гидроксидом меди при нагревании демонстрирует восстановительные свойства глюкозы. Происходит изменение — окрашивания раствора. В начале выпадает осадок оксида меди CuO желтого цвета. В процессе дальнейшего нагревания CuO восстанавливается до оксида меди (I) – Cu2O, который выпадает в виде красного осадка. В процессе этой реакции глюкоза окисляется до глюконовой кислоты.
Таким образом, при нагревании реакция глюкозы с гидроксидом меди(II) идет с восстановлением двухвалентной меди Cu (II) до одновалентной меди Cu (I).
Уравнениия реакций можно представить так:

Происходит качественная реакция на многоатомные спирты, коим является глюкоза, реакция обусловлена наличием гидроксильной группы.
б) Если в пробирку налили немного раствора глюкозы, 2 мл раствора гидроксида натрия и 1 мл медного купороса, но не нагревали, то будем наблюдать образование голубого осадка гидроксида меди (II), который сразу растворяется и раствор окрашивается в ярко-синий цвет (образуется растворимая комплексная соль). В пробирку к полученному раствору добавили немного воды, закрепили пробирку на штативе. Нагрели пробирку так, чтобы прогревалась только верхняя часть раствора. Наблюдаем выпадение жёлто-красного осадка и обесцвечивание раствора. 
При нагревании происходит окисление глюкозы гидроксидом меди до карбоновой кислоты, эта реакция обеспечивается альдегидной группой 
Выводы:
1) глюкоза реагирует с гидроксидом меди без нагревания с образованием ярко-синего раствора комплексной соли Cu 2+ ;
2) если реакцию глюкозы с гидроксидом меди проводить при нагревании, то происходит окисление глюкозы до карбоновой кислоты, образуется жёлто-красный осадок .
Опыт 3. Действие аммиачного раствора оксида серебра на сахарозу
Условия выполнения работы:
а) В пробирку налили немного раствора сахарозы и немного аммиачного раствора оксида серебра и нагрели пробирку. Ничего не происходит, реакция не идёт, так как сахарозу образуют циклические формы глюкозы и фруктозы, а они не дают реакцию серебряного зеркала.
б) В пробирку налили немного раствора сахарозы и несколько капель разбавленной серной кислоты. Пробирку нагрели. Затем добавили в пробирку раствор гидроксида натрия, доводим раствор до слабощелочной среды (используя как индикатор лакмусовую бумагу). К полученному раствору добавили 2 мл аммиачного раствора оксида серебра и опять нагрели пробирку.
При нагревании раствора сахарозы с несколькими каплями серной кислоты, образуется глюкоза и фруктоза в свободной линейной форме:
Так как при гидролизе сахарозы образуется фруктоза и глюкоза, то реакция серебряного зеркала возможна только при линейной форме глюкозы (Смотри уравнение в Опыте 1.).
Опыт 4. Действие иода на крахмал
Условия выполнения работы:
В химический стакан налили 20 мл кипящей воды и присыпали немного крахмала, образовавшуюся смесь перемешали до образования прозрачного коллоидного раствора — крахмального клейстера. В пробирку налили немного охлаждённого клейстера и добавили несколько капель спиртового раствора иода. Наблюдаем синее окрашивание раствора. При нагревании полученного раствора синее окрашивание исчезает.
🔍 Видео
Взаимодействие глюкозы с гидроксидом медиСкачать

Взаимодействие глюкозы с гидроксидом меди(II). | Лабораторный опыт № 6.Скачать

Опыты по химии. Взаимодействие сахарозы с гидроксидом меди (II)Скачать

Качественная реакция на глюкозу. Реакция глюкозы с гидроксидом меди (ll)Скачать

CuOH2 с глюкозойСкачать

Качесвтная реакция ГЛЮКОЗЫ(C6H12O6) и ГИДРОКСИДА МЕДИ(Cu(OH)2) .Скачать

Качественные реакции на глицерин, глюкозу и сахарозуСкачать

качественная реакция глюкозы с гидроксидом меди IIСкачать

качественная реакция глюкозы с гидроксидом меди.wmvСкачать

Качественная реакция на глюкозуСкачать

Глюкоза и гидроксид меди (II) нагревСкачать

Химопытка 2: качественная реакция глюкозы на альдегидную группу с гидроксидом меди (II)Скачать

Качественные реакции на глюкозуСкачать

ХимБонус - выпуск 41 - Качественная реакция глюкозы с гидроксидом меди (II)Скачать

Взаимодействие многоатомных спиртов с гидроксидом меди(II)Скачать

Качественная реакция на глюкозу I ЕГЭ по химииСкачать