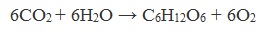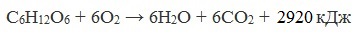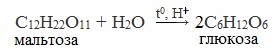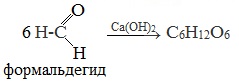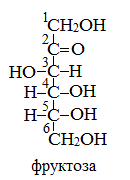МИКРОМЕТОДОМ ХАГЕДОРНА-ИЕНСЕНА
Метод основан на реакции окисления глюкозы (и других углеводов) гексациано-(III) ферратом калия в слабощелочной среде до глюконовой кислоты. Гексациано-(III) феррат калия восстанавливается до гексациано-(II) феррата. Гексациано-(III) феррат калия берут в избытке и неиспользованный остаток его определяют иодометрически в кислой среде. К пробам прибавляют иодид калия, выделившийся иод оттитровывают тиосульфатом натрия.
Реактивы и оборудование
─ 0,045% раствор сульфата цинка.
─ 0,1 и раствор гидроксида натрия.
─ Щелочной раствор гексациано-(III) феррата калия (1,65 г K3[Fe(CN)6] и 10,6 г безводного карбоната натрия доводят водой до 1 л).
─ Реактив А (10 г сульфата цинка и 50 г хлорида натрия доводят водой до 200 мл).
─ Реактив Б (к 40 мл реактива А перед использованием добавляют 1 г иодида калия).
─ 3%-ная уксусная кислота.
─ 0,005 и тиосульфат натрия.
─ Колбы для титрования, воронки, баня водяная, пипетки, пробирки, вата гигроскопическая.
Ход работы
Подписывают 2 опытные и 2 контрольные пробирки и прибавляют реагенты по схеме, приведённой на с.30.
Содержание глюкозы рассчитывают по таблице на с. 31.
Затем из содержания глюкозы в опытной пробе вычитают содержание глюкозы в контрольной пробе и по найденной разности находят количество глюкозы в 100 мл крови:
x = разность * 100 / 0,1 (мг).
Схема прибавления реактивов для определения содержания глюкозы
| № | Операция | Опыт | Контроль |
| 1. | Дистиллированная вода | — | 0,1 мл |
| 2. | Сыворотка | 0,1 мл | — |
| 3. | 1 мл 0,1 и NaOH и 4 мл 0,45% ZnNO4 | + | + |
| 4. | Инкубация на кипящей водяной бане | 3 мин. | 3 мин. |
| 5. | Фильтрование в колбу для титрования | + | + |
| 6. | Щелочной раствор K3[Fe(CN)6] | 2 мл | 2 мл |
| 7. | Инкубация на кипящей водяной бане | 15 мин. | 15 мин. |
| 8. | Охлаждение до комнатной температуры | + | + |
| 9. | 3 мл реактива Б, 2 мл 3% уксусной кислоты, 5-6 капель раствора крахмала | + | + |
| 10. | Титрование раствором тиосульфата | + | + |
Содержание отчёта
| Объём тиосульфата натрия, израсходованного на титрование | Содержание глюкозы (мг) | |||
| опытных проб | контрольных проб | |||
| среднее | среднее | опыт | контроль | разность |
Содержание глюкозы в крови равно:
Количество миллилитров 0,005 и раствора тиосульфата и соответствующее им количество миллиграмм глюкозы при использовании 2 мл 0,005 и раствора гексациано-(III) феррата калия:
| Объём раствора тиосульфата ( в мл) | ||||||||||
| 0,00 | 0,01 | 0,02 | 0,03 | 0,04 | 0,05 | 0,06 | 0,07 | 0,08 | 0,09 | |
| 0,0 | 0,385 | 0,382 | 0,379 | 0,376 | 0,373 | 0,370 | 0,367 | 0,364 | 0,361 | 0,358 |
| 0,1 | 0,355 | 0,352 | 0,350 | 0,348 | 0,345 | 0,343 | 0,341 | 0,338 | 0,336 | 0,333 |
| 0,2 | 0,331 | 0,329 | 0,327 | 0,325 | 0,323 | 0,321 | 0,318 | 0,316 | 0,314 | 0,312 |
| 0,3 | 0,310 | 0,308 | 0,306 | 0,304 | 0,302 | 0,300 | 0,298 | 0,296 | 0,294 | 0,292 |
| 0,4 | 0,290 | 0,288 | 0,286 | 0,284 | 0,282 | 0,280 | 0,278 | 0,276 | 0,274 | 0,272 |
| 0,5 | 0,270 | 0,268 | 0,266 | 0,264 | 0,262 | 0,260 | 0,259 | 0,257 | 0,255 | 0,253 |
| 0,6 | 0,251 | 0,249 | 0,247 | 0,245 | 0,243 | 0,241 | 0,240 | 0,238 | 0,236 | 0,234 |
| 0,7 | 0,232 | 0,230 | 0,228 | 0,226 | 0,224 | 0,222 | 0,221 | 0,219 | 0,217 | 0,215 |
| 0,8 | 0,213 | 0,211 | 0,209 | 0,208 | 0,206 | 0,204 | 0,202 | 0,200 | 0,199 | 0,197 |
| 0,9 | 0,195 | 0,193 | 0,191 | 0,190 | 0,188 | 0,186 | 0,184 | 0,182 | 0,181 | 0,179 |
| 1,0 | 0,177 | 0,175 | 0,173 | 0,172 | 0,170 | 0,168 | 0,166 | 0,164 | 0,163 | 0,161 |
| 1,1 | 0,159 | 0,157 | 0,155 | 0,154 | 0,152 | 0,150 | 0,148 | 0,146 | 0,145 | 0,143 |
| 1,2 | 0,141 | 0,139 | 0,138 | 0,136 | 0,134 | 0,132 | 0,131 | 0,129 | 0,127 | 0,125 |
| 1,3 | 0,124 | 0,122 | 0,120 | 0,119 | 0,117 | 0,115 | 0,113 | 0,111 | 0,110 | 0,108 |
| 1,4 | 0,106 | 0,104 | 0,102 | 0,101 | 0, 099 | 0, 097 | 0, 095 | 0, 093 | 0, 092 | 0, 090 |
| 1,5 | 0,088 | 0,086 | 0,084 | 0,083 | 0,081 | 0,079 | 0,077 | 0,075 | 0,074 | 0,072 |
| 1,6 | 0,070 | 0,068 | 0,066 | 0,065 | 0,063 | 0,061 | 0,059 | 0,057 | 0,056 | 0,054 |
| 1,7 | 0,052 | 0,050 | 0,048 | 0,047 | 0,045 | 0,043 | 0,041 | 0,039 | 0,038 | 0,036 |
| 1,8 | 0,034 | 0,032 | 0,031 | 0,029 | 0,027 | 0,025 | 0,024 | 0,022 | 0,020 | 0,015 |
| 1,9 | 0,017 | 0,015 | 0,014 | 0,012 | 0,010 | 0,008 | 0,007 | 0,005 | 0,003 | 0,002 |
Контрольные вопросы
- Напишите уравнения реакций, на которых основано определение глюкозы методом Хагедорна-Иенсена.
- О чём может свидетельствовать пониженное или повышенное содержание глюкозы в крови?
- Механизмы гормональной регуляции уровня глюкозы в крови.
Лабораторная работа №10
КАЧЕСТВЕННЫЕ РЕАКЦИИ НА ЛИПИДЫ
Ход работы
Опыт 1. Выделение лецитина из яичного желтка
К 1/6 части яичного желтка добавляют 5-7 мл кипящего этанола и тщательно перемешивают в течение 5-10 мин. Затем жидкость фильтруют в сухую пробирку через сухой фильтр.
Опыт 2. Получение эмульсии лецитина
К 5 каплям спиртового раствора лецитина прибавляют 20-30 капель воды. Образуется эмульсия лецитина в воде.
Опыт 3. Осаждение лецитина
К 5 каплям спиртового раствора лецитина прибавить 1-2 капли насыщенного спиртового раствора хлористого кадмия. Наблюдать образование осадка нерастворимого соединения лецитина.
Опыт 4. Гидролиз лецитина
К 5-10 каплям спиртового раствора лецитина добавляют такой же объём 10% раствора NaOH и кипятят 5 мин. Лецитин при этом распадается на глицерин, жирные кислоты, холин и фосфорную кислоту. Из холина образуется триметиламин, который обнаруживается по запаху селёдочного раствора.
Опыт 5. Реакция на холестерин
К 10 каплям хлороформного раствора холестерина или растительного масла прибавляют равный объём концентрированной серной кислоты (осторожно, по стенке). При лёгком встряхивании на границе двух слоёв жидкости образуется оранжевое кольцо, которое при стоянии переходит в красное. Нижний слой серной кислоты приобретает зеленую флюоресценцию.
Содержание отчёта
Полученные результаты заносят в таблицу:
| Реакция | Наблюдаемый эффект |
Контрольные вопросы
- Перечислите представителей класса липидов, имеющих непосредственное отношение к образованию биомембран. Обьясните почему именно эти липиды.
- Напишите уравнение гидролиза лецитина.
- Почему для осаждения лецитина используется спиртовой, а не водный раствор хлорида кадмия?
- В нервной ткани относительное содержания липидов выше, чем в любой другой
- ( разумеется кроме жировой ткани). Попытайтесь дать этому факту обяьснение.
Уравнение гидролиза лецитина:
Видео:Аэробный и анаэробный гликолиз. Реакции катаболизма глюкозы. Расчет выхода АТФ в гликолизеСкачать

Контроль качества лекарственных средств, изготовляемых в аптеках (стр. 16 )
 | Из за большого объема этот материал размещен на нескольких страницах: 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 |
9.5.1 Раствор глюкозы 5, 10, 20, 25% для инъекций.
Раствор глюкозы 5, 10, 20, 25% для инъекций.
Глюкозы безводной 50, 100, 200, 250 г.
Раствор кислоты хлороводородной (0,1 моль/л) до рН 3,0-4,1-5 мл
Натрия хлорида 0,26 г.
Воды для инъекций до 1 л
К раствору глюкозы прибавляют стабилизатор Вейбеля в количестве 5% от общего объема раствора состава:
Натрия хлорида 5,2 г
Кислоты хлороводородной разведенной 4,4 мл
Воды для инъекций до 1 л
Описание. Прозрачная бесцветная жидкость.
1. К 0,5 мл раствора прибвляют 3мл реактива Фелинга и нагревают до кипения. Образуется кирпично-красный осадок.
2. Помещают 2-3 капли раствора в фарфоровую чашку и выпаривают на водяной бане досуха. После охлаждения к сухому остатку прибавляют 0,01 г тимола, 5-6 капель концентрированной серной кислоты и 2 капли воды. Появляется красно-фиолетовое окрашивание.
Хлорид-ион. К 1 мл раствора прибавляют по 2-3 капли кислоты азотной разведенной и раствора серебра нитрата. Образуется белый творожистый осадок, растворимый в растворе аммиака.
Натрий-ион. Графитовую палочку, смоченную раствором, вносят в бесцветное пламя. Пламя окрашивается в желтый цвет.
1. К 2-3 мл раствора прибавляют 1 каплю раствора метилового красного. Раствор окрашивается в красный цвет.
2. К 2-3 мл раствора прибавляют 1 каплю метилового оранжевого. Раствор окрашивается в розовый цвет. рН 3,0-4,1 (потенциометрически или по универсальной индикаторной бумаге).
Глюкоза (м. м. 180,14)
Содержание глюкозы (Х) в г в 1 мл раствора вычисляют по формуле:
Содержание глюкозы в 1 мл раствора должно быть 0,0485-0,0515; 0,097-0,103; 0,194-0,206; 0,242-0,258г.
5 мл раствора помещают в мерную колбу вместимостью 25 мл и доводят водой до метки.
1 мл разведения помещают в склянку с притертой пробкой, прибавляют 2,5 мл раствора йода (0,1 моль/л) УЧ (1/2 I2), 0,5 мл раствора натрия гидроксида (1 моль/л) и оставляют в темном месте на 5 минут. Затем прибавляют 0,5 мл кислоты серной разведенной. Избыток йода оттитровывают раствором натрия тиосульфата (0,1 моль/л). Индикатор – крахмал. Параллельно проводят контрольный опыт.
Определение стабилизатора в растворе глюкозы.
К 25 мл раствора прибавляют 1 каплю метилового красного и титруют раствором натрия гидроксида (0,02 моль/л) от красного до желтого окрашивания (А мл).
1 мл раствора натрия гидроксида (0,02 моль/л) соответствует 0,0007292 г хлороводорода. Содержание раствора хлороводородной кислоты (0,1 моль/л) (Х) в 1 мл раствора вычисляют по формуле:

где 0,003646 – содержание хлороводорода в 1 мл раствора кислоты хлороводородной (0,1 моль/л),
а – навеска лекарственной формы (25 мл).
Натрия хлорид и кислота хлороводородная.
К 2 мл раствора прибавляют 1-2 капли раствора калия хромата и титруют раствором серебра нитрата (0,02 моль/л) до появления красноватого осадка (Б, мл).
М. м. натрия хлорида 58,44
Содержание натрия хлорида (Х) в г в 1 мл вычисляют по формуле:
К 25 мл раствора глюкозы прибавляют 1-2 капли раствора калия хромата и титруют раствором серебра нитрата (0,1 моль/л) до появления красноватого осадка.
1 мл раствора серебра нитрата (0,1 моль/л) соответствует 0,0097 г суммы натрия хлорида и кислоты хлороводородной разведенной, которых в 1 мл раствора должно быть 0,00043-0,00053 г.
Содержание суммы натрия хлорида и кислоты хлороводородной разведенной (Г∑) в г 1 мл раствора рассчитывают по формуле:
Теоретический расчет суммы натрия хлорида и кислоты хлороводородной в 1мл раствора глюкозы.
Натрия хлорид 5,2 г
Кислоты хлороводородной разведенной 4,4 мл
Воды для инъекций до 1 л
В 1 литр стабилизатора содержится 9,6 г суммы NaCl и HCl разв.
На 1 литр раствора глюкозы добавлено 50 мл стабилизатора (5%):
В 1000 мл — 9,6 г суммы NaCl и HCl разв.
В 50 мл — х г суммы NaCl и HCl разв.
х=0,48 г суммы NaCl и HCl разв. в 1 л раствора глюкозы; 0,00048 г суммы NaCl и HCl разв. в 1 мл расвора глюкозы.
Расчет среднего титра натрия хлорида и кислоты хлороводородной разведенной.


9.5.2 Раствор кислоты аскорбиновой 5% или 10% для инъекций.
Кислота аскорбиновая 50 г или 100 г
Натрия гидрокарбоната 23,85 г или 47,7 г
Натрия сульфита безводного 2,0 г
Воды для инъекций до 1 л
Описание. Бесцветная прозрачная жидкость.
1. К 2-3 каплям раствора прибавляют 3-5 капель воды и 2-3 капли раствора серебра нитрата. Образуется темный осадок.
2. К 1 капле раствора прибавляют 5-6 мл воды, по 1 капле раствора гексациано-(III)феррата калия и железа (III) хлорида. Появляется синее окрашивание.
К 1 мл раствора прибавляют 2-3 капли раствора бария хлорида. Образуется белый осадок, растворимый в разведенной хлороводородной кислоте.
рН 6,0-7,0 (потенциометрически или по универсальной индикаторной бумаге).
Кислота аскорбиновая (М. м. 176,12)
К 0,5 мл раствора прибавляют 0,15 мл (5-6 капель) 40% раствора формальдегида, 4 мл свежепрокипяченной и охлажденной воды, 1 мл кислоты серной разведенной и сразу же титруют раствором йода (0,1 моль/л) УЧ (1/2 I2) до синего окрашивания (индикатор – крахмал) (А, мл).
В 1 мл раствора должно быть 0,0475-0,0525 г или 0,097-0,103 г аскорбиновой кислоты.
Кислота аскорбиновая и натрия сульфит.
К 0,5 мл раствора прибавляют 4 мл свежепрокипяченной и охлажденной воды, 1 мл кислоты серной разведенной и сразу же титруют раствором йода (0,1 моль/л) УЧ (1/2 I2) до синего окрашивания (индикатор – крахмал) (Б, мл).
1 мл раствора йода (0,1 моль/л) УЧ (1/2 I2) соответствует 0,008673 г (для 5% раствора) или 0,008738 г (для 10% раствора) суммарного количества кислоты аскорбиновой и натрия сульфита, которых в 1 мл раствора должно быть 0,0493-0,0547 или 0,099-0,105 г.
Рассчитывают либо суммарное количество кислоты аскорбиновой и натрия сульфита в г в 1 мл по среднему титру, либо содержание натрия сульфита безводного в г в 1 мл.
Содержание натрия сульфита безводного (Х) в г в 1 мл раствора может быть вычислено по формуле:
1 мл раствора йода (0,1 моль/л) УЧ (1/2 I2) соответствует 0,006302 натрия сульфита безводного, которого в 1 мл раствора должно быть 0,0018-0,0022 г.
М. м. натрия сульфита водного 252,18
М. м. натрия сульфита безводного 126,04
К 0,5 мл раствора прибавляют 2,5 мл 1% раствора формальдегида, 4 мл 2% раствора кислоты хлороводородной, 0,5 мл 1% раствора калия иодида, 2мл раствора крахмала и титруют раствором калия йодата (0,1 моль/л, УЧ 1/6 KIO3) до устойчивого синего окрашивания (А, мл).
Кислота аскорбиновая и натрия сульфит.
К 0,5 мл раствора прибавляют 4 мл 2% раствора кислоты хлороводородной, 0,5 мл 1% раствора калия иодида, 2 мл раствора крахмала и титруют раствором калия йодата (0,1 моль/л, УЧ 1/6 KIO3) до устойчивого синего окрашивания (Б, мл).
Расчеты см. вар. 1.
Калия хлорида 1,5
Натрия хлорида 4,75
Натрия ацетата 3,6
Воды для инъекций до 1 л
Описание. Бесцветная прозрачная жидкость.
Хлориды. К 4-5 каплям раствора прибавляют мл разведенной азотной кислоты и 2-3 капли раствора нитрата серебра. Образуется белый творожистый осадок, растворимый в растворе аммиака.
Калий-ион. Упаривают 2 мл раствора на водяной бане до мл, прибавляют 2-3 капли разведенной уксусной кислоты и 1-2 капли гексанитро-(III)кобальтата натрия. Постепенно образуется желтый кристаллический осадок.
Натрий-ион. Микрокристаллоскопическая реакция с пикриновой кислотой.
Натрия ацетат. К 2-3 мл раствора прибавляют 3-5 капель раствора железа(III)хлорида. Появляется красно-бурое окрашивание.
рН 6,5-7,5 (потенциометрически или по универсальной индикаторной бумаге).
Натрия хлорид и калия хлорид.
1 мл раствора титруют раствором серебра нитрата (0,1 моль/л) до появления красноватого осадка) (индикатор – калия хромат).
1 мл раствора серебра нитрата соответствует 0,006164 г суммарного количественного натрия хлорида и калия хлорида, которых в 1 мл раствора должно быть 0,0059-0,0066 г.
Натрия ацетат (М. м. 136,08).
5 мл раствора титруют раствором хлороводородной кислоты (0,1 моль/л) до желтого окрашивания (индикатор — бромфеноловый синий).
1 мл раствора хлороводородной кислоты (0,1 моль/л) соответствует 0,01361 г натрия ацетата (водного), которого в 1 мл раствора должно быть 0,0035-0,0038 г.
К 5 мл раствора прибавляют 10 мл эфира, 2 капли раствора метилового оранжевого, 1 каплю метиленовой сини и титруют раствором хлороводородной кислоты (0,1 моль/л) до перехода зеленой окраски в фиолетовую с окраской в контрольном опыте.
Видео:Алгоритм определения глюкозы в крови.Скачать

Глюкоза количественное определение уравнение реакции
Глюкоза С6Н12O6 представляет собой наиболее распространенный и наиболее важный моносахарид — гексозу. Она является структурной единицей большинства пищевых ди- и полисахаридов.
Биологическая роль глюкозы
Глюкоза образуется в природе в процессе фотосинтеза, протекающего под действием солнечного света в листьях растений:
Глюкоза – ценное питательное вещество. Она является обязательным компонентом крови и тканей животных и непосредственным источником энергии для клеточных реакций. При окислении ее в тканях освобождается энергия, необходимая для нормальной жизнедеятельности организмов:
Глюкоза – необходимый компонент обмена углеводов. Она необходима для образования в печени гликогена (запасной углевод человека и животных).
Уровень содержания глюкозы в крови человека постоянен. Во всем объеме крови взрослого человека содержится 5-6 г глюкозы. Такого количества достаточно для покрытия энергетических затрат организма в течение 15 минут его жизнедеятельности.
При снижении ее уровня в крови или высокой концентрации и невозможности использования, как это происходит при сахарном диабете, наступает сонливость, может наступить потеря сознания (гипогликемическая кома).
Строение глюкозы. Изомерия
В молекуле глюкозы присутствуют альдегидная и гидроксильная группы.
Видеоопыт «Распознавание глюкозы с помощью качественных реакций»
Моносахаридам свойственна также иная структура, возникающая в результате внутримолекулярной реакции между карбонильной группой с одним из спиртовых гидроксидов. Такая реакция внутри одной молекулы сопровождается ее циклизацией.
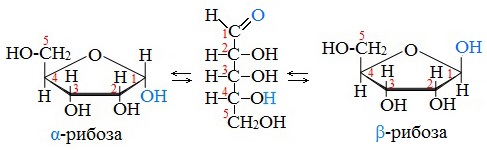
Известно, что наиболее устойчивыми являются 5-ти и 6-ти членные циклы. Поэтому, как правило, происходит взаимодействие карбонильной группы с гидроксилом при 4-м или 5-м углеродном атоме.
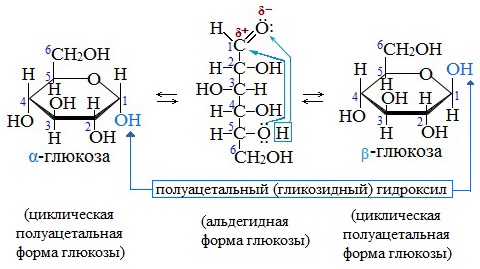
В результате взаимодействия карбонильной группы с одной из гидроксильных глюкоза может существовать в двух формах: открытой цепной и циклической.
Образование циклической формы глюкозы при взаимодействии альдегидной группы и спиртового гидроксила при С5 приводит к появлению нового гидроксила у С1 называемого полуацетальным (крайний правый). Он отличается от других большей реакционной способностью, а циклическую форму в этом случае называют также полуацетальной.
В кристаллическом состоянии глюкоза находится в циклической форме, а при растворении частично переходит в открытую и устанавливается состояние подвижного равновесия.
Например, в водном растворе глюкозы существуют следующие структуры:
Подвижное равновесие между взаимопревращающимися структурными изомерами (таутомерами) называется таутомерией. Данный случай относится к цикло-цепной таутомерии моносахаридов.
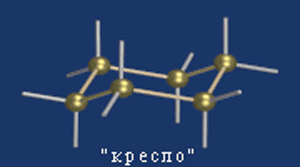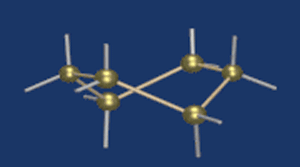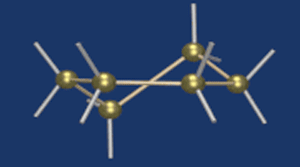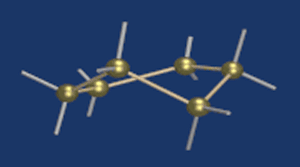
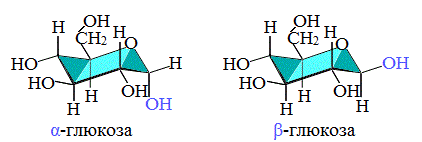
Циклические α- и β-формы глюкозы представляют собой пространственные изомеры, отличающиеся положением полуацетального гидроксила относительно плоскости кольца.
В α-глюкозе этот гидроксил находится в транс-положении к гидроксиметильной группе -СН2ОН, в β-глюкозе – в цис-положении.
С учетом пространственного строения шестичленного цикла
формулы этих изомеров имеют вид:
Видеофильм «Глюкоза и ее изомеры»
Аналогичные процессы происходят и в растворе рибозы:
В твердом состоянии глюкоза имеет циклическое строение.
Обычная кристаллическая глюкоза – это α-форма. В растворе более устойчива β-форма (при установившемся равновесии на неё приходится более 60% молекул).
Доля альдегидной формы в равновесии незначительна. Это объясняет отсутствие взаимодействия с фуксинсернистой кислотой (качественная реакция альдегидов).
Явление существования веществ в нескольких взаимопревращающихся изомерных формах было названо А. М. Бутлеровым динамической изомерией. Позднее это явление было названо таутомерией.
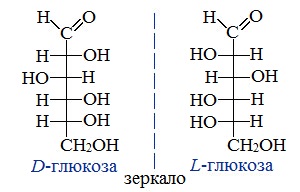
Для глюкозы кроме явления таутомерии характерны структурная изомерия с кетонами (глюкоза и фруктоза – структурные межклассовые изомеры) и оптическая изомерия:
Физические свойства глюкозы
Глюкоза – бесцветное кристаллическое вещество, хорошо растворимое в воде, сладкое на вкус (лат. «глюкос» – сладкий).
Она содержится в растительных и живых организмах, особенно много ее содержится в виноградном соке (отсюда и название – виноградный сахар), в спелых фруктах и ягодах. Мед в основном состоит из смеси глюкозы с фруктозой.
В крови человека ее содержится примерно 0,1 %
Видеоопыт «Определение глюкозы в виноградном соке»
Получение глюкозы
Основным способом получения моносахаридов, имеющим практическое значения, является гидролиз ди- и полисахароидов.
1. Гидролиз полисахаридов
Глюкозу чаще всего получают гидролизом крахмала (промышленный способ получения):
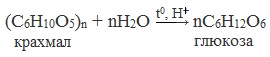
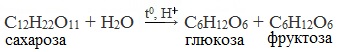
Первый синтез углеводов из формальдегида в щелочной среде осуществил А.М. Бутлеров в 1861 году.
4. Фотосинтез
В природе глюкоза образуется в растениях в результате фотосинтеза:
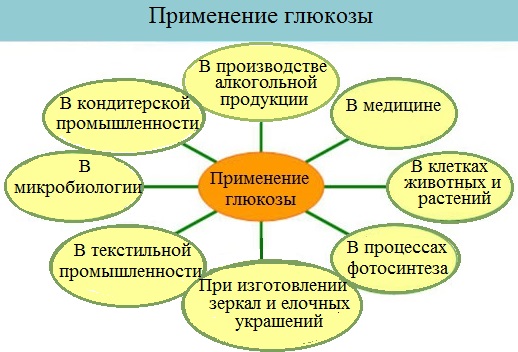
Применение глюкозы
Глюкоза применяется в медицине в качестве укрепляющего лечебного средства при явлениях сердечной слабости, шоке, для приготовления лечебных препаратов, консервирования крови, внутривенного вливания, при самых разнообразных заболеваниях (особенно при истощении организма).
Широко применяют глюкозу в кондитерском деле (изготовление мармелада, карамели, пряников и т. д.)
Глюкоза находит широкое применение в текстильной промышленности при крашении и печатании рисунков.
Глюкоза применяется в качестве исходного продукта при производстве аскорбиновых и глюконовых кислот, для синтеза ряда производных сахаров и т.д.
Она применяется в производстве зеркал и елочных игрушек (серебрение).
В микробиологической промышленности как питательная среда для получения кормовых дрожжей.
Большое значение имеют процессы брожения глюкозы. Так, например, при квашении капусты, огурцов, молока происходит молочнокислое брожение глюкозы, так же как и при силосовании кормов. Если подвергаемая силосованию масса недостаточно уплотнена, то под влиянием проникшего воздуха происходит маслянокислое брожение и корм становится непригоден к применению.
На практике используется также спиртовое брожение глюкозы, например при производстве пива.
Фруктоза
Фруктоза (фруктовый сахар) С6Н12О6 – изомер глюкозы. Фруктоза в свободном виде содержится в фруктах, меде. Входит в состав сахарозы и полисахарида инсулина. Она слаще глюкозы и сахарозы. Ценный питательный продукт.
В отличие от глюкозы она может без участия инсулина проникать из крови в клетки тканей. По этой причине фруктоза рекомендуется в качестве наиболее безопасного источника углеводов для больных диабетом.
Как и глюкоза, она может существовать в линейной и циклических формах. В линейной форме фруктоза представляет собой кетоноспирт с пятью гидроксильными группами.
Строение ее молекулы можно выразить формулой:
Имея гидроксильные группы, фруктоза, как и глюкоза, способна образовывать сахараты и сложные эфиры. Однако вследствие отсутствия альдегидной группы она в меньшей степени подвержена окислению, чем глюкоза. Фруктоза, также как и глюкоза, не подвергается гидролизу.
Фруктоза вступает во все реакции многоатомных спиртов, но, в отличие от глюкозы, не реагирует с аммиачным раствором оксида серебра.
🎬 Видео
Качественная реакция глюкозы с гидроксидом меди (II)Скачать

Реакция глюкозы с аммиачным раствором оксида серебраСкачать

25. Схема реакции и химическое уравнениеСкачать

Качественные реакции на глицерин, глюкозу и сахарозуСкачать

Опыты по химии. Обнаружение глюкозы в виноградном соке и медеСкачать

Реакция глюкозы с гидроксидом меди (II)Скачать

Опыт по химии. Определение глюкозыСкачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Решение задач на термохимические уравнения. 8 класс.Скачать

Как за 4 МИНУТЫ выучить Химию? Химическое Количество, Моль и Закон АвогадроСкачать

Свойства глюкозы. 11 класс.Скачать
Анализ крови на сахар | Норма глюкозы в крови | Как подготовиться к анализу | Высокий и Низкий сахарСкачать

СОП: ГлюкометрияСкачать

Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Химия | Тепловой эффект химической реакции (энтальпия)Скачать

Глюкоза строение, свойства, применение | Химия 10 класс #38 | ИнфоурокСкачать

Биохимия. Качественные реакции для определения белков, аминокислот и углеводов (С. Смирнов)Скачать

ТИПОВЫЕ ЗАДАЧИ ПО ХИМИИ: Химическое Количество Вещества, Моль, Молярная Масса и Молярный ОбъемСкачать