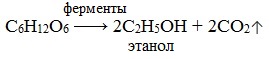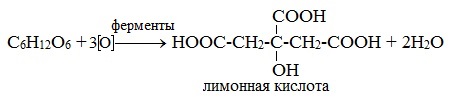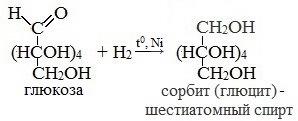Химические свойства глюкозы, как и других альдоз, обусловлены присутствием в ее молекуле: а)альдегидной группы; б) спиртовых гидроксилов; в) полуацетального (гликозидного) гидроксила.
- Специфические свойства
- Реакции с участием альдегидной группы глюкозы (свойства глюкозы как альдегида)
- Реакции глюкозы с участием гидроксильных групп (свойства глюкозы как многоатомного спирта)
- Реакции с участием полуацетального гидроксила
- Реакции окисления
- Please wait.
- We are checking your browser. gomolog.ru
- Why do I have to complete a CAPTCHA?
- What can I do to prevent this in the future?
- Этанол: химические свойства и получение
- Строение этанола
- Водородные связи и физические свойства спиртов
- Изомерия спиртов
- Структурная изомерия
- Химические свойства этанола
- 1.1. Взаимодействие с раствором щелочей
- 1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
- 2. Реакции замещения группы ОН
- 2.1. Взаимодействие с галогеноводородами
- 2.2. Взаимодействие с аммиаком
- 2.3. Этерификация (образование сложных эфиров)
- 2.4. Взаимодействие с кислотами-гидроксидами
- 3. Реакции замещения группы ОН
- 3.1. Внутримолекулярная дегидратация
- 3.2. Межмолекулярная дегидратация
- 4. Окисление этанола
- 4.1. Окисление оксидом меди (II)
- 4.2. Окисление кислородом в присутствии катализатора
- 4.3. Жесткое окисление
- 4.4. Горение спиртов
- 5. Дегидрирование этанола
- Получение этанола
- 1. Щелочной гидролиз галогеналканов
- 2. Гидратация алкенов
- 3. Гидрирование карбонильных соединений
- 4. Получение этанола спиртовым брожением глюкозы
Специфические свойства
1. Брожение (ферментация) моносахаридов
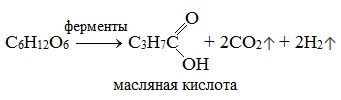
Важнейшим свойством моносахаридов является их ферментативное брожение, т.е. распад молекул на осколки под действием различных ферментов. Брожению подвергаются в основном гексозы в присутствии ферментов, выделяемых дрожжевыми грибками, бактериями или плесневыми грибками. В зависимости от природы действующего фермента различают реакции следующих видов:
1) Спиртовое брожение
2) Молочнокислое брожение
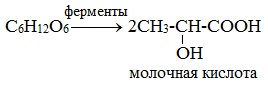
3) Маслянокислое брожение
4) Лимоннокислое брожение
Реакции с участием альдегидной группы глюкозы (свойства глюкозы как альдегида)
1. Восстановление (гидрирование) с образованием многоатомного спирта
В ходе этой реакции карбонильная группа восстанавливается и образуется новая спиртовая группа:
Cорбит содержится во многих ягодах и фруктах, особенно много сорбита в плодах рябины.
2. Окисление
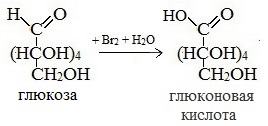
1) Окисление бромной водой
Качественные реакции на глюкозу как альдегид!
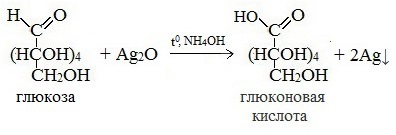
Протекающие в щелочной среде при нагревании реакции с аммиачным раствором Ag2O (реакция серебряного зеркала») и с гидроксидом меди (II) Cu (OH)2 приводят к образованию смеси продуктов окисления глюкозы.
2) Реакция серебряного зеркала
Соль этой кислоты – глюконат кальция – известное лекарственное средство.
Видеоопыт «Качественная реакция глюкозы с аммиачным раствором оксида серебра (I)»
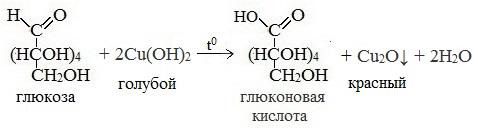
3) Окисление гидроксидом меди (II)
В ходе этих реакций альдегидная группа – СНО окисляется до карбоксильной группы – СООН.
Реакции глюкозы с участием гидроксильных групп (свойства глюкозы как многоатомного спирта)
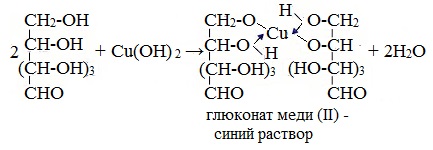
1. Взаимодействие с Cu (ОН)2 с образованием глюконата меди (II)
Качественная реакция на глюкозу как многоатомный спирт!
Подобно этиленгликолю и глицерину, глюкоза способна растворять гидроксид меди (II), образуя растворимое комплексное соединение синего цвета:
Прильём к раствору глюкозы несколько капель раствора сульфата меди (II) и раствор щелочи. Осадка гидроксида меди не образуется. Раствор окрашивается в ярко-синий цвет.
В данном случае глюкоза растворяет гидроксид меди (II) и ведет себя как многоатомный спирт, образуя комплексное соединение.
Видеоопыт «Качественная реакция глюкозы с гидроксидом меди (II)»
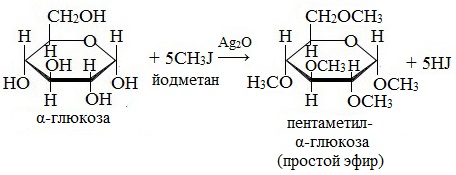
2. Взаимодействие с галогеналканами с образованием простых эфиров
Являясь многоатомным спиртом, глюкоза образует простые эфиры:
Реакция происходит в присутствии Ag2O для связывания выделяющегося при реакции НI.
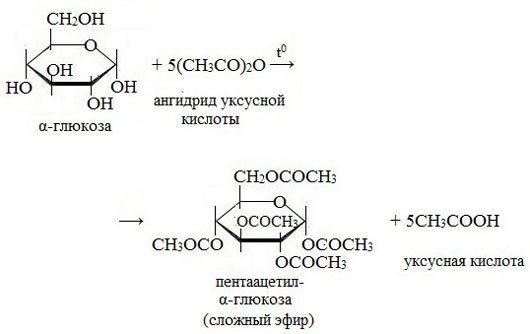
3. Взаимодействие с карбоновыми кислотами или их ангидридами с образованием сложных эфиров.
Например, с ангидридом уксусной кислоты:
Реакции с участием полуацетального гидроксила
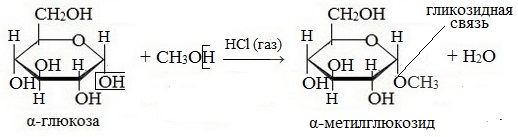
1. Взаимодействие со спиртами с образованием гликозидов
Гликозиды – это производные углеводов, у которых гликозидный гидроксил замещен на остаток какого-либо органического соединения.
Содержащийся в циклических формах глюкозы полуацетальный (гликозидный) гидроксил является очень реакционноспособным и легко замещается на остатки различных органических соединений.
В случае глюкозы гликозиды называются глюкозидами. Связь между углеводным остатком и остатком другого компонента называется гликозидной.
Гликозиды построены по типу простых эфиров.
При действии метилового спирта в присутствии газообразного хлористого водорода атом водорода гликозидного гидроксила замещается на метильную группу:
В данных условиях в реакцию вступает только гликозидный гидроксил, спиртовые гидроксильные группы в реакции не участвуют.
Гликозиды играют чрезвычайно важную роль в растительном и животном мире. Существует огромное число природных гликозидов, в молекулах которых с атомом С (1) глюкозы остатки самых различных соединений.
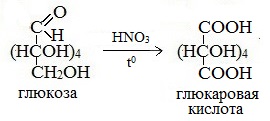
Реакции окисления
Более сильный окислитель – азотная кислота НNO3 – окисляет глюкозу до двухосновной глюкаровой (сахарной) кислоты:
В ходе этой реакции и альдегидная группа – СНО и первичная спиртовая группа — СН2ОН окисляются до карбоксильных – СООН.
Видеоопыт «Окисление глюкозы кислородом воздуха в присутствии метеленового голубого»
Видео:Аэробный и анаэробный гликолиз. Реакции катаболизма глюкозы. Расчет выхода АТФ в гликолизеСкачать

Please wait.
Видео:Глюкоза как многоатомный спиртСкачать

We are checking your browser. gomolog.ru
Видео:Великая тайна. Глюкоза - спирт из воздуха - ДоброварСкачать

Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
Видео:Из крахмала(I), глюкозы (II) и мальтозы(III) можно получить этиловый спирт. Расположите эти соединСкачать

What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6e00c128abf6716c • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Видео:Качественная реакция глюкозы с гидроксидом меди (II)Скачать

Этанол: химические свойства и получение
Этанол C2H5OH или CH3CH2OH, этиловый спирт – это органическое вещество, предельный одноатомный спирт .
Общая формула предельных нециклических одноатомных спиртов: CnH2n+2O.
Видео:Качественные реакции на глицерин, глюкозу и сахарозуСкачать

Строение этанола
В молекулах спиртов, помимо связей С–С и С–Н, присутствуют ковалентные полярные химические связи О–Н и С–О.
| Электроотрицательность кислорода (ЭО = 3,5) больше электроотрицательности водорода (ЭО = 2,1) и углерода (ЭО = 2,4). |
Электронная плотность обеих связей смещена к более электроотрицательному атому кислорода:
| Атом кислорода в спиртах находится в состоянии sp 3 -гибридизации. |
В образовании химических связей с атомами C и H участвуют две 2sp 3 -гибридные орбитали, а еще две 2sp 3 -гибридные орбитали заняты неподеленными электронными парами атома кислорода.
Поэтому валентный угол C–О–H близок к тетраэдрическому и составляет почти 108 о .
Водородные связи и физические свойства спиртов
Спирты образуют межмолекулярные водородные связи. Водородные связи вызывают притяжение и ассоциацию молекул спиртов:
Поэтому этанол – жидкость с относительно высокой температурой кипения (температура кипения этанола +78 о С).
Водородные связи образуются не только между молекулами спиртов, но и между молекулами спиртов и воды. Поэтому спирты очень хорошо растворимы в воде. Молекулы спиртов в воде гидратируются:
| Чем больше углеводородный радикал, тем меньше растворимость спирта в воде. Чем больше ОН-групп в спирте, тем больше растворимость в воде. |
Этанол смешивается с водой в любых соотношениях.
Видео:Спиртовое брожение глюкозыСкачать

Изомерия спиртов
Видео:Опыты по химии. Обнаружение глюкозы в виноградном соке и медеСкачать

Структурная изомерия
Для этанола характерна структурная изомерия – межклассовая изомерия.
Межклассовые изомеры — это вещества разных классов с различным строением, но одинаковым составом. Спирты являются межклассовыми изомерами с простыми эфирами. Общая формула и спиртов, и простых эфиров — CnH2n+2О.
| Например. Межклассовые изомеры с общей формулой С2Н6О этиловый спирт СН3–CH2–OH и диметиловый эфир CH3–O–CH3 |
| Этиловый спирт | Диметиловый эфир |
| СН3–CH2–OH | CH3–O–CH3 |
Видео:РЕАКЦИЯ ЭТЕРИФИКАЦИИСкачать

Химические свойства этанола
Спирты – органические вещества, молекулы которых содержат, помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.
1. Кислотные свойства
| Спирты – неэлектролиты, в водном растворе не диссоциируют на ионы; кислотные свойства у них выражены слабее, чем у воды. |
1.1. Взаимодействие с раствором щелочей
При взаимодействии этанола с растворами щелочей реакция практически не идет, т. к. образующийся алкоголят почти полностью гидролизуется водой.
Равновесие в этой реакции так сильно сдвинуто влево, что прямая реакция не идет. Поэтому этанол не взаимодействуют с растворами щелочей.
1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
Этанол взаимодействует с активными металлами (щелочными и щелочноземельными).
| Например, этанол взаимодействует с калием с образованием этилата калия и водорода . |
Алкоголяты под действием воды полностью гидролизуются с выделением спирта и гидроксида металла.
| Например, этилат калия разлагается водой: |
Видео:Химия 10 класс (Урок№11 - Полисахариды. Крахмал. Целлюлоза.)Скачать

2. Реакции замещения группы ОН
2.1. Взаимодействие с галогеноводородами
При взаимодействии спиртов с галогеноводородами группа ОН замещается на галоген и образуется галогеналкан.
| Например, этанол реагирует с бромоводородом. |
2.2. Взаимодействие с аммиаком
Гидроксогруппу спиртов можно заместить на аминогруппу при нагревании спирта с аммиаком на катализаторе.
| Например, при взаимодействии этанола с аммиаком образуется этиламин. |
2.3. Этерификация (образование сложных эфиров)
Одноатомные и многоатомные спирты вступают в реакции с карбоновыми кислотами, образуя сложные эфиры.
| Например, этанол реагирует с уксусной кислотой с образованием этилацетата (этилового эфира уксусной кислоты): |
2.4. Взаимодействие с кислотами-гидроксидами
Спирты взаимодействуют и с неорганическими кислотами, например, азотной или серной.
| Например, при взаимодействии этанола с азотной кислотой образуется сложный эфир этилнитрат : |
Видео:Реакция глюкозы с гидроксидом меди (II)Скачать

Видео:7.4. Спирты: Химические свойства. ЕГЭ по химииСкачать

3. Реакции замещения группы ОН
В присутствии концентрированной серной кислоты от спиртов отщепляется вода. Процесс дегидратации протекает по двум возможным направлениям: внутримолекулярная дегидратация и межмолекулярная дегидратация.
3.1. Внутримолекулярная дегидратация
При высокой температуре (больше 140 о С) происходит внутримолекулярная дегидратация и образуется соответствующий алкен.
| Например, из этанола под действием концентрированной серной кислоты при температуре выше 140 градусов образуется этилен: |
Видео:7.3. Спирты: Способы получения. ЕГЭ по химииСкачать

В качестве катализатора этой реакции также используют оксид алюминия.
3.2. Межмолекулярная дегидратация
При низкой температуре (меньше 140 о С) происходит межмолекулярная дегидратация по механизму нуклеофильного замещения: ОН-группа в одной молекуле спирта замещается на группу OR другой молекулы. Продуктом реакции является простой эфир.
| Например, при дегидратации этанола при температуре до 140 о С образуется диэтиловый эфир: |
Видео:Свойства глюкозы. 11 класс.Скачать
4. Окисление этанола
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на каталитическое, мягкое и жесткое.
| При окислении первичных спиртов они последовательно превращаются сначала в альдегиды, а потом в карбоновые кислоты. Глубина окисления зависит от окислителя. Первичный спирт → альдегид → карбоновая кислота |
Типичные окислители — оксид меди (II), перманганат калия KMnO4, K2Cr2O7, кислород в присутствии катализатора.
4.1. Окисление оксидом меди (II)
Cпирты можно окислить оксидом меди (II) при нагревании. При этом медь восстанавливается до простого вещества.
| Например, этанол окисляется оксидом меди до уксусного альдегида |
4.2. Окисление кислородом в присутствии катализатора
Cпирты можно окислить кислородом в присутствии катализатора (медь, оксид хрома (III) и др.).
4.3. Жесткое окисление
При жестком окислении под действием перманганатов или соединений хрома (VI) первичные спирты окисляются до карбоновых кислот.
| Например, при взаимодействии этанола с перманганатом калия в серной кислоте образуется уксусная кислота |
4.4. Горение спиртов
Образуются углекислый газ и вода и выделяется большое количество теплоты.
| Например, уравнение сгорания этанола: |
Видео:Углеводы. Тема 33. Химические свойства глюкозыСкачать

5. Дегидрирование этанола
При нагревании спиртов в присутствии медного катализатора протекает реакция дегидрирования.
| Например, при дегидрировании этанола образуется этаналь |
Видео:Расчёт по уравнению реакцииСкачать

Получение этанола
Видео:Получение этилового спирта по наукеСкачать

1. Щелочной гидролиз галогеналканов
При взаимодействии галогеналканов с водным раствором щелочей образуются спирты. Атом галогена в галогеналкане замещается на гидроксогруппу.
| Например, при нагревании хлорэтана с водным раствором гидроксида натрия образуется этанол |
Видео:Глюкоза строение, свойства, применение | Химия 10 класс #38 | ИнфоурокСкачать

2. Гидратация алкенов
Гидратация (присоединение воды) алкенов протекает в присутствии минеральных кислот. При присоединении воды к алкенам образуются спирты.
| Например, при взаимодействии этилена с водой образуется этиловый спирт. |
Видео:ХИМИЧЕСКИЕ СВОЙСТВА ГЛЮКОЗЫСкачать

3. Гидрирование карбонильных соединений
Присоединение водорода к альдегидам и кетонам протекает при нагревании в присутствии катализатора. При гидрировании альдегидов образуются первичные спирты, при гидрировании кетонов — вторичные спирты, а из формальдегида образуется метанол.
| Например, при гидрировании этаналя образуется этанол |
Видео:Сколько молей этилового спирта образуется при брожении 180 г глюкозы? А) 2 В)1 С) 1,5 D) 2,5 Е) 3Скачать

4. Получение этанола спиртовым брожением глюкозы
Для глюкозы характерно ферментативное брожение, то есть распад молекул на части под действием ферментов. Один из вариантов — спиртовое брожение.