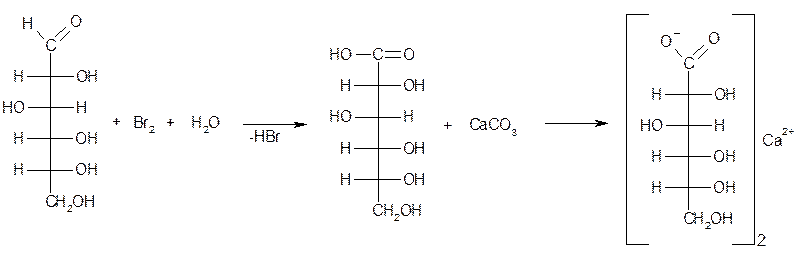Карбонат кальция CaCO3 — соль кальция и угольной кислоты. Белый, при прокаливании разлагается, плавится без разложения под избыточным давлением CO2. Практически не растворяется в воде.
Относительная молекулярная масса Mr = 100,09; относительная плотность для тв. и ж. состояния d= 2,93; tпл = 1242º C при избыточном давлении.
Видео:Реакция азотной кислоты и карбоната кальция, получение нитрата кальция/Obtaining calcium nitrateСкачать

Способ получения
1. Карбонат кальция можно получить путем взаимодействия хлорида кальция и карбоната кальция , образуется карбонат кальция и хлорид натрия:
2. В результате взаимодействия при комнатной температуре оксида кальция и углекислого газа происходит образование карбоната кальция:
3. Гидроксид кальция вступает в взаимодействие с углекислым газом и образует карбонат кальция и воду:
Видео:Взаимодействие карбоната кальция с соляной кислотой I ЕГЭ по химииСкачать

Качественная реакция
Качественная реакция на карбонат кальция — взаимодействие его с раствором сильных кислот. В результате реакции происходит бурное выделение углекислого газа, образование которого можно проверить, если пропустить его через известковую воду, которая мутнеет из-за образования осадка:
1. При взаимодействии с хлороводородной кислотой, карбонат кальция образует хлорид кальция, углекислый газ и воду:
Видео:Опыты по химии. Разложение карбоната кальция при нагреванииСкачать

Химические свойства
1. Карбонат кальция разлагается при температуре выше 900 — 1200º С, с образованием оксида кальция и углекислого газа:
2. Карбонат кальция вступает в реакцию со многими сложными веществами :
2.1. Карбонат кальция реагирует с оксидами :
2.1.1. Карбонат лития вступает в взаимодействие с оксидом кремния при 800º С и образует на выходе силикат кальция и углекислый газ:
2.2. Карбонат кальция реагирует с кислотами :
2.2.1. При взаимодействии с разбавленной хлороводородной кислотой карбонат кальция образует хлорид кальция, углекислый газ и воду:
2.2.2. Карбонат кальция реагирует с разбавленной плавиковой кислотой . Взаимодействие карбоната кальция с плавиковой кислотой приводит к образованию фторида кальция, воды и углекислого газа:
2.2.3. Карбонат кальция взаимодействует с сероводородной кислотой при 900º С и образует сульфид кальция, воду и углекислый газ:
3. Карбонат кальция реагирует с простыми веществами:
3.1. Карбонат кальция при 800 — 850º С вступает в реакцию с углеродом (коксом) образуя оксид кальция и угарный газ:
CaCO3 + C = CaO + 2CO
Видео:химическая реакция соляной кислоты и карбоната кальцияСкачать

Лекарственные препараты карбоновых кислот алифатического ряда и их производных (стр. 1 )
 | Из за большого объема этот материал размещен на нескольких страницах: 1 2 3 |
Министерство здравоохранения и социального развития Российской Федерации
Волгоградский государственный медицинский университет
карбоновых кислот АЛИФАТИЧЕСКОГО РЯДА
и их производных
Составители: Солодунова К. Н.,
под редакцией док. хим. наук, профессора ,
карбоновых кислот АЛИФАТИЧЕСКОГО РЯДА
и их производных
Учебно-методическое пособие по фармацевтической химии
для студентов III курса фармацевтического факультета
Пособие включает в себя общую характеристику препаратов производ-ных карбоновых кислот, зависимость «структура-активность». В каждой группе препаратов рассматриваются синтез и полный фармацевтический анализ. Практическая часть представлена лабораторными работами с конкретными методиками. Каждая тема заканчивается тестовыми заданиями по рассмотренному материалу.
, докт. фарм. наук, доцент кафедры управления и экономики фармации, медицинского и фармацевтического товароведения.
докт. фарм. наук, профессор кафедры фармацев-тической технологии и биотехнологии.
Рекомендовано ЦМС: протокол /5 от 22 декабря 2010 г.
Волгоградский государственный медицинский университет
г. Волгоград, пл. Павших борцов,1.
Карбоновые кислоты алифатического ряда и их соли
Лабораторная работа №1:
Определение подлинности препаратов карбоно-вых кислот и их солей
Аминокислоты алифатического ряда
кислоты γ-аминомасляная, ε-аминокапроновая
цистеин, ацетилцистеин, метианин, пеницилл-амин
натрия, кальция эдетеат
Лабораторная работа №2:
Определение подлинности препаратов амино-кислот и их солей
Ответы на тесты
Сформировать область знаний в методологии синтеза и оценки качества лекарственных веществ ряда карбоновых кислот (установление подлинности, контроль чистоты и количественное определение).
ü изучить строение кислот и их производных;
ü исследовать свойства и фармакологическое действие лекарственных веществ данного ряда;
ü изучить способы получения и полного фармацевтического анализа лекарственных веществ ряда аминокислот и их производных.
ü Привить навыки и умения, необходимые для осуществ-ления контроля качества лекарственных веществ ряда карбоновых кислот алифатического ряда и их производных.
ü Научить студентов работать с общегосударственными стандартами и нормативной документацией, нормирую-щими качество лекарственных веществ.
Видео:Получение Карбоната Кальция - чистого мела. CaCO3.Скачать

КОНТРОЛЬНЫЕ ВОПРОСЫ:
1. Дайте общую характеристику препаратам карбоновых кисло-там алифатического ряда и их солей.
2. Приведите методы синтеза препаратов данного ряда.
3. Проведите сравнительный анализ подлинности препаратов.
4. Охарактеризуйте методы количественного определения препаратов.
5. Назовите области применения препаратов в медицине и укажите особенности их хранения.
Карбоновые кислоты алифатического ряда характеризуются наличием карбоксильной группы, кислой реакцией на лакмус водных и водно-спиртовых растворов и способностью образовывать соли при взаимодействии с карбонатами, гидрокарбонатами и щелочами.
Свободные карбоновые кислоты в медицинской практике применяются довольно редко. Это обусловлено тем, что кислоты, диссоциируя на ионы, отщепляют ионогенный водород. Он придает карбоновым кислотам раздражающее действие, и чем сильнее степень диссоциации кислоты, тем большее раздражающее и прижигающее действие она проявляет. Поэтому в медицине чаще применяют соли кислот или их эфиры.
Фармацевтическими препаратами являются калия ацетат, натрия цитрат, кальция лактат и глюконат, натрия вальпро-ат. Их физиологическое действие, в основном, обусловлено катионом. Так, калия ацетат применяется при отеках сердечного происхождения как солевое диуретическое средство. Натрия цитрат создает щелочной резерв крови, а глюконат и лактат кальция применяют подобно хлориду кальция.
Химические свойства во многом определяются свойствами карбоксильной группы. Для идентификации карбоновых кислот часто используется способность кислот образовывать сложные эфиры, как правило, обладающие своеобразным запахом. С солями тяжелых металлов в нейтральной среде кислоты образуют окрашенные осадки. Подлинность солей органических кислот определяется по характеру катиона и аниона.
Калия ацетат
Калия ацетат получают нейтрализацией уксусной кислоты эквивалентным количеством карбоната калия:
Калия ацетат – белый кристаллический порошок со слабым запахом уксусной кислоты, солоноватого вкуса. Гигроскопичен, расплывается на воздухе. Легко растворим в воде; растворим в этаноле.
для испытания подлинности калия ацетата рекомендуют использовать ИК-спектры, которые должны полностью совпадать с полосами поглощения прилагаемых к ФС рисунков спектров.
v При взаимодействии с этиловым спиртом в присутствии концентрированной серной кислоты остаток уксусной кислоты образует сложный эфир – этилацетат, имеющий характерный фруктовый запах.
v Реакция комплексообразования с хлоридом железа (III) при рН=7.
3FeCl3 + 9CH3COOK + 2H2O → [(CH3COO)6Fe3(OH)2]+CH3COO− +
+ 2 СH3COOH + 9 KCl
Аналитический эффект реакции – интенсивно-красное или буро-красное окрашивание раствора за счет образования комплекса.
Методика. 2 мл раствора калия ацетата нагревают с равным количеством концентрированной серной кислоты и 0,5 мл спирта. Ощущается запах этилацетата.
Методика. К 2 мл нейтрального раствора ацетата (0,02 – 0,06 г иона ацетата) прибавляют 0,5 мл раствора хлорида окисного железа.
v Окрашивание бесцветного пламени горелки в фиолетовый цвет или при рассматривании через синее стекло – пурпурно-красный.
v Осаждение ионов калия винной кислотой.
Выпадает белый кристаллический осадок, растворимый в
разведенных кислотах и щелочах:

v Гексанитрокобальтат (III) натрия осаждает ионы калия в виде желтого кристаллического осадка соли гексанитрокобаль-тата (III) калия-натрия:
К+ + Na3[Co(NO2)6] → K2Na[Co(NO2)6]↓ + 2 Na+
Учитывая, что способ получения калия ацетата (также, как и других солей карбоновых кислот) основан на взаимодействии кислоты с карбонатом, устанавливают пределы кислотности и щелочности. Препарат не должен содержать примесей восстанав-ливающих веществ.
Калия ацетат представляет собой соль сильного основания и слабой кислоты, его растворы имеют щелочную реакцию, в связи с этим для его количественного определения используют ацидиметрическое титрование.
v Ацидиметрия в неводной среде (по ФС): Среда – ледяная уксусная кислота; титрант – 0,1 М раствор хлорной кислоты; индикатор – кристаллический фиолетовый.
CH3COOK + CH3COOН → (CH3COOKН)+ ∙ CH3COO−
CH3COOН + HСlO4 → (CH3COOH2)+ ∙ ClO4−
(CH3COOKН)+ ∙ CH3COO− + (CH3COOH2)+ ∙ ClO4− → KClO4 +
CH3COOK + HСlO4 → KClO4 + CH3COOН
v Ацидиметрия в водной среде: Титрант – раствор хлороводородной кислоты; индикатор – тропеолин 00 (рН перехода 1,3 – 3,2).
CH3COOК + HСl → KCl + CH3COOН
Калия ацетат хранят в сухом месте, в хорошо укупоренной таре, учитывая его гигроскопичность.
Калия ацетат оказывает диуретическое действие как осмоти-чески активное вещество. Препарат иногда используют как мочегонное средство при отёках, связанных с нарушением кровообращения. Кроме того, калия ацетат может быть использован в качестве источника ионов калия (при гипокалиемии).
Натрия вальпроат
(Натриевая соль 2-пропил-
Одним из способов получения натрия вальпроата является синтез на основе малонового эфира
Белый или с небольшим оттенком кристаллический порошок без запаха или почти без запаха. легко растворим в воде и этаноле.
При действии нитрата кобальта на водный раствор препарата образуется пурпурный осадок
Осадок вальпроата кобальта растворим в тетрахлорметане (четыреххлористом углероде).
v Цинкуранилацетат с ионами натрия дает желтый кристал-лический осадок, растворимый в кислотах:
Na+ + Zn[(UO2)3(CH3COO)8] + CH3COOН + 9Н2О →
v В нейтральных растворах при взаимодействии ионов натрия с гексагидроксистибиатом (антимонатом) калия образуется белый студенистый осадок гексагидроксистибиата натрия:
K[Sb(OH)6] + Na+ → Na[Sb(OH)6]↓ + K+
v При внесении в бесцветное пламя горелки медной проволоки, смоченной раствором соли натрия, пламя окрашивается в желтый цвет.
1. ацидиметрическое титрование
v Титрование в водной среде; титрант – 0,5 М раствор хлористоводородной кислоты, индикатор – метиловый оранжевый.
(С3Н7)2СНСООNa + НСl → (С3Н7)2СНСООН + NaCl
v Ацидиметрия в неводной: Среда – ледяная уксусная кислота; титрант – 0,1 М раствор хлорной кислоты; индикатор – кристаллический фиолетовый.
(С3Н7)2СНСООNa + CH3COOН →(CH3COONaН)+∙ CH3COO−
CH3COOН + HСlO4 → (CH3COOH2)+ ∙ ClO4−
(CH3COONaН)+∙CH3COO− +(CH3COOH2)+ ∙ClO4− → NaClO4 +
CH3COONa + HСlO4 → NaClO4 + CH3COOН
В сухом, прохладном, защищенном от света месте при температуре 25ºС, в хорошо укупоренной таре, так как на воздухе препарат расплывается.
Вальпроевая кислота и её соли являются новой группой противоэпилептических средств широкого спектра действия. Натрия вальпроат применяют при различных видах эпилепсии: при различных формах генерализованных припадках – малых, больших и полиморфных.

Для получения натрия цитрата нейтрализуют (до слабощелочной реакции) раствор лимонной кислоты. Очистку от примесей производят перекристаллизацией соли из этанола.
Бесцветные кристаллы или белый кристаллический порошок без запаха, выветривающийся на воздухе, солоноватого вкуса. Легко растворим в воде, в этаноле практически нерастворим.
В медицинской пратике применяется раствор натрия цитрата для инъекций: Sodium Citrate (Natrii Citras pro inject tionibus).
v Образование цитрата кальция, растворимость которого уменьшается при нагревании раствора. В связи с этим, после добавления хлорида кальция при комнатной температуре раствор остается прозрачным, а при последующем кипячении выпадает белый осадок, растворимый в хлороводородной кислоте.
v Взаимодействие с бромной водой в присутствии разведенной азотной кислоты. Аналитический эффект реакции – образование белого осадка пентабромацетона.

v Реакция ацилирования уксусным ангидридом в присутствии пиридина или никотиновой кислоты (карминово-красное окрашивание):
v После нагревания в течение 3 минут на водяной бане с раствором ванилина в концентрированной серной кислоте и последующего добавления воды возникает зеленое окрашивание.
v При сплавлении с мочевиной или резорцином образуются флуоресцирующие продукты.
(См. натрия вальпроат)
v Определение прозрачности и цветности, щелочности 10% раствора препарата.
v Хлориды, сульфаты, тяжелые металлы, железо, соли винной кислоты и другие обугливающиеся примеси, кальций – в пределах эталона.
v Препарат не должен содержать солей щавелевой кислоты, а 0,5 г препарата должен давать отрицательные реакции на мышьяк.
1. Кислотно-основное титрование в неводной среде.
Растворитель – ледяная уксусная кислота; титрант – 0,1 М раствор хлорной кислоты; индикатор – кристаллический фиолетовый.
CH3COOН + HСlO4 → (CH3COOH2)+ ∙ ClO4−
с алкалиметрическим окончанием.
Навеску с натрия цитратом растворяют и пропускают через колонку с катионитом КУ-2 в Н-форме, при этом происходит обмен ионов.
Затем колонку промывают и фильтрат с промывными водами, содержащими лимонную кислоту, титруют 0,05 М раствором щелочи.
3. Обратное аргентометрическое титрование.
К навеске натрия цитрата прибавляют в мерной колбе двойной избыток 0,1 М раствора нитрата серебра.
Образующаяся трехзамещенная соль цитрата серебра трудно растворима и выпадает в осадок. Для уменьшения растворимости соли серебра в реакционную смесь добавляют этанол. Осадок отфильтровывают, а избыток нитрата серебра титруют 0,1М раствором тиоцианата аммония (индикатор железоаммониевые квасцы).
AgNO3 + NH4SCN → AgSCN↓ + NH4NO3
NH4SCN + NH4Fe(SO4)2 → Fe(SCN)3 + (NH4)2SO4
В точке эквивалентности раствор приобретает кроваво-красное окрашивание.
Метод основан на образовании медно-цитратного комплексного соединения с сульфатом меди (II):
Титрант – 0,05М раствор сульфата меди, индикатор – мурексид. Анализ выполняют в слабощелочной среде, которую создают с помощью гидрокарбоната натрия или оксида магния. В точке эквивалентности фиолетовая окраска переходит в зеленую.
Хранят в сухом месте в хорошо укупоренной таре.
Препарат создаёт щелочной резерв крови. Его 10% растворы имеют рН 7,0–7,5. Но основное значение препарата натрия цитрат состоит в том, что он предохраняет кровь от свёртывания и потому применяется в виде 4-5% раствора для консервации крови при больших заготовках её в медицинских целях.

Кальция лактат получают в процессе промышленного производства молочной кислоты. Синтез протекает в две стадии.
v Получение молочной кислоты.
Молочная кислота образуется в результате брожения глюкозы (или других сахаристых веществ). Процесс происходит под влиянием культур молочнокислых бактерий при 35-45ºС.
v Получение лактата кальция.
Образовавшуюся кислоту нейтрализуют, добавляя карбонат кальция:
Кальция лактат – белый аморфный порошок почти без запаха, выветривающийся на воздухе. Медленно растворим в холодной воде с образованием мутных растворов, в кипящей воде растворимость значительно повышается. Очень мало растворим в спирте, эфире, хлороформе.
Под действием перманганата калия в кислой среде происходит разложение лактата кальция. При этом раствор обесцвечивается и образуется ацетальдегид, имеющий характерный запах:
Кроме того, уксусный альдегид идентифицируют в парах по почернению полоски фильтровальной бумаги, смоченной реакти-вом Несслера:
или по образованию синего пятна на полоске бумаги, смоченной нитропруссидом натрия и пиперидина.
v Соль кальция, смоченная соляной кислотой и внесенная в бесцветное пламя, окрашивает пламя в кирпично-красный цвет.
v ион кальция обнаруживается по выпадению белого осадка оксалата аммония, растворимого в минеральных кислотах:
Для испытания на доброкачественность кальция лактата определяют кислотность и щелочность: к раствору 1 г препарата в 20 мл воды прибавляют 2 капли фенолфталеина – раствор должен оставаться бесцветным. Розовое окрашивание должно появиться от прибавления не более 0,6 мл 0,02 н раствора едкого натрия.
Содержание хлоридов, сульфатов, железа, тяжелых металлов, должно быть в пределах, указанных в ГФ Х. Также определяют содержание влаги и нерастворимых примесей.
1. Комплексонометрическое титрование.
Титрант – 0.05М раствор трилона Б. Раствор препарата титруется рабочим раствором в присутствии аммиачного буферного раствора. Точку эквивалентности определяют по изменению окраски индикатора кислотного хром темно-синего до сине-фиолетового. Титрование протекает по схеме:
Хранят в сухом месте в хорошо укупоренной таре.
Кальция лактат применяется:
v при недостаточной функции паращитовидных желёз, сопровождающейся спазмофилией;
v при усиленном выделении кальция из организма: препарат является источником ионов кальция;
v при аллергических заболеваниях (сывороточная болезнь, сенная лихорадка, крапивница и тд.);
v при кожных заболеваниях (зуд, экзема, псориаз и тд.)
v при токсических поражениях печени, нефрите.
КАЛЬЦИЯ ГЛЮКОНАТ
Препарат получают электрохимическим окислением глюкозы в присутствии бромида и карбоната кальция. При электролизе бромида кальция на аноде выделяется свободный бром, окисляющий глюкозу до глюконовой кислоты. Глюконовая и бромоводородная кислоты нейтрализуются карбонатом кальция. Образующийся бромид кальция вновь подвергают электролизу. Общая схема синтеза:
Кальция глюконат – белый зернистый или кристаллический порошок без запаха и вкуса. Медленно растворим в 50 ч. воды, растворим в 5 ч. кипящей воды, практически нерастворим в спирте и эфире.
1. Реакции идентификации глюконат-иона.
v С хлоридом железа кальция глюконат в нейтральной среде дает светло-зеленое окрашивание:
v Образование фенилгидразида глюконовой кислоты.
Кальция глюконат нагревают на водяной бане в течение 30 минут со свежеперегнанным фенилгидразином и ледяной уксусной кислотой. Выпадает осадок фенилгидразида, который идентифицируют по температуре плавления около 200ºС. Для более быстрой кристаллизации потирают стеклянной палочкой внутреннюю часть пробирки.
v Кальция глюконат восстанавливает нитрат серебра при нагревании в нейтральном растворе. В кислой среде и в присутствии аммиака восстановления не происходит.
Для обнаружения ионов кальция проводят испытания аналогично препарату кальция лактат.
Кислотность или щелочность. 0,5 г препарата растворяют при подогревании в 25 мл свежепрокипяченной воды, раствор должен быть нейтральным (раствор лакмуса).
Сульфаты, хлориды, мышьяк, тяжелые металлы – в пределах нормы. Недопустимыми примесями являются декстрин и сахароза.
2. Комплексонометрическое титрование.
Титрант – 0.05М раствор трилона Б, индикатор – кислотный хром темно-синий. Титрование протекает по схеме:

Хранят в сухом месте в хорошо укупоренной таре.
Кальция глюконат применяется так же, как и кальция лактат:
v при недостаточной функции паращитовидных желёз, сопровождающейся спазмофилией;
v при усиленном выделении кальция из организма: препарат является источником ионов кальция;
v при аллергических заболеваниях (сывороточная болезнь, сенная лихорадка, крапивница и тд.);
v при кожных заболеваниях (зуд, экзема, псориаз и тд.)
v при токсических поражениях печени, нефрите.
Лабораторная работа № 1
ОПРЕДЕЛЕНИЕ ПОДЛИННОСТИ ПРЕПАРАТОВ
КАРБОНОВЫХ КИСЛОТ И ИХ СОЛЕЙ
Привить навыки в проведении анализа на подлинность препаратов ряда карбоновых кислот и их солей.
v Реакция с этиловым спиртом: 2 мл раствора калия ацетата нагревают с равным количеством концентрированной серной кислоты и 0,5 мл спирта. Ощущается запах этилацетата (схему реакции записать).
v Реакция с хлоридом железа (III) при рН=7: К 2 мл нейтраль-ного раствора ацетата (0,02 – 0,06 г иона ацетата) прибавляют 0,5 мл раствора хлорида окисного железа (схему реакции записать).
2. Обнаружение иона калия.
v Осаждение ионов калия винной кислотой: К 2 мл раствора соли калия (0,01 – 0,02 г иона калия) прибавляют 1 мл раствора виннокаменной кислоты, 1 мл раствора ацетата натрия, охлаждают и встряхивают. Постепенно выпадает белый кристаллический осадок (схему реакции записать).
v Осаждение гексанитрокобальтатом (Ш) натрия: К 2 мл раствора соли калия (0,005 – 0,01г иона калия), предварительно прокаленной для удаления солей аммония, прибавляют 0,5 мл уксусной кислоты и 0,5 мл раствора кобальтонитрита натрия. Образуется желтый кристалл-лический осадок (схему реакции записать).
v Реакция с хлоридом кальция: К 1 мл нейтрального раствора цитрата (0,002 – 0,01 г иона цитрата) прибавляют 1 мл раствора хлорида кальция. Раствор остается прозрачным, при кипячении появляется белый осадок (схему реакции записать).
Видео:Опыты по химии. Превращение гидрокарбоната кальция в карбонат кипячениемСкачать

КАРБОНОВЫЕ КИСЛОТЫ И ИХ СОЛИ
Карбоновые кислоты алифатического ряда представляют собой производные углеводородов, у которых один атом водорода замещен карбоксильной группой. Эту группу соединений можно также рассматривать как конечный продукт процесса окисления спиртов, не связанного с разрушением углеродной цепи:
В медицинской практике используют соли карбоновых кислот: калия ацетат, кальция лактат, натрия цитрат для инъекций, кальция глюконат, натрия вальпроат.
Калия ацетат получают нейтрализацией уксусной кислоты эквивалентным количеством карбоната калия:
Для получения натрия цитрата нейтрализуют (до слабощелочной реакции) раствор лимонной кислоты:
Для очистки от примесей натрия цитрат перекристаллизовывают из этанола.
Кальциевые соли молочной и глюконовой кислот получают окислением глюкозы в присутствии соединений кальция. Молочная кислота образуется в результате брожения глюкозы (или других сахаристых веществ). Процесс происходит под влиянием культур молочнокислых бактерий при 35–45°C. Образующуюся молочную кислоту нейтрализуют, добавляя карбонат кальция:
Кальция глюконат получают электрохимическим окислением глюкозы в присутствии бромида кальция и карбоната кальция. При электролизе бромида кальция на аноде выделяется свободный бром, который окисляет глюкозу до глюконовой кислоты. Глюконовая и бромоводородная кислоты нейтрализуются карбонатом кальция. Образующийся бромид кальция вновь подвергают электролизу. Общая схема происходящего процесса может быть выражена в виде следующих уравнений химических реакций:
23.1. Свойства солей карбоновых кислот
| Лекарственное вещество | Химическая структура | Описание |
| Potassium Acetate (Kalii acetas)— калия ацетат | CH3COOK | Белый кристаллический порошок со слабым запахом уксусной кислоты. Гигроскопичен. На воздухе расплывается |
| Valproic Acid Sodium Salt— натрия вальпроат |  | Белый или почти белый кристаллический порошок без запаха или почти без запаха |
| Calcium Lactate— кальция лактат |  | Белый аморфный порошок почти без запаха, выветривающийся на воздухе |
| Sodium Citrate (Natrii citras pro injectionibus)— натрия цитрат для инъекций |  тринатриевая соль лимонной кислоты тринатриевая соль лимонной кислоты | Бесцветные кристаллы или белый кристаллический порошок без запаха, выветривающийся на воздухе |
| Calcium Gluconate— кальция глюконат |  | Белый зернистый или кристаллический порошок без запаха |
Сравнительные данные о физических свойствах солей карбоновых кислот (табл. 23.1) указывают на то, что они представляют собой белые кристаллические вещества, гигроскопичные (калия ацетат) или выветривающиеся на воздухе (кальция лактат, натрия цитрат) ввиду наличия кристаллизационной воды. Соли уксусной и лимонной кислот имеют солоноватый вкус, а калия ацетат — слабый запах уксусной кислоты. Соли щелочных металлов (калия ацетат, натрия вальпроат и натрия цитрат) легко растворимы в воде.
Кальциевые соли медленно растворимы в воде, но в кипящей воде их растворимость значительно улучшается (кроме цитрата кальция). В этаноле растворим калия ацетат, легко растворим натрия вальпроат. Остальные соли в этаноле практически нерастворимы.
Для испытания подлинности ФС рекомендуют использовать ИК-спектры лекарственных веществ, которые должны полностью совпадать с полосами поглощения прилагаемых к ФС рисунков спектров.
С помощью соответствующих аналитических реакций устанавливают в растворах солей карбоновых кислот наличие ионов калия, натрия и кальция.
Ацетат-ион в калия ацетате обнаруживают реакцией образования сложного эфира при взаимодействии с этиловым спиртом и концентрированной серной кислотой. Этилацетат имеет характерный фруктовый запах:
Ацетат-ион в нейтральных растворах образует с хлоридом железа (III) соединения, окрашенные в интенсивно-красный или буро-красный цвет:
Анион глюконовой кислоты приобретает в тех же условиях светло-зеленое окрашивание.
Натрия вальпроат, взаимодействуя с раствором нитрата кобальта, образует пурпурный осадок вальпроата кобальта, растворимый в тетрахлорметане (четырёххлористом углероде):
Для обнаружения глюконат-иона используют также реакцию образования фенилгидразида глюконовой кислоты, температура плавления которого около 200°C. Испытание выполняют, нагревая кальция глюконат на водяной бане в течение 30 мин со свежеперегнанным фенилгидразином и ледяной уксусной кислотой. Для более быстрой кристаллизации потирают стеклянной палочкой внутреннюю часть пробирки. Кальция глюконат восстанавливает нитрат серебра при нагревании в нейтральном растворе. В кислой среде и в присутствии аммиака восстановления не происходит.
Лактат-ион идентифицируют разложением перманганатом калия в кислой среде. Образуется ацетальдегид, имеющий характерный запах:
Образовавшийся ацетальдегид можно также обнаружить в парах по почернению полоски фильтровальной бумаги, смоченной реактивом Несслера, или по образованию синего пятна на полоске бумаги, смоченной смесью раствора нитропруссида натрия и пиперидина.
Испытание подлинности цитрат-иона основано на образовании цитрата кальция. Характерное свойство этой соли — уменьшение растворимости при нагревании раствора. Поэтому после добавления хлорида кальция раствор остается прозрачным, а при последующем кипячении выпадает белый осадок:
Выпавший осадок растворим в хлороводородной кислоте. Цитрат (гидроцитрат)-ион можно обнаружить действием раствора ванилина в концентрированной серной кислоте. После нагревания на водяной бане в течение 5 мин и последующего добавления воды возникает зеленое окрашивание.
При нагревании натрия цитрата с уксусным ангидридом и пиридином или несколькими кристаллами никотиновой кислоты появляется карминово-красное окрашивание. Винная кислота и ее соли в этих условиях приобретают зеленую окраску.
При сплавлении цитратов с мочевиной или резорцином образуются флуоресцирующие продукты.
Прибавление к натрия цитрату бромной воды и нескольких капель разведенной азотной кислоты приводит к образованию белого кристаллического осадка пентабромацетона:
Эту химическую реакцию используют для гравиметрического определения натрия цитрата.
Учитывая, что способы получения солей карбоновых кислот основаны на взаимодействии карбоновых кислот с карбонатами, при испытании на чистоту устанавливают пределы кислотности или щелочности. Для выполнения испытаний используют определение рН растворов, титрование со специально подобранными индикаторами.
Количественно соли щелочных металлов можно определить методом кислотно-основного титрования. Калия ацетат, представляющий собой соль сильного основания и слабой кислоты, титруют в водной среде раствором хлороводородной кислоты:
Индикатором служит раствор тропеолина 00 (pH перехода 1,3–3,2).
ФС рекомендует проводить титрование калия ацетата в неводной среде. Навеску растворяют в ледяной уксусной кислоте и титруют 0,1 М раствором хлорной кислоты (индикатор кристаллический фиолетовый):
Аналогично в неводной среде определяют количественное содержание натрия цитрата и натрия вальпроата, используя в качестве индикатора 1-нафтолбензеин или кристаллический фиолетовый. Определить содержание натрия вальпроата можно в водной среде, титруя 0,5 М раствором хлороводородной кислоты (индикатор метиловый оранжевый).
Натрия цитрат определяют, используя ионообменную хроматографию в сочетании с алкалиметрией. Навеску натрия цитрата растворяют и пропускают через колонку с катионитом КУ-2 в Н-форме. Происходит обмен ионов:
Затем колонку промывают и фильтрат с промывными водами, содержащими лимонную кислоту, титруют 0,05 М раствором щелочи.
Метод обратного аргентометрического титрования натрия цитрата основан на образовании трудно растворимой трехзамещенной соли серебра:
К навеске натрия цитрата прибавляют в мерной колбе двойной избыток 0,1 М раствора нитрата серебра. Для уменьшения растворимости соли серебра в реакционную смесь добавляют этанол. Осадок отфильтровывают и избыток нитрата серебра титруют 0,1 М раствором тиоцианата аммония (индикатор железоаммониевые квасцы).
Известен также куприметрический метод определения натрия цитрата, основанный на образовании медноцитратного комплексного соединения с сульфатом меди (II). Анализ выполняют в слабощелочной среде, которую создают с помощью гидрокарбоната натрия или оксида магния. Титруют 0,05 М раствором сульфата меди в присутствии индикаторной смеси мурексида до исчезновения фиолетового и появления зеленого окрашивания.
Кальциевые соли карбоновых кислот (кальция лактат и кальция глюконат) количественно определяют комплексонометрическим методом. Методика идентична определению неорганических лекарственных веществ кальция (см. ч. II, гл. 16).
Соли карбоновых кислот следует хранить в сухом месте в хорошо укупоренной таре, учитывая их гигроскопичность (калия ацетат) или возможность потери кристаллизационной воды (кальция лактат, кальция глюконат, натрия цитрат). Натрия вальпроат хранят в сухом, прохладном, защищенном от света месте при температуре до 25 °C в хорошо укупоренной таре (расплывается на воздухе).
Соли карбоновых кислот применяют в медицине для различных целей. Калия ацетат используют в качестве источников ионов калия (при гипокалиемии) и диуретического средства. Кислота вальпроевая и её натриевая соль составляют новую группу противоэпилептических средств широкого спектра действия. Натрия цитрат применяют для консервации (предупреждения свертывания) крови в виде 4–5%-ного раствора. Кальция лактат и кальция глюконат используют как источники ионов кальция и в качестве антиаллергического средства.
ГЛАВА 24.
ПРОСТЫЕ ЭФИРЫ
Простые эфиры (этеры) представляют собой кислородсодержащие органические соединения с общей формулой R–O–R1.
В медицинской практике применяют лекарственные препараты диэтилового эфира: эфир медицинский и эфир для наркоза. Впервые диэтиловый эфир был получен в 1540 г. В.Кордусом, но затем это открытие было забыто и в XIX в. его «открыли» вновь (Сессюр в 1807 г. и Гей-Люссак в 1815 г.). Современный промышленный синтез диэтилового эфира проводят путём дегидратации при 135 °C этилового спирта под действием концентрированной серной кислоты в специальных аппаратах — эфиризаторах. Процесс идет в несколько стадий. Вначале образуется этилсерная кислота (этилсульфат):
Этилсерная кислота взаимодействует с избытком этилового спирта, образуя диэтиловый эфир:
Полученный эфир отгоняют в приемник. Для получения максимального выхода необходимо поддерживать оптимальный температурный режим (130–140 °C).
Более экономичным является получение диэтилового эфира из этилена одновременно с получением этилового спирта:
Гидратация этилена до этилсульфатов происходит в присутствии 96-98%-ной серной кислоты при температуре 65-75 °C и давлении 2,5 МПа. Затем в результате гидролиза этилсульфатов (при 95-100 °C и 0,2 МПа) образуется диэтиловый эфир:
При несоблюдении технологического режима синтеза происходит образование побочных продуктов по схеме:
Примерная схема образования побочных продуктов
при получении диэтилового эфира
Образующиеся при получении эфира побочные продукты по химическим свойствам можно разделить на четыре группы: кислоты (уксусная, сернистая и непрореагировавшая серная); пероксиды (пероксид водорода, пероксид диоксиэтила, гидропероксид ацетила, гидропероксид оксиэтила, пероксид этилидена); непредельные соединения (этилен, виниловый спирт) и альдегиды (уксусный альдегид).
При хранении диэтилового эфира (особенно при несоблюдении условий хранения) под влиянием солнечного света, кислорода воздуха происходит образование аналогичных побочных продуктов:
Примерная схема образования побочных продуктов
при хранении диэтилового эфира
Кроме того, эфир может содержать примеси воды и этилового спирта.
Для очистки от кислот и других примесей эфир промывают водой, высушивают безводным хлоридом кальция и подвергают фракционной перегонке над кристаллическим гидроксидом натрия, удаляя остатки влаги и спирта. Поскольку пероксиды могут служить причиной сильных взрывов, особую осторожность следует соблюдать при перегонке долго хранившегося диэтилового эфира. Из пероксидов самый взрывоопасный — пероксид этилидена. Для очистки от пероксидов перед фракционной перегонкой к эфиру добавляют сульфат железа (II), который восстанавливает пероксид, окисляясь до сульфата железа (III).
Дополнительную очистку эфира для наркоза проводят с помощью гидросульфита натрия и щелочного раствора перманганата калия, которые взаимодействуют с примесями непредельных соединений и альдегидов. Затем вновь промывают, сушат эфир и подвергают ректификации, отделяя фракцию, кипящую при 34–35°C.
24.1. Свойства лекарственных препаратов диэтилового эфира
| Лекарственный препарат | Химическая структура | Описание | Т. кип.,°C | Плотность, г/см 3 |
| Aether medicinalis— эфир медицинский | H5C2–O–C2H5 | Бесцветная, прозрачная, подвижная, легко воспламеняющаяся, летучая жидкость своеобразного запаха, жгучего вкуса | 34–36 | 0,714–0,717 |
| Aether pro narcosi— эфир для наркоза | H5C2–O–C2H5 | То же | 34–35 | 0,713–0,715 |
Физические свойства лекарственных препаратов диэтилового эфира очень сходны. Они различаются по температуре кипения и по плотности (табл. 24.1), т.е. степенью чистоты. Оба лекарственных препарата растворимы в 12 ч. воды, смешиваются во всех соотношениях с этанолом, бензолом, петролейным эфиром, хлороформом, жирными и эфирными маслами.
При выполнении испытаний на лекарственные препараты диэтилового эфира, при хранении и работе с ними необходимо соблюдать правила техники безопасности. Особенно следует помнить об огнеопасности (не должно быть поблизости источников огня) и взрывоопасности паров эфира.
Прежде чем выполнять фармакопейный анализ, проводят испытание на наличие пероксидов в испытуемом лекарственном препарате диэтилового эфира. Если эти соединения обнаружены, то определение температуры кипения и нелетучего остатка проводить нельзя.
Наличие пероксидов в эфире медицинском и эфире для наркоза устанавливают по реакции с иодидами:
При визуальном наблюдении не должно быть пожелтения ни эфирного, ни водного слоев.
Подлинность лекарственных препаратов диэтилового эфира подтверждают по физическим константам: температуре кипения и плотности (см. табл. 24.1).
При испытании на чистоту в обоих лекарственных препаратах устанавливают отсутствие или допустимые пределы примесей, образующихся при производстве и хранении. Примесь кислот определяют нейтрализацией водного извлечения. Примесь посторонних пахучих органических веществ (виниловый спирт и др.) устанавливают, выпаривая 10 мл эфира, который постепенно приливают на фильтровальную бумагу (не должно оставаться постороннего запаха). Нелетучие примеси определяют по массе остатка, полученного после выпаривания и высушивания (при 100–105 °C) 50 мл лекарственного препарата. Остаток не должен превышать 0,001 г. Примесь воды определяют методом Фишера. В эфире медицинском её допускается 0,5 г/100 мл, а в эфире для наркоза — не более 0,2%.
Примесь альдегидов определяют по реакции с реактивом Несслера:
 |
У эфира медицинского не допускается образования осадка. Может быть только помутнение нижнего слоя и желто-бурая окраска раствора. У эфира для наркоза допускается лишь слабая опалесценция, изменения окраски и помутнения реактива быть не должно.
Эфир для наркоза ввиду высокой степени чистоты должен иметь более узкие интервалы значений плотности и температуры кипения (см. табл. 24.1).
Оба лекарственных препарата относятся к списку Б. Эфир медицинский хранят в хорошо укупоренных склянках оранжевого стекла в защищенном от света месте, вдали от огня. Склянки закупоривают корковыми пробками с пергаментной подкладкой и заливают специальной цинк-желатиновой массой, нерастворимой в эфире, т. к. резиновые пробки разбухают от паров эфира, а стеклянные не создают должной герметичности.
Эфир для наркоза хранят в условиях, исключающих воздействие кислорода воздуха и образование пероксидных соединений, которые могут стать причиной его самовоспламенения при комнатной температуре. Сразу же после получения и очистки эфир расфасовывают во флаконы оранжевого стекла вместимостью 150 мл. Закупоривают флаконы корковой пробкой, под которую подкладывают металлическую фольгу, а поверх заливают специальной мастикой. Фольга (обычно цинковая) не только предохраняет корковую пробку от растворения, но и восстанавливает образующиеся примеси пероксидов и альдегидов:
 |
По истечении каждых 6 мес. хранения эфир для наркоза подвергают контролю в соответствии с требованиями ФС.
Эфир медицинский применяют как растворитель для приготовления настоек, экстрактов, некоторых лекарственных форм для наружного применения, а также в фармацевтическом анализе. Эфир для наркоза используют очень ограниченно, так как в настоящее время для ингаляционного наркоза применяют менее токсичные вещества (азота закись, циклопропан, галотан).
В последние годы выпускается эфир для наркоза стабилизированный (Aether pro narcosi stabilisatum). Он представляет собой эфир для наркоза, стабилизированный антиоксидантом п-фенилендиамином. Содержание п-фенилендиамина определяют методом УФ-спектрофотометрии при длине волны 309 нм (не более 0,00015%). Упаковывают эфир для наркоза стабилизированный по 140 мл во флаконы из оранжевого стекла с винтовым горлом, которые герметично закрывают металлической кронен-пробкой, а затем завинчивают колпачком из полиэтилена. Срок годности три года.
🔍 Видео
Химия Заново 4. Ракушки, мрамор, карбонат кальция.Скачать

Получение ОКСИДА КАЛЬЦИЯ. Разложение КАРБОНАТА КАЛЬЦИЯ ( МЕЛА). Реакция с водой. Опыты по химииСкачать

Карбонат кальция - 5 дней для здоровья сердцаСкачать

Химия 9 класс (Урок№19 - Угольная кислота.)Скачать

Реакция карбоната кальция и соляной кислотыСкачать

Карбонат кальция (CaCO₃)Скачать

Термическое разложение карбонатов #химия #химияскатей #химияегэ #химияогэ #егэхимия #easy.chemistryСкачать

Химия/7 кл/ Карбонат Кальция/03.05.22Скачать

Химия. КарбонатыСкачать

CaCO3 + 2HCl → CaCl2 + CO2 + H2O | Реакция карбоната кальция и хлороводородаСкачать

8 класс. Химия. Химические свойства солей (соль + кислота).Скачать

Карбонат кальция СаСО3Скачать

Карбонат натрия из пищевой содыСкачать

Карбонат кальцияСкачать