В две пробирки помещают по 2 мл CuSO4 и затем в одну из них добавляют 1 мл 1%-ного раствора глицина. Затем приливают по 1 мл разбавленного раствора щелочи и наблюдают образование Cu(OH)2 в одной из пробирок.
В третью пробирку помещают 1 мл 5%-ого раствора глицина, добавляют несколько капель 3%-ного раствора FeCl3.
1) Cо свободным сульфатом меди реакция с глицином не пойдет. Нужно образовать гидроксид.
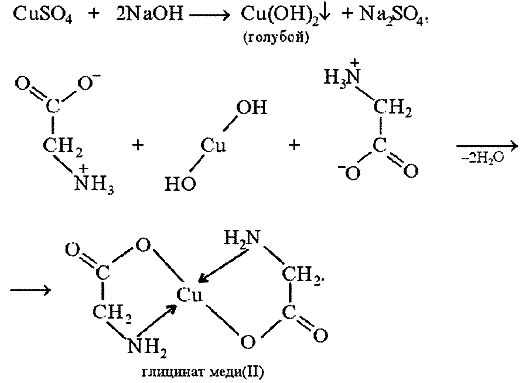 |
Аминоуксусная кислота (глицин) может реагировать с гидроксидом меди с образованием сине-фиолетового прочного комплекса, растворимого в воде:
Лиганд NH2CH2COO − (глицинат-ион) относят к категории бидентатных лигандов, образующих две химические связи с комплексообразователем — через атом кислорода карбоксильной группы и через атом азота аминогруппы.
Внутренняя сфера комплекса содержит два замкнутых пятичленных цикла, в связи с чем полученный комплекс отличается высокой устойчивостью. Константа образования диглицинатомеди(II) β2равна 1,8·10 15 .
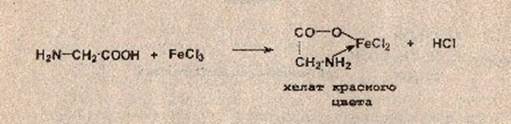 |
Реакция с хлоридом железа (III). От прибавления раствора хлорида железа (III) к аминокислоте жидкость приобретает сине-фиолетовую окраску. Состав и окраска комплексов, образующихся при взаимодействии аминокислоты с ионами железа, зависит от рН среды. При рН=1,8. 2,5 образуется моносалицилатный комплекс , имеющий сине-фиолетовую окраску. При рН = 4. 8 образуется дисалицилатный комплекс , имеющий красно-бурую окраску. Комплекс железа , имеющий желтую окраску, образуется при рН = 8. 11.
Видео:Опыты по химии. Реакция глицерина с гидроксидом меди (II)Скачать

Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Видео:Взаимодействие многоатомных спиртов с гидроксидом меди(II)Скачать  Глицинат меди (II)
Глицинат меди (II) — химическое соединение, соль меди и аминокислоты глицин с формулой Cu(NH2CH2COO)2, голубые кристаллы, растворяется в воде. Видео:Опыты по химии. Получение гидроксида меди (II) и изучение его свойствСкачать  СодержаниеВидео:Качественная реакция глюкозы с гидроксидом меди (II)Скачать  Получение
CuO + 2NH2CH2COOH → Cu(NH2CH2COO)2 + H2O Видео:Образование гидроксида меди (II)Скачать  Физические свойстваГлицинат меди (II) образует голубые кристаллы. Плохо растворяется в воде и этаноле, не растворяется в углеводородах, эфирах, кетонах. Образует кристаллогидрат состава Cu(NH2CH2COO)2•H2O — кристаллы ромбической сингонии, пространственная группа P 212121, параметры ячейки a = 1,078 нм, b = 0,5208 нм, c = 1,347 нм, Z = 4. 🎬 ВидеоОпыты по химии. Окисление муравьиного альдегида гидроксидом меди (II)Скачать  Получение осадка гидроксида меди и комплекса меди с глицериномСкачать  Получение гидроксида меди (II) и растворение его в кислотахСкачать  Реакция глюкозы с гидроксидом меди (II)Скачать  получение оксида и гидроксида медиСкачать  Гидроксид меди (II) и серная кислотаСкачать  Получение гидроксида медиСкачать  гидроксид меди 2Скачать  синтез гидроксида меди II (synthesis of copper hydroxide)Скачать  Растворение целлюлозы в аммиачном растворе гидроксида меди IIСкачать  Гидроксид меди 2 + глюкозаСкачать  Качественная реакция на альдегиды с гидроксидом медиСкачать  Получение КУПРАТА Натрия - Na2CuO2. Реакция Гидроксида Меди(2) и Гидроксида Натрия.Скачать  Взаимодействие глюкозы с гидроксидом медиСкачать  Реакция глицерина с гидроксидом меди IIСкачать  | |||||||||||||||||||||||||

