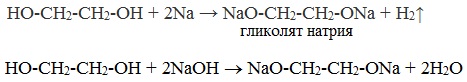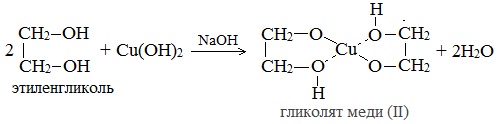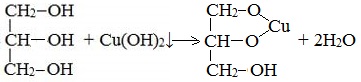Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
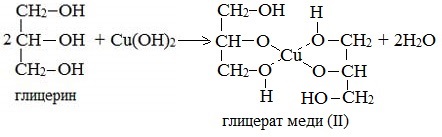
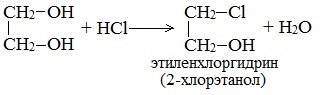
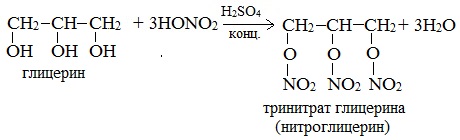
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Видео:Опыты по химии. Реакция глицерина с гидроксидом меди (II)Скачать  Глицерин и оксид меди уравнение реакцииМногоатомные спирты по химическим свойствам сходны с одноатомными спиртами. Однако в химических свойствах многоатомных спиртов есть особенности, обусловленные присутствием в молекуле двух и более гидроксильных групп. Если в многоатомных спиртах ОН-группы находятся при соседних атомах углерода, то вследствие взаимного влияния этих групп (–I-эффект одной ОН-группы по отношению к другой), разрыв связи О-Н происходит легче, чем в одноатомных спиртах. Кислотные свойства1. С щелочными металлами Многоатомные спирты с ОН-группами у соседних атомов углерода (этиленгликоль, глицерин и т.п.) вследствие взаимного влияния атомов (-I-эффект ОН-групп) являются более сильными кислотами, чем одноатомные спирты. Они образуют соли не только в реакциях с активными металлами, но и под действием их гидроксидов. Видеоопыт «Взаимодействие глицерина с металлическим натрием» 2. С гидроксидом меди(II) — качественная реакция! Наличие нескольких ОН-групп в молекулах многоатомных спиртов обусловливает увеличение подвижности и способности к замещению гидроксильных атомов водорода по сравнению с одноатомными спиртами. Поэтому, в отличие от алканолов, многоатомные спирты взаимодействуют с гидроксидами тяжелых металлов (например, с гидроксидом меди (II) Cu (OH)2). Продуктами этих реакций являются комплексные («хелатные») соединения, в молекулах которых атом тяжелого металла образует как обычные ковалентные связи Ме–О за счет замещения атомов водорода ОН-групп, так и донорно-акцепторные связи Ме←О за счет неподеленных пар атомов кислорода других ОН-групп. При взаимодействии многоатомного спирта с гидроксидом меди (II) в щелочной среде образуется темно-синий раствор (гликолят меди и глицерат меди). Эта реакция является качественной реакцией на многоатомные спирты. Видеоопыт «Взаимодействие многоатомных спиртов с гидроксидом меди (II)» Гликолят меди Глицерат меди По аналогии с алкоголятами соли двухатомных спиртов называются гликолятами, а трехатомных — глицератами. Многоатомные спирты с несоседними ОН-группами подобны по свойствам одноатомным спиртам (не проявляется взаимное влияние групп ОН). Основные свойства1. С галогенводородными кислотами При взаимодействии этиленгликоля с галогеноводородами (НСl, HBr) одна гидроксильная группа замещается на галоген: Вторая гидроксогруппа замещается труднее, под действием РСl5. 2. Реакция этерификации (с органическими и неорганическими кислотами) Многоатомные спирты взаимодействуют с органическими и неорганическими кислотами с образованием сложных эфиров. С карбоновыми кислотами глицерин образует сложные эфиры – жиры и масла. При взаимодействии глицерина с азотной кислотой в присутствии концентрированной серной кислоты образуется нитроглицерин (тринитрат глицерина): Тринитрат глицерина (тривиальное название – нитроглицерин) – тяжелая маслянистая жидкость, известное взрывчатое вещество (взрывается от легкого сотрясения и нагревания). И одновременно лекарственный препарат (спиртовые растворы его не взрываются): 1% спиртовой раствор нитроглицерина применяется в медицине в качестве средства расширяющего сосуды сердца. 3. Окисление Видеоопыт «Взаимодействие глицерина с кристаллическим перманганатом калия» Какая разница между третичным и трехатомным спиртом? Третичным называется спирт, в котором функциональная группа -ОН связана с третичным атомом углерода. Трехатомным называют спирт, в котором имеется три функциональных группы – ОН. Видео:Реакция оксида меди(II) со спиртом.Скачать  Глицерин и оксид меди уравнение реакцииУстановите соответствие между схемой реакции и органическим веществом — продуктом реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Оксид меди(II) — окислитель для первичных (до альдегидов) и вторичных (до кетонов) спиртов. Гидроксид меди(II) является окислителем для альдегидов (до карбоновых кислот), а также образует хелатные комплексы с многоатомными спиртами. A. Глицерин — многоатомный спирт, с гидроксидом меди(II) образует комплекс глицерата меди(II) (6); Б. Окисляем вторичный спирт до соответствующего кетона — пропанона = ацетон (3 ); В. Пропаналь окислится до пропионовой кислоты (5); 💡 ВидеоКачественная реакция на оксид медиСкачать  Качественные реакции на глицерин, глюкозу и сахарозуСкачать  Окисление этанола оксидом меди (II). Опыт 3Скачать  Получение оксида меди(1) - Cu2O. Реакция сульфата меди и сульфита натрия. Реакция CuSO4 и Na2SO3Скачать  Взаимодействие многоатомных спиртов с гидроксидом меди(II)Скачать  Взаим-вие многоатомных спиртов с гидроксидом медиСкачать  Окисление этанола оксидом меди(II). | Лабораторный опыт № 2.Скачать  Взаимодействие глицерина с гидроксидом меди(II)Скачать  Окисление этилового спирта оксидом меди(II)Скачать  Качественная реакция глюкозы с гидроксидом меди (II)Скачать  8.3. Многоатомные спирты (этиленгликоль, глицерин): Химические свойства. ЕГЭ по химииСкачать  Качественная Реакция На Многоатомные Спирты.Скачать  Взаимодействие многоатомных спиртов с гидроксидом меди IIСкачать  Опыты по химии. Взаимодействие угля и оксида меди (II)Скачать  На что способна ЗАКИСЬ МЕДИ?Скачать  Опыты по химии. Получение гидроксида меди (II) и изучение его свойствСкачать  Опыты по химии. Взаимодействие водорода с оксидом меди (II)Скачать  оксид меди + соляная кислотаСкачать  |