Образование прозрачного васильково-синего раствора говорит о том, что глицерин — многоатомный спирт и образует сложное соединение с медью — глицерат меди (II).
Проведём опыт аналогичный опыту выше. Этиленгликоль – многоатомный спирт, который так же будет давать васильково-синее окрашивание с гидроксидом меди (II) из-за образования гликолята меди (II).
Укажите температуру замерзания 40%-го (по объему) водного раствора этиленгликоля.
Температура замерзания такой смеси -35,5°С. Потому что по объёму этиленгликоля и воды 1/1 = 50/50. Соответственно концентрация этиленгликоля по объему = 50%.
Это утверждение неверно. Дело в том, что с увеличением концентрации этиленгликоля в водном растворе его теплоемкость и теплопроводность уменьшается, и соответственно снижается температура замерзания.
Видео:Опыты по химии. Реакция глицерина с гидроксидом меди (II)Скачать

Экспериментальные задачи по распознаванию и получению глицерина, альдегида и глюкозы
1. Нам необходимо определить три вещества: глицерин (многоатомный спирт), альдегид, глюкозу (углевод).
Одной из характерных реакций для этих веществ является взаимодействие с Cu(OH)2.
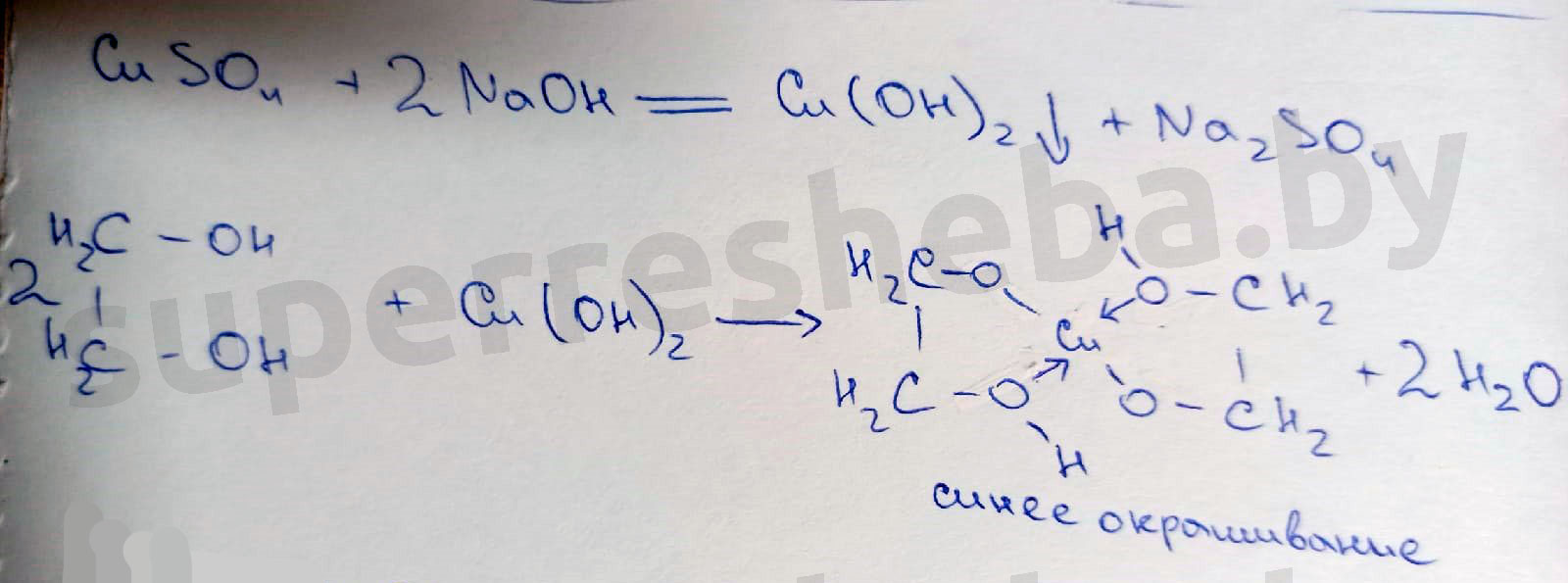
Сначала получим гидроксид меди (II). Для этого к медному купоросу добавим немного раствора NаОН:
1) К образовавшемуся осадку прильем немного альдегида и нагреем смесь:
В результате образуется красный осадок Сu2O ↓ .
2) Теперь к Cu(OH)2 добавим по каплям глицерин и смесь взболтаем. Осадок растворяется, получается раствор ярко-синего цвета. Образуется устойчивый комплекс глицерина с медью:
3) Глюкоза по своим химическим свойствам является альдегидоспиртом, т.е. она проявляет свойства и альдегидов, и многоатомных спиртов. Как альдегид, она вступает в реакции, характерные для этого класса веществ, в частности при нагревании взаимодействует с Cu(OH)2 с образованием красно-коричневого осадка Сu2O. Как многоатомный спирт, глюкоза дает раствор ярко-синего цвета при добавлении к ней свежего осадка Cu(OH)2:
Выпадает красный осадок Сu2O.
4) для определения трех данных веществ из каждой пробирки добавим немного Cu(OH)2. В двух пробирках образуется ярко-синий раствор (глюкоза и глицерин). Теперь нагреем все три смеси: в двух пробирках выпадет красный осадок (альдегид и глюкоза). Таким образом, мы узнаем, в какой пробирке какое вещество находится.
2. Машинное масло состоит, в основном, из предельных углеводородов, а растительное масло — из жиров, образованных непредельными кислотами. Растительное масло обесцвечивает бромную воду, а машинное — нет.
3. а) для получения простого эфира проведем реакцию дегидратации этилового спирта:
Образующий эфир называется диэтиловым. данная реакция проходит лишь при определенных условиях: нагревании, в присутствии H2SO4, и при избытке спирта.
б) для получения альдегида из спирта нужно использовать слабый окислитель, например, Сu 2+ :

Образуется уксусная кислота.
4. Сахар это сложное органическое вещество, содержащее достаточно большое количество углерода. Чтобы доказать это, возьмем немного сахара и добавим к нему Н2SO4 (конц.).
Сахар под действием концентрированной серной кислоты отдаст воду и превратится в углерод:
Концентрированная серная кислота Н2SO4 забирает воду у сахара, в результате получается свободный углерод (черное вещество).
5. а) для определения крахмала существует хорошая качественная реакция с иодом. Образуется устойчивый комплекс ярко-синего цвета.
Капнем несколько капель раствора иода на картофель и белый хлеб. Если на продуктах образуется синее пятно, то они содержат крахмал.
б) для проверки яблока на содержание глюкозы приготовим несколько капель яблочного сока, добавим немного синего осадка Cu(OH)2. Если исследуемый раствор содержит глюкозу, то сначала мы получим синий растворимый комплекс глюкозы, который при нагревании разложится до красного Сu2O.
6. а) Сначала определим крахмал, добавив к каждому из трех веществ раствор иода. В пробирке с крахмалом образуется синий комплекс. Глюкозу от сахарозы можно отличить за счет альдегидных свойств. Оба вещества обладают свойствами многоатомного спирта, но только глюкоза обладает еще и свойствами альдегида. добавим в обе пробирки Cu(OH)2, образуется синий раствор. Но только при нагревании с глюкозой выпадает красный осадок Сu2O (т.е. происходит окисление альдегидной группы).
б) Сначала определим крахмал с помощью иода. Образуется синий комплекс.
Теперь проверим кислотности растворов мыла и глицерина. Глицерин имеет слабокислую среду, а мыло — щелочную.
Глицерин также образует с Cu(OH)2 синий раствор (свойство многоатомных спиртов).
7. Нагреем полученные растворы. В одной из пробирок выпадет белый осадок — происходит денатурация белка. С глицерином при нагревании ничего не происходит.
Видео:Реакции глицерина, глюкозы и этилендиамина с Cu(OH)2Скачать

Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. 📺 ВидеоВзаим-вие многоатомных спиртов с гидроксидом медиСкачать  Разложение гидроксида меди II (Cu(OH)2 = CuO + H2O)Скачать  Получение осадка гидроксида меди и комплекса меди с глицериномСкачать  8.3. Многоатомные спирты (этиленгликоль, глицерин): Химические свойства. ЕГЭ по химииСкачать  Взаимодействие многоатомных спиртов с гидроксидом меди(II)Скачать  Взаимодействие глицерина с гидроксидом меди(II)Скачать  8.2. Многоатомные спирты (этиленгликоль, глицерин): Способы получения. ЕГЭ по химииСкачать  Качественные реакции с гидроксидами Cu(OH)2, Fe(OH)3, Fe(OH)2, Al(OH)3, Mg(OH)2, NH4OH, Ag2OСкачать  Качественные реакции на глицерин, глюкозу и сахарозуСкачать  Качественная Реакция На Многоатомные Спирты.Скачать  Making Cu(OH)2 (a precipitation reaction) #shortsСкачать  Горение глицерина.Скачать  Химия, 11-й класс, Этиленгликоль, глицеринСкачать  Качественная реакция глюкозы с гидроксидом меди (II)Скачать  Опыты по химии. Растворение глицерина в водеСкачать  ХИМИЧЕСКИЙ ОПЫТ - Глицерин и МарганцовкаСкачать  Glicerolio (C3H5(OH)3) atpažinimasСкачать  Реакция глицерина с перманганатом калияСкачать  |