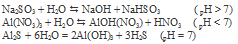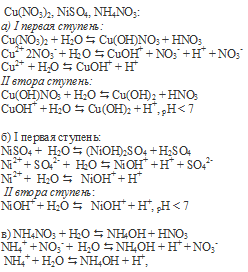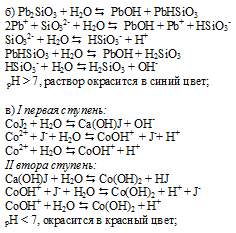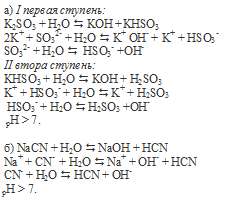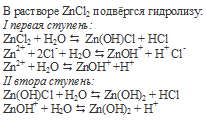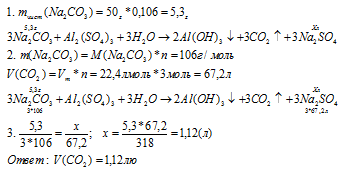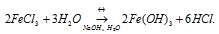Материалы портала onx.distant.ru
Теоретическое введение
Примеры обратимого гидролиза
Случаи необратимого гидролиза
Константа и степень гидролиза
Примеры решения задач
Задачи для самостоятельного решения
Видео:Гидролиз солей. 9 класс.Скачать

Теоретическое введение
Гидролиз – обменная реакция взаимодействия растворенного вещества (например, соли) с водой. Гидролиз происходит в тех случаях, когда ионы соли способны образовывать с Н + и ОН — ионами воды малодиссоциированные электролиты.
Видео:Гидролиз солей. 1 часть. 11 класс.Скачать

Примеры обратимого гидролиза
Соли, образованные сильным основанием и слабой кислотой, например , CH3COONa, Na2CO3, Na2S, KCN гидролизуются по аниону:
СН3СООNa + НОН ↔ СН3СООН + NaОН (рН > 7)
Гидролиз солей многоосновных кислот протекает ступенчато. 1 ступень:
CO3 2– + HOH ↔ HCO3 – + OH – ,
или в молекулярной форме:
или в молекулярной форме:
Продукты гидролиза по первой ступени подавляют вторую ступень гидролиза, в результате вторая ступень гидролиза протекает незначительно.
Соли, образованные слабым основанием и сильной кислотой, например , NH4Cl, FeCl3, Al2(SO4)3, гидролизуются по катиону:
или в молекулярной форме:
Соли, образованные многокислотными основаниями, гидролизуются ступенчато, образуя катионы основных солей. 1 ступень:
Fe 3+ + HOH ↔ FeOH 2+ + H + ;
FeCl3 + HOH ↔ FeOHCl2 + HCl
FeOH 2+ + HOH ↔ Fe(OH)2 + + H + ;
FeOHCl2 + HOH ↔ Fe(OH)2Cl+ HCl.
Fe(OH)2 + + HOH ↔ Fe(OH)3 + H + ;
Fe(OH)2Cl + HOH ↔ Fe(OH)3+ HCl.
Гидролиз по второй и, в особенности, по третьей ступени практически не протекает при комнатной температуре.
Соли, образованные слабым основанием и слабой кислотой, например , CH3COONH4, (NH4)2CO3, HCOONH4, гидролизуются и по катиону, и по аниону:
В этом случае реакция раствора зависит от соотношения констант диссоциации образующихся кислот и оснований. Поскольку в рассматриваемом примере константы диссоциации СH3COOH и NH3·H2О при 25 о С примерно равны (Кд(СH3COOH) = 1,75·10 –5 , Кд(NH3·H2О) = 1,76·10 –5 ), то раствор соли будет нейтральным.
При гидролизе HCOONH4 реакция раствора будет слабокислой, поскольку константа диссоциации муравьиной кислоты (Кд(HCOOН) = 1,77·10 –4 ) больше константы диссоциации уксусной кислоты.
Соли, образованные сильным основанием и сильной кислотой (например, NaNO3, KCl, Na2SO4), при растворении в воде гидролизу не подвергаются.
Видео:Гидролиз солей. Классификация солей. Решение примеров.Скачать

Случаи необратимого гидролиза
Гидролиз некоторых солей, образованных слабыми основаниями и слабыми кислотами, протекает необратимо. Необратимо гидролизуется, например , сульфид алюминия:
Следует отметить, что при смешении растворов солей гидролизующихся по аниону и катиону:
Mg 2+ + HOH ↔ MgOH + + H + ,
CO3 2– + HOH ↔ HCO3 – + OH –
Продукты гидролиза первой соли усиливают гидролиз второй соли и наоборот. В результате при смешении водных растворов сульфата магния и карбоната натрия образуется основной карбонат магния:
Основные карбонаты выпадают в осадок также при смешивании растворов карбонатов щелочных металлов и солей Be 2+ , Co 2+ , Ni 2+ , Zn 2+ , Pb 2+ , Cu 2+ и др.
При сливании растворов соды и солей Fe 2+ , Ca 2+ , Sr 2+ , Ba 2+ реакции протекают следующим образом:
(Ме – Fe, Ca, Sr, Ba)
При взаимодействии солей Аl 3+ , Сr 3+ и Fe 3+ в растворе с сульфидами, карбонатами и сульфитами в результате гидролиза в осадок выпадают не сульфиды, карбонаты и сульфиты этих катионов, а их гидроксиды:
Следует отметить, что катион Fe 3+ производит окисляющее действие на анион S 2- . В результате протекает реакция:
2Fe 3+ + S 2- = 2Fe 2+ + S о .
Например , хлорид железа (III) реагирует с сульфидом калия:
2FeCl3 + 3K2S = 2FeS + S + 6KCl
Некоторые соли в результате гидролиза в воде образуют малорастворимые оксосоединения:
SbCl3 + H2O → SbOCl↓ + 2HCl.
Необратимо гидролизуются в водных растворах галогенангидриды:
Видео:Всё про ГИДРОЛИЗ для ЕГЭ ПО ХИМИИ. с ЭКСПЕРИМЕНТАМИ!Скачать

Константа и степень гидролиза
Константа Кг и α г степень гидролиза для растворов электролитов связаны между собой уравнением, по форме совпадающим с уравнением Оствальда:

Константа гидролиза Кг может быть рассчитана на основе значений ионного произведения воды Кw и константы диссоциации Кд образующихся в результате гидролиза слабой кислоты или слабого основания:

Видео:Ступенчатый гидролиз солей по аниону. Решаем примеры.Скачать

Примеры решения задач
Задача 1. Вычислите Кг, α г и рН 0,01 М раствора NH4Cl при температуре 298 К, если при указанной температуре Кд(NH3·H2O) = 1,76× 10 -5 .
Решение.

[Н + ] = 2,4·10 –4× 0,01 = 2,4× 10 –6 М.
рН = — lg 2,4× 10 –6 = 5,6.
Задача 2. Определите константу гидролиза, степень гидролиза и рН 0,02 М раствора НСООNa при 298 К, если при указанной температуре Кд(НСООН) = 1,77× 10 –4 .
Решение. Формиат натрия гидролизуется в соответствии с уравнением:
НСОО — + Н2О ↔ НСООН + ОН — .
Поскольку [НСООН] = [ОН – ] и [НСОО – ]·Сисх(НСООNa), то константу гидролиза можно записать следующим образом:

[Н + ] = 10 –14 ÷1,06× 10 –6 = 9,4·10 –9 М
рН = — lg 9,4× 10 –9 = 8
Задача 3. Определите рН 0,006М раствора NaNO2, если α г = 7·10 –3 %.
Решение.
[ОН – ] = 0,006× 7× 10 –5 = 4,2× 10 –7 М.
[Н + ] = 10 –14 :4,2× 10 –7 = 2,4× 10 –8 М.
рН = — lg 2,4× 10 –8 = 7,6.
Задача 5. Определите рН 0,1 М раствора Na3PO4 при 298 К, если константы диссоциации ортофосфорной кислоты при указанной температуре соответственно равны: Кд.1 = 7,11× 10 — 3 , Kд.2 = 6,34× 10 — 8 , Kд.3 = 4,40× 10 — 13 .
Решение. Na3PO4 диссоциирует в растворе и подвергается ступенчатому гидролизу:
Следует обратить внимание на выбор “нужной” величины Кд.
Kдисс.2 = 6,34·10 — 8
Так как Кг,1 > > Кг,2, то можно считать, что соль подвергается гидролизу только по первой ступени.

поскольку [HPO4 2- ] = [OH — ].
рОН = –lg 4,76× 10 — 2 = 1,32 и рН = 14 – 1,32 = 12,68.
Видео:Расчет рН растворов сильных и слабых кислот. Химия для поступающих.Скачать

Задачи для самостоятельного решения
1. Гидролиз соли Na2SO3 усилится при добавлении в раствор веществ:
| а) Н2O | б) Na2CO3 | в) NaOH |
| г) H2SO4 | д) Na2S | е) Na2SO4 |
2. Напишите уравнение реакции NiCl2 + Na2CO3 + H2O → .
Видео:Примеры решения задач на водородный показатель pH растворов. 11 класс.Скачать

Реакции гидролиза органических веществ и минеральных солей
Вопрос 1.
Примерами органических веществ, подвергающихся гидролизу, являются сахароза, бромметан, метиловый эфир муравьиной кислоты:
а) гидролиз сахарозы протекает в присутствии серной кислоты и при нагревании с образованием глюкозы и фруктозы:
б) гидролиз бромметана протекает в присутствии едкого калия, при этом образуется метиловый спирт и бромоводород:
в) при гидролизе метилового эфира муравьиной кислоты образуется муравьиная кислота и метиловый спирт:
Вопрос 2.
Гидролизу подвергаются соли, образованные сильным основанием и слабой кислотой, слабым основанием и сильной кислотой, слабым основанием и слабой кислотой. Водные растворы солей при этом могут иметь щелочную, кислую и нейтральную среды, соответственно.
Вопрос 3.
Гидролизу по катиону подвергаются соли слабого основания и сильной кислоты:
Вопрос 4.
Гидролиз по аниону подвергаются соли сильного основания и слабой кислоты: CaS, Na2SO3, K(HCOO):
Вопрос 5.
а) SrCl2 – соль сильного основания и сильной кислоты, поэтому не подвергается гидролизу.
г) BaBr2 – соль сильного основания и сильной кислоты, поэтому не подвергается гидролизу. Реакция среды будет нейтральная, pH = 7, лакмус — фиолетовый.
з) NaJ – соль сильного основания и сильной кислоты, поэтому не подвергается гидролизу. Реакция среды будет нейтральная, pH = 7, лакмус — фиолетовый.
и) KNO3 – соль сильного основания и сильной кислоты, поэтому не подвергается гидролизу. Реакция среды будет нейтральная, pH = 7, лакмус — фиолетовый.
Вопрос 6.
Фенолфталеин окрашивает щелочные растворы в малиновый цвет. Окраска растворов при добавлении фенолфталеина изменится (станет малиновой) при добавлении его к растворам солей, образованных сильным основанием и слабой кислотой.
По условию задания это соли K2SO3 и NaCN.
Вопрос 7.
При гидролизе соли ZnCl2 в растворе образовалось небольшое количество соляной кислоты, которая прореагировала с металлическим цинком с образованием пузырьков газа водорода: Zn + 2HCl ↔ ZnCl2 H2↑
Вопрос 8.
Гидролизу и по катиону и по аниону подвергаются соли образованные слабой кислотой и слабым основанием. По условию задания это
соль (NH4)2SO3.
Вопрос 9.
Уравнение реакции имеет вид:
3NaH2COH3 + AlH2(SOH4)H3 + 3HH2O ↔ 2Al(OH)H3↓ + 3COH2↑ + 3NaH2SOH4
Вопрос 10.
Расположение солей в порядке возрастания кислотности среды их водных растворов:
Na2CO3, Na(CH3COO), Na(CH2ClCOO), NaNO3, NH4Cl.
Растворы солей Na2CO3, Na(CH3COO), Na(CH2ClCOO) имеют щелочную среду, поэтому они располагаются вначале; т.к. являются солями сильного основания NaOH и слабых кислот H2CO3, CH3COOH, CH2ClCOOH. Эти соли гидролизуются по аниону и поэтому образуют в растворах избыток ионов OH – , которые и придают раствору щелочную среду. H2CO3 — самая слабая из всех кислот, те. среда Na2CO3 — самая щелочная, то он находится первым в ряду, СН3СООН более сильная кислота, СН2СIСООН еще более сильная, среды Na(CH3COO) и Na(CH2ClCOO) менее щелочные, поэтому они располагаются следующими. NaNO3 – соль сильного основания (NaOH) и сильной кислоты (HNO3) имеет нейтральную среду, т.к. гидролизу не подвергается. NH4Cl — соль слабого основания (NH4OH) и сильной кислоты (HCl) гидролизуется по катиону с образованием избытка ионов водорода H + , что и придаёт раствору соли слабокислую среду.
Вопрос 11.
FeCl3 – соль слабого основания (Fe(OH)3 и сильной кислоты (HCl) гидролизуется по катиону с образованием избытка ионов водорода H + , что придаёт раствору соли слабокислую среду. При добавлении к раствору щёлочи NaOH или H2O уменьшится концентрация H + , что будет вести к усилению гидролиза соли. Равновесие реакции будет смещаться вправо.
Добавление к раствору FeCl3 растворов HCl и ZnCl2, и металлического Zn ,будет вести к увеличению концентрации ионов водорода, что будет вести к ослаблению гидролиза.
Вопрос 12.
K2S – соль сильного основания и слабой кислоты гидролизуется по аниону с образованием ионов OH – , что придаёт раствору соли щелочную среду:
K2S + 2H2O ↔ 2KOH + H2S
Поэтому для подавления гидролиза нужно понизить кислотность, ввести дополнительно ионы OH – ,например, раствор KOH. Можно уменьшить концентрацию самой соли K2S, а также понизить температуру.
Видео:Гидролиз солей. Теория для задания 23 ЕГЭ по химии.Скачать

Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. 🎥 ВидеоГидролиз солей. Опыт 1. Окраска индикаторов в различных средахСкачать  Летучка: все реакции гидролиза | Химия ЕГЭ 2023 | УмскулСкачать  Гидролиз солей. Опыт 2. Определение реакции среды в растворах солейСкачать  Химия 9 класс (Урок№8 - Гидролиз солей.)Скачать  11 класс. Гидролиз солей.Скачать  Кислотно-основные равновесия в водном растворе. Гидролиз солей.Скачать  Гидролиз | Химия ЕГЭ | УмскулСкачать  Гидролиз солей | ХимияСкачать  Щелочь + соль = ??? | Опыты для ЕГЭ и ОГЭ по химииСкачать  Решаем все задания на гидролиз в ЕГЭСкачать  Совместный гидролиз за 12 минут | ХИМИЯ ЕГЭ | СОТКАСкачать  Гидролиз солей. Практическая часть. 10 класс.Скачать  |