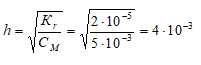K2S — соль образованная сильным основанием и слабой кислотой, поэтому реакция гидролиза протекает по аниону.
- Первая стадия (ступень) гидролиза
- Вторая стадия (ступень) гидролиза
- Среда и pH раствора сульфида калия
- Как правильно написать уравнения гидролиза и рассчитать константу и степень гидролиза соли
- Молекулярная и ионная формы уравнений реакций гидролиза
- а) Гидролиз сульфида калия:
- б) Гидролиз сульфата меди (ⅠⅠ):
- в) Совместный гидролиз хлорида алюминия и ацетата калия:
- Определение степени гидролиза и рН раствора цианида калия
- Гидролиз khs соли протекает по уравнению s2 hoh hs oh
- 💥 Видео
Видео:ГИДРОЛИЗ СОЛЕЙ | 9 класс | Кратко и понятноСкачать

Первая стадия (ступень) гидролиза
Молекулярное уравнение
K2S + HOH ⇄ KHS + KOH
Полное ионное уравнение
2K + + S 2- + HOH ⇄ K + + HS — + K + + OH —
Сокращенное (краткое) ионное уравнение
S 2- + HOH ⇄ HS — + OH —
Видео:Гидролиз солей. 9 класс.Скачать

Вторая стадия (ступень) гидролиза
Молекулярное уравнение
KHS + HOH ⇄ H2S + KOH
Полное ионное уравнение
K + + HS — + HOH ⇄ H2S + K + + OH —
Сокращенное (краткое) ионное уравнение
HS — + HOH ⇄ H2S + OH —
Видео:Гидролиз солей. 1 часть. 11 класс.Скачать

Среда и pH раствора сульфида калия
В результате гидролиза образовались гидроксид-ионы (OH — ), поэтому раствор имеет щелочную среду (pH > 7).
Видео:Гидролиз солейСкачать

Как правильно написать уравнения гидролиза и рассчитать константу и степень гидролиза соли
Видео:Гидролиз солей. Теория для задания 23 ЕГЭ по химии.Скачать

Молекулярная и ионная формы уравнений реакций гидролиза
Задача 21.
Напишите в молекулярной и ионной форме уравнения реакций гидролиза следующих солей: а) сульфида калия; б) сульфата меди (ⅠⅠ); в) совместного гидролиза хлорида алюминия и ацетата калия. Константа гидролиза соли.
Решение:
а) Гидролиз сульфида калия:
K2S + H2O = KHS + KOH — (молекулярная форма);
S 2– + HOH = HS – + OH – — (ионная форма).
б) Гидролиз сульфата меди (ⅠⅠ):
Cu 2+ + HOH = CuOH + + H + — (ионная форма).
в) Совместный гидролиз хлорида алюминия и ацетата калия:
AlCl3 + 3CH3COOK + 3H2O = Al(OH)3↓ + 3CH3COOH + 3KCl — (молекулярная форма);
Al 3+ + 3CH3COO – + 3HOH = Al(OH)3↓ + 3CH3COOH — (ионная форма).
Определение степени гидролиза и рН раствора цианида калия
Задача 22.
Определите степень гидролиза и pH раствора цианида калия с молярной концентрацией 0,005 моль/л.
Решение:
Цианид калия – соль, образованная сильным основанием КОН и слабой кислотой HCN, которая в водном растворе гидролизуется по аниону.
KCN + HOH ⇔ KOH + HCN
CN – + HOH ⇔ HCN + OH –
Таким образом, при гидролизе этой соли в растворе ее будет избыток ионов OH-, что придает раствору щелочную реакцию
(pH > 7 – среда щелочная).
Константа гидролиза соли, образованной слабой кислотой и сильным основанием определяется по формуле:
Kw = 1 . 10 -14 – ионное произведение воды.
KD(HCN) = 5 . 10 -10 – константа диссоциации циановодородной кислоты
Константа гидролиза цианида калия равна:
Kr(KCN) = Kw/KD(HCN) = (1 . 10 -14 )/(5 . 10 -10 ) = 2 . 10 -5 .
Находим степень гидролиза цианида калия, получим:
Рассчитаем молярную концентрацию ионов OH? в растворе, получим:
[OH – ] = h . СM(KCN) = (4 . 10 -3 ) . 0,005 = 2 . 10 -5 моль/л.
Находим гидроксильный показатель, получим:
рОН = — lg[OH – ] = – lg2 . 10 -5 = 5 — lg2 = 5 — 0,30 = 4,7.
Находим водородный показатель, получим
Видео:Химия 9 класс (Урок№8 - Гидролиз солей.)Скачать

Гидролиз khs соли протекает по уравнению s2 hoh hs oh
1.4. Гидролиз солей
Гидролиз – процесс обменного взаимодействия ионов соли с водой, приводящий к образованию малодиссоциированных веществ и сопровождающийся изменением реакции ( pH ) среды.
Суть гидролиза солей заключается в том, что происходит смещение равновесия диссоциации воды вследствие связывания одного из ее ионов с образованием малодиссоциированного или труднорастворимого вещества. В результате гидролиза могут образовываться молекулы слабых кислот и оснований, анионы кислых солей или катионы основных солей. В большинстве случаев гидролиз является обратимым процессом. При повышении температуры и разбавлении гидролиз усиливается. Гидролиз идет по-разному в зависимости от силы кислоты и основания, образовавших соль. Рассмотрим различные случаи гидролиза солей.
а) Соль образована слабой кислотой и сильным основанием ( K 2 S ).
При растворении в воде K2S диссоциирует
K2S
При составлении уравнений гидролиза в первую очередь необходимо определить ионы соли, связывающие ионы воды в малодиссоциирующие соединения, т.е. ионы, обусловливающие гидролиз.
В данном случае ионы S 2- связывают катион H + , образуя ион HS –
S 2– +H2O
Уравнение гидролиза в молекулярной форме
K2S + H2O
Практически гидролиз соли преимущественно ограничивается первой ступенью с образованием кислой соли (в данном случае KHS). Таким образом, гидролиз соли, образованной сильным основанием и слабой кислотой (такой, как K2S) протекает по аниону соли. Избыток ионов OH – в растворе обусловливает щелочную реакцию среды в растворе (pН>7).
При растворении в воде CuCl2 диссоциирует
СuCl2
Ионы Cu 2+ соединяются с ионами OH – , образуя гидроксоионы CuOH + . Гидролиз соли ограничивается первой ступенью, и образование молекулы Cu(OH)2 не происходит. Ионно-молекулярное уравнение имеет вид
Cu 2+ + HOH
В данном случае продуктами гидролиза являются основная соль и кислота. Уравнение гидролиза в молекулярной форме записывается следующим образом
CuCl2 + H2O
Таким образом, гидролиз соли, образованной слабым основанием и сильной кислотой (в данном случае CuCl2) протекает по катиону соли. Избыток ионов H + в растворе обусловливает кислую реакцию среды в растворе (рН
При растворении в воде Al 2 ( SO 4 )3 диссоциирует
Al 2 ( SO 4 )3
В данном случае ионы Al 3+ соединяются с ионами ОН — , образуя гидроксоионы AlOH 2+ . Гидролиз соли ограничивается первой ступенью, и образование молекулы Al ( OH )3 не происходит. Ионно-молекулярное уравнение имеет вид
Al 3+ + Н2О 
Продуктами электролиза является основная соль и кислота.
Уравнение гидролиза в молекулярной форме записывается следующим образом
Al2(SO4)3+2 Н 2 О 
в) Соль образована слабой кислотой и слабым основанием (CH3COONH4).
CH3COO – + NH4 + + H2O 
В этом случае образуются два малодиссоциированных соединения, и pH раствора зависит от относительной силы кислоты и основания. Если продукты гидролиза могут удаляться из раствора, то гидролиз протекает до конца. Например
Возможны и другие случаи необратимого гидролиза, их нетрудно предсказать, ведь для необратимости процесса небходимо, чтобы хотя бы один из продуктов гидролиза уходил из сферы реакции.
г) Соли, образованные сильной кислотой и сильным основанием ( NaCl , K 2 SO 4 , RbBr и др.) гидролизу не подвергаются, т.к. единственным малодиссоциирующим соединением является H2O (рН=7). Растворы этих солей имеют нейтральную среду. Например
NaCl + H 2 O 
Na + + Cl – + H2O 
H 2 O 
Реакции обратимого гидролиза полностью подчиняются принципу Ле–Шателье. Поэтому гидролиз соли можно усилить (и даже сделать необратимым) следующими способами:
1) добавить воды;
2) нагреть раствор, при этом усиливается эндотермическая диссоциация воды, а значит, увеличивается количество ионов Н + и ОН – , которые необходимы для осуществления гидролиза соли;
3) связать один из продуктов гидролиза в труднорастворимое соединение или удалить один из продуктов в газовую фазу; например, гидролиз цианида аммония NH 4 CN будет значительно усиливаться за счет разложения гидрата аммиака с образованием аммиака NH 3 и воды:
NH4 + + CN – + H2O 
Гидролиз можно подавить , действуя следующим образом:
1) увеличить концентрацию растворенного вещества;
2) охладить раствор ( для ослабления гидролиза растворы солей следует хранить концентрированными и при низких температурах);
3) ввести в раствор один из продуктов гидролиза; например, подкислять раствор, если его среда в результате гидролиза кислая, или подщелачивать, если щелочная.
Взаимное усиление гидролиза Допустим, что в разных сосудах установились равновесия
CO3 2– + H2O 
Al 3+ + H2O 
Обе соли гидролизованы незначительно, но если растворы смешать, то происходит связывание ионов H + и OH – . В соответствии с принципом Ле-Шателье оба равновесия смещаются вправо, гидролиз усиливается и протекает полностью
Это называется взаимным усилением гидролиза. Таким образом, если смешивать растворы солей, из которых одна гидролизуется по катиону, а другая – по аниону, гидролиз усиливается и протекает полностью.
💥 Видео
Гидролиз солей | Задание 21 | 10-11 классыСкачать

Гидролиз солей. Классификация солей. Решение примеров.Скачать

Как выглядит совместный гидролиз солей на ЕГЭ - химические опыты | Химия 10 класс УмскулСкачать

Гидролиз солей. Задание №23 ЕГЭ | Екатерина Дацук | ХИМИЯ ЕГЭСкачать

Гидролиз солей и среда водных растворов веществ, Задание 21 | ЕГЭ по химии 2024Скачать

Гидролиз солей. 10 класс.Скачать

Ступенчатый гидролиз солей по аниону. Решаем примеры.Скачать

11 класс. Гидролиз солей.Скачать

Гидролиз солей.ПримерыСкачать

РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Гидролиз солей. Практическая часть. 10 класс.Скачать

Химия 8 класс: Гидролиз солейСкачать

Гидролиз солей. Опыт 1. Окраска индикаторов в различных средахСкачать

Константа гидролиза и pH водного раствора солиСкачать