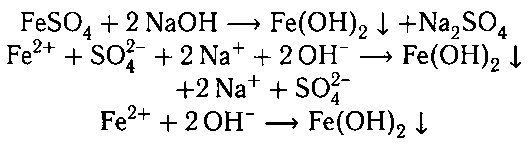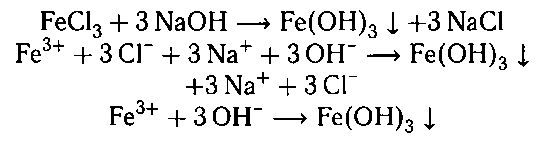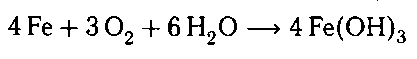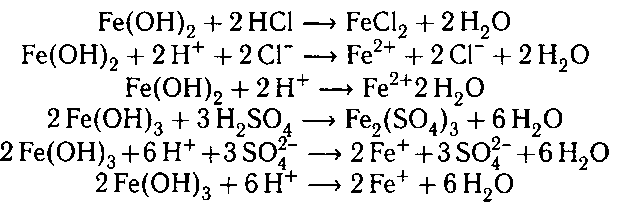Гидроксид железа (II)
Способы получения
1. Гидроксид железа (II) можно получить действием раствора аммиака на соли железа (II).
Например , хлорид железа (II) реагирует с водным раствором аммиака с образованием гидроксида железа (II) и хлорида аммония:
2. Гидроксид железа (II) можно получить действием щелочи на соли железа (II).
Например , хлорид железа (II) реагирует с гидроксидом калия с образованием гидроксида железа (II) и хлорида калия:
FeCl2 + 2KOH → Fe(OH)2↓ + 2KCl
Химические свойства
1. Гидроксид железа (II) проявляется основные свойства , а именно реагирует с кислотами . При этом образуются соответствующие соли.
Например , гидроксид железа (II) взаимодействует с соляной кислотой с образованием хлорида железа (II):
2. Гидроксид железа (II) взаимодействует с кислотными оксидами сильных кислот .
Например , гидроксид железа (II) взаимодействует с оксидом серы (VI) с образованием сульфата железа (II):
3. Гидроксид железа (II) проявляет сильные восстановительные свойства , и реагирует с окислителями. При этом образуются соединения железа (III) .
Например , гидроксид железа (II) взаимодействует с кислородом в присутствии воды:
Гидроксид железа (II) взаимодействует с пероксидом водорода:
При растворении Fe(OH)2 в азотной или концентрированной серной кислотах образуются соли железа (III):
4. Г идроксид железа (II) разлагается при нагревании :
Видео:Практическая работа №5. Разбавленная серная кислота и её соли. 9 класс.Скачать

Лабораторные опыты 18 и 19 Химия 9 класс Рудзитис, Фельдман
Кто сделал лабы?
Получение гидроксида железа(II) и взаимодействие его с кислотами.
1. Налейте в пробирку 2—3 мл свежеприготовленного раствора сульфата железа(II) и добавьте немного раствора гидроксида натрия. 2. К полученному осадку добавьте немного соляной кислоты.
Получение гидроксида железа(III) и взаимодействие его с кислотами.
1. Налейте в пробирку 2—3 мл раствора хлорида железа(III) и добавьте немного раствора гидроксида натрия. 2. К полученному осадку добавьте немного серной кислоты.
Задания.
1. Как получают гидроксид железа(II) и гидроксид железа(III)?
2. Какого цвета полученные осадки? 3. Какие вещества образуются при взаимодействии полученных осадков с кислотами? 4. Напишите уравнения соответствующих реакций в молекулярном, ионном и сокращенном ионном виде. 5. Как можно определить ионы железа Fе2+ и Fе3+?
Получение гидроксида железа(II) и взаимодействие его с кислотами.
Получение гидроксида железа(III) и взаимодействие его с кислотами.
1. Гидроксид железа (II) получают действием
щелочей на водные растворы солей железа (II):
Гидроксид железа (III) получают взаимодействи-
ем солей железа (III) со щелочами:
Также можно получить взаимодействием чисто-
го железа при нагревании с водой в присутствии
кислорода воздуха:
3. Гидроксид железа (II) зеленого цвета, гид-
роксид железа (III) бурого цвета.
4. При взаимодействии полученных осадков с
кислотами получаются соли железа:
5. Ионы Fe 2+ от Fe 3 + можно отличить по цвету их
гидроксидов: зеленого Fe(OH)2, бурого — Fe(OH)3.
Видео:СЕРНАЯ КИСЛОТА разбавленная и концентрированная - в чем отличия? | Химия ОГЭСкачать

Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. 📺 ВидеоКИСЛОТЫ В ХИМИИ — Химические Свойства Кислот. Реакция Кислот с Основаниями, Оксидами и МеталламиСкачать  Опыты по химии. Получение гидроксида железа (II) и изучение его свойствСкачать  Опыты по химии. Получение гидроксида железа (III) и изучение его свойствСкачать  Серная кислота и металлы за 10 минут | ХИМИЯ ЕГЭ | СОТКАСкачать  Серная кислота. Химические свойства. Реакции с металлами.Скачать  Взаимодействие гидроксида железа (III) с серной кислотой | ЕГЭ по химииСкачать  Получение и превращения гидроксидов железа Fe(OH)2 и Fe(OH)3Скачать  Fe + H2SO4 → FeSO4 + H2 | Реакция взаимодействия железа и серной кислотыСкачать  Химия 9 класс (Урок№13 - Оксид серы (VI). Серная кислота и ее соли.)Скачать  Взаимодействие серной кислоты с металламиСкачать  Концентрированная серная кислота и ее особые свойства | Химия ЕГЭ | УмскулСкачать  Реакция Концентрированной Серной Кислоты и Хлората Натрия. Реакция H2SO4 и NaClO3. Выделение ClO2.Скачать  9 класс.Химия.ОГЭ.Задание 24.Сульфат железа (II).Скачать  Все про серную кислоту | Химия ОГЭ 2023 | УмскулСкачать  Как получить гидроксиды металла в 2 стадии?Скачать  Сульфат Нитрожелеза(2) - [Fe(NO)]SO4. Реакция Нитрита Натрия, Серной кислоты и Сульфата Железа(2).Скачать ![Сульфат Нитрожелеза(2) - [Fe(NO)]SO4. Реакция Нитрита Натрия, Серной кислоты и Сульфата Железа(2).](https://i.ytimg.com/vi/FlTKUvWX9mU/0.jpg) Химическая реакция FeSO4 с KMnO4 и H2SO4Скачать  ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать  |