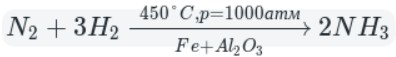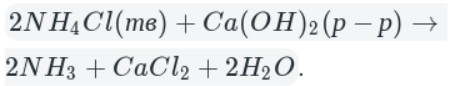- Положение в периодической системе химических элементов
- Электронное строение азота
- Физические свойства и нахождение в природе
- Строение молекулы
- Соединения азота
- Способы получения азота
- Химические свойства азота
- Аммиак
- Строение молекулы и физические свойства
- Способы получения аммиака
- Химические свойства аммиака
- Соли аммония
- Способы получения солей аммония
- Химические свойства солей аммония
- Оксиды азота
- Оксид азота (I)
- Оксид азота (II)
- Оксид азота (III)
- Оксид азота (IV)
- Оксид азота (V)
- Азотная кислота
- Строение молекулы и физические свойства
- Способы получения
- Химические свойства
- Азотистая кислота
- Соли азотной кислоты — нитраты
- Соли азотистой кислоты — нитриты
- Генетическая взаимосвязь неорганических соединений. Азот, аммиак, азотная кислота.
- Краткое описание документа:
- Дистанционное обучение как современный формат преподавания
- Педагогическая деятельность в контексте профессионального стандарта педагога и ФГОС
- Химия: теория и методика преподавания в образовательной организации
- Дистанционные курсы для педагогов
- Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
- Другие материалы
- Вам будут интересны эти курсы:
- Оставьте свой комментарий
- Автор материала
- Дистанционные курсы для педагогов
- Подарочные сертификаты
- Генетическая связь между азотом и его важнейшими соединениями уравнения реакций
- Электронное строение азота
- Строение молекулы азота
- Физические свойства азота
- Химические свойства азота
- Важнейшие соединения азота
- Аммиак
- Азотная кислота
- Оксиды азота
- Вопросы для самопроверки
- 🎥 Видео
Положение в периодической системе химических элементов
Азот расположен в главной подгруппе V группы (или в 15 группе в современной форме ПСХЭ) и во втором периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение азота
Электронная конфигурация азота в основном состоянии :
Атом азота содержит на внешнем энергетическом уровне 3 неспаренных электрона и одну неподеленную электронную пару в основном энергетическом состоянии. Следовательно, атом азота может образовать 3 связи по обменному механизму и 1 связь по донорно-акцепторному механизму. Таким образом, максимальная валентность азота в соединениях равна IV. Также характерная валентность азота в соединениях — III.
Степени окисления атома азота – от -3 до +5. Характерные степени окисления азота -3, 0, +1, +2, +3, +4, +5.
Физические свойства и нахождение в природе
Азот в природе существует в виде простого вещества газа N2. Нет цвета, запаха и вкуса. Молекула N2 неполярная, следовательно, в воде азот практически нерастворим.
Азот – это основной компонент воздуха (79% по массе). В земной коре азот встречается в основном в виде нитратов. Входит в состав белков, аминокислот и нуклеиновых кислот в живых организмах.
Строение молекулы
Связь между атомами в молекуле азота – тройная, т.к. у каждого атома в молекуле по 3 неспаренных электрона. Одна σ-связь (сигма-связь) и две — π-связи.
Структурная формула молекулы азота:
Структурно-графическая формула молекулы азота: N≡N.
Схема перекрывания электронных облаков при образовании молекулы азота:
Соединения азота
Типичные соединения азота:
| Степень окисления | Типичные соединения |
| +5 | оксид азота (V) N2O5 азотная кислота HNO3 нитраты MeNO3 |
| +4 | оксид азота (IV) NO2 |
| +3 | оксид азота (III) нитриты MeNO2 |
| +2 | оксид азота (II) NO |
| +1 | оксид азота (I) |
| -3 | аммиак NH3 нитриды металлов MeN бинарные соединения азота с неметаллами |
Способы получения азота
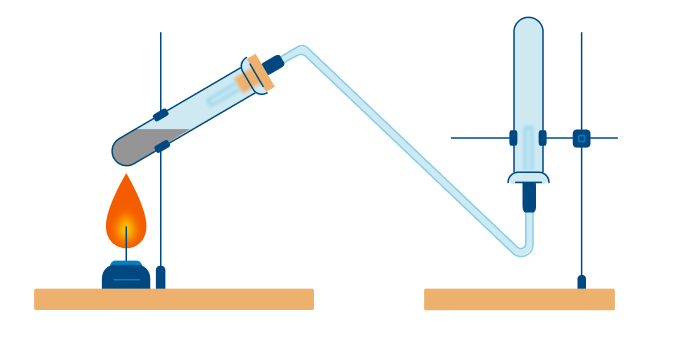
1. Азот в лаборатории получают при взаимодействии насыщенных растворов хлорида аммония и нитрита натрия. Образующийся в результате реакции обмена нитрит аммония легко разлагается с образованием азота и воды. В колбу наливают раствор хлорида аммония, а капельную воронку раствор нитрита натрия. При приливании нитрита натрия в колбу начинается выделение азота. Собирают выделяющийся азот в цилиндр. Горящая лучинка в атмосфере азота гаснет.
Суммарное уравнение процесса:
Видеоопыт взаимодействия нитрита натрия с хлоридом аммония можно посмотреть здесь.
Азот также образуется при горении аммиака:
2. Наиболее чистый азот получают разложением азидов щелочных металлов.
Например , разложением азида натрия:
3. Еще один лабораторный способ получения азота — восстановление оксида меди (II) аммиаком при температуре
3CuO + 2NH3 → 3Cu + N2 + 3H2O
В промышленности азот получают, буквально, из воздуха. При промышленном производстве очень важно, чтобы сырье было дешевым и доступным. Воздуха много и он пока бесплатный.
Используются различные способы выделения азота из воздуха — адсорбционная технология, мембранная и криогенная технологии.
Адсорбционные методы разделения воздуха на компоненты основаны на разделения газовых сред в азотных установках лежит явление связывания твёрдым веществом, называемым адсорбентом, отдельных компонентов газовой смеси.
Основным принципом работы мембранных систем является разница в скорости проникновения компонентов газа через вещество мембраны. Движущей силой разделения газов является разница парциальных давлений на различных сторонах мембраны.
В основе работы криогенных установок разделения воздуха лежит метод разделения газовых смеси, основанный на разности температур кипения компонентов воздуха и различии составов находящихся в равновесии жидких и паровых смесей.
Химические свойства азота
При нормальных условиях азот химически малоактивен.
1. Азот проявляет свойства окислителя (с элементами, которые расположены ниже и левее в Периодической системе) и свойства восстановителя (с элементами, расположенными выше и правее). Поэтому азот реагирует с металлами и неметаллами .
1.1. Молекулярный азот при обычных условиях с кислородом не реагирует. Реагирует с кислородом только при высокой температуре (2000 о С), на электрической дуге (в природе – во время грозы) :
Процесс эндотермический, т.е. протекает с поглощением теплоты.
1.2. При сильном нагревании (3000 о С-5000 о С или действие электрического разряда) образуется атомарный азот, который реагирует с серой , фосфором, мышьяком, углеродом с образованием бинарных соединений:
2С + N2 → N≡C–C≡N
Молекулярный азот, таким образом, не реагирует с серой , фосфором, мышьяком, углеродом.
1.3. Азот взаимодействует с водородом при высоком давлении и высокой температуре, в присутствии катализатора. При этом образуется аммиак:
Этот процесс экзотермический, т.е. протекает с выделением теплоты.
1.4. Азот реагирует с активными металлами : с литием при комнатной температуре, кальцием, натрием и магнием при нагревании. При этом образуются бинарные соединения-нитриды.
Например , литий реагирует с азотом с образованием нитрида лития:
2. Со сложными веществами азот практически не реагирует из-за крайне низкой реакционной способности.
Взаимодействие возможно только в жестких условиях с активными веществами, например, сильными восстановителями.
Например , азот окисляет гидрид лития:
Аммиак
Строение молекулы и физические свойства
В молекуле аммиака NH3 атом азота соединен тремя одинарными ковалентными полярными связями с атомами водорода:
Геометрическая форма молекулы аммиака — правильная треугольная пирамида. Валентный угол H-N-H составляет 107,3 о :
У атома азота в аммиаке на внешнем энергетическом уровне остается одна неподеленная электронная пара. Эта электронная пара оказывает значительное влиение на свойства аммиака, а также на его структуру. Электронная структура аммиака — тетраэдр , с атомом азота в центре:
Аммиак – бесцветный газ с резким характерным запахом. Ядовит. Весит меньше воздуха. Связь N-H — сильно полярная, поэтому между молекулами аммиака в жидкой фазе возникают водородные связи. При этом аммиак очень хорошо растворим в воде, т.к. молекулы аммиака образуют водородные связи с молекулами воды.
Способы получения аммиака
В лаборатории аммиак получают при взаимодействии солей аммония с щелочами. Поск
ольку аммиак очень хорошо растворим в воде, для получения чистого аммиака используют твердые вещества.
Например , аммиак можно получить нагреванием смеси хлорида аммония и гидроксида кальция. При нагревании смеси происходит образование соли, аммиака и воды:
Тщательно растирают ступкой смесь соли и основания и нагревают смесь. Выделяющийся газ собирают в пробирку (аммиак — легкий газ и пробирку нужно перевернуть вверх дном). Влажная лакмусовая бумажка синеет в присутствии аммиака.
Видеоопыт получения аммиака из хлорида аммония и гидроксида кальция можно посмотреть здесь.
Еще один лабораторный способ получения аммиака – гидролиз нитридов.
Например , гидролиз нитрида кальция:
В промышленности аммиак получают с помощью процесса Габера: прямым синтезом из водорода и азота.
Процесс проводят при температуре 500-550 о С и в присутствии катализатора. Для синтеза аммиака применяют давления 15-30 МПа. В качестве катализатора используют губчатое железо с добавками оксидов алюминия, калия, кальция, кремния. Для полного использования исходных веществ применяют метод циркуляции непровзаимодействовавших реагентов: не вступившие в реакцию азот и водород вновь возвращают в реактор.
Более подробно про технологию производства аммиака можно прочитать здесь.
Химические свойства аммиака
1. В водном растворе аммиак проявляет основные свойства (за счет неподеленной электронной пары). Принимая протон (ион H + ), он превращается в ион аммония. Реакция может протекать и в водном растворе, и в газовой фазе:
Таким образом, среда водного раствора аммиака – щелочная. Однако аммиак – слабое основание . При 20 градусах один объем воды поглощает до 700 объемов аммиака.
Видеоопыт растворения аммиака в воде можно посмотреть здесь.
2. Как основание, аммиак взаимодействует с кислотами в растворе и в газовой фазе с образованием солей аммония.
Например , аммиак реагирует с серной кислотой с образованием либо кислой соли – гидросульфата аммония (при избытке кислоты), либо средней соли – сульфата аммония (при избытке аммиака):
Еще один пример : аммиак взаимодействует с водным раствором углекислого газа с образованием карбонатов или гидрокарбонатов аммония:
Видеоопыт взаимодействия аммиака с концентрированными кислотами – азотной, серной и и соляной можно посмотреть здесь.
В газовой фазе аммиак реагирует с летучим хлороводородом. При этом образуется густой белый дым – это выделяется хлорид аммония.
NH3 + HCl → NH4Cl
Видеоопыт взаимодействия аммиака с хлороводородом в газовой фазе (дым без огня) можно посмотреть здесь.
3. В качестве основания, водный раствор аммиака реагирует с растворами солей тяжелых металлов , образуя нерастворимые гидроксиды.
Например , водный раствор аммиака реагирует с сульфатом железа (II) с образованием сульфата аммония и гидроксида железа (II):
4. Соли и гидроксиды меди, никеля, серебра растворяются в избытке аммиака, образуя комплексные соединения – амминокомплексы.
Например , хлорид меди (II) реагирует с избытком аммиака с образованием хлорида тетрамминомеди (II):
Гидроксид меди (II) растворяется в избытке аммиака:
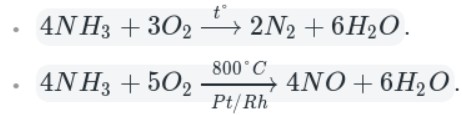
5. Аммиак горит на воздухе , образуя азот и воду:
Если реакцию проводить в присутствии катализатора (Pt), то азот окисляется до NO:
6. За счет атомов водорода в степени окисления +1 аммиак может выступать в роли окислителя , например в реакциях с щелочными, щелочноземельными металлами, магнием и алюминием . С металлами реагирует только жидкий аммиак.
Например , жидкий аммиак реагирует с натрием с образованием амида натрия:
Также возможно образование Na2NH, Na3N.
При взаимодействии аммиака с алюминием образуется нитрид алюминия:
2NH3 + 2Al → 2AlN + 3H2
7. За счет азота в степени окисления -3 аммиак проявляет восстановительные свойства. Может взаимодействовать с сильными окислителями — хлором, бромом, пероксидом водорода, пероксидами и оксидами некоторых металлов. При этом азот окисляется, как правило, до простого вещества.
Например , аммиак окисляется хлором до молекулярного азота:
Пероксид водорода также окисляет аммиак до азота:
Оксиды металлов , которые в электрохимическом ряду напряжений металлов расположены справа — сильные окислители. Поэтому они также окисляют аммиак до азота.
Например , оксид меди (II) окисляет аммиак:
2NH3 + 3CuO → 3Cu + N2 + 3H2O
Соли аммония
Соли аммония – это соли, состоящие из катиона аммония и аниона кислотного остатка .
Способы получения солей аммония
1. Соли аммония можно получить взаимодействием аммиака с кислотами . Реакции подробно описаны выше.
2. Соли аммония также получают в обменных реакциях между солями аммония и другими солями.
Например , хлорид аммония реагирует с нитратом серебра:
3. Средние соли аммония можно получить из кислых солей аммония . При добавлении аммиака кислая соль переходит в среднюю.
Например , гидрокарбонат аммония реагирует с аммиаком с образованием карбоната аммония:
Химические свойства солей аммония
1. Все соли аммония – сильные электролиты , почти полностью диссоциируют на ионы в водных растворах:
NH4Cl ⇄ NH4 + + Cl –
2. Соли аммония проявляют свойства обычных растворимых солей –вступают в реакции обмена с щелочами, кислотами и растворимыми солями , если в продуктах образуется газ, осадок или образуется слабый электролит.
Например , карбонат аммония реагирует с соляной кислотой. При этом выделяется углекислый газ:
Соли аммония реагируют с щелочами с образованием аммиака.
Например , хлорид аммония реагирует с гидроксидом калия:
NH4Cl + KOH → KCl + NH3 + H2O
Взаимодействие с щелочами — качественная реакция на ионы аммония. Выделяющийся аммиак можно обнаружить по характерному резкому запаху и посинению лакмусовой бумажки.
3. Соли аммония подвергаются гидролизу по катиону , т.к. гидроксид аммония — слабое основание:
4. При нагревании соли аммония разлагаются . При этом если соль не содержит анион-окислителя, то разложение проходит без изменения степени окисления атома азота. Так разлагаются хлорид, карбонат, сульфат, сульфид и фосфат аммония:
Если соль содержит анион-окислитель, то разложение сопровождается изменением степени окисления атома азота иона аммония. Так протекает разложение нитрата, нитрита и дихромата аммония:
При температуре 250 – 300°C:
При температуре выше 300°C:
Разложение бихромата аммония («вулканчик»). Оранжевые кристаллы дихромата аммония под действием горящей лучинки бурно реагируют. Дихромат аммония – особенная соль, в ее составе – окислитель и восстановитель. Поэтому «внутри» этой соли может пройти окислительно-восстановительная реакция (внутримолекулярная ОВР):
Окислитель – хром (VI) превращается в хром (III), образуется зеленый оксид хрома. Восстановитель – азот, входящий в состав иона аммония, превращается в газообразный азот. Итак, дихромат аммония превращается в зеленый оксид хрома, газообразный азот и воду. Реакция начинается от горящей лучинки, но не прекращается, если лучинку убрать, а становится еще интенсивней, так как в процессе реакции выделяется теплота, и, начавшись от лучинки, процесс лавинообразно развивается. Оксид хрома (III) – очень твердое, тугоплавкое вещество зеленого цвета, его используют как абразив. Температура плавления – почти 2300 градусов. Оксид хрома – очень устойчивое вещество, не растворяется даже в кислотах. Благодаря устойчивости и интенсивной окраске окись хрома используется при изготовлении масляных красок.
Видеоопыт разложения дихромата аммония можно посмотреть здесь.
Оксиды азота
| Оксиды азота | Цвет | Фаза | Характер оксида |
| N2O Оксид азота (I), закись азота, «веселящий газ» | бесцветный | газ | несолеобразующий |
| NO Оксид азота (II) | бесцветный | газ | несолеобразующий |
| N2O3 Оксид азота (III), азотистый ангидрид | синий | жидкость | кислотный |
| NO2 Оксид азота (IV), диоксид азота, «лисий хвост» | бурый | газ | кислотный (соответствуют две кислоты) |
| N2O5 Оксид азота (V), азотный ангидрид | бесцветный | твердый | кислотный |
Оксид азота (I)
Оксид азота (I) – это несолеобразующий оксид . Малые концентрации закиси азота вызывают лёгкое опьянение (отсюда название — «веселящий газ»). При вдыхании чистого газа быстро развиваются состояние опьянения и сонливость. Закись азота обладает слабой наркотической активностью, в связи с чем в медицине её применяют в больших концентрациях. В смеси с кислородом при правильном дозировании (до 80 % закиси азота) вызывает хирургический наркоз.
Строение молекулы оксида азота (I) нельзя описать методом валентных связей. Так как оксид азота (I) состоит из двух, так называемых резонансных структур, которые переходят одна в другую:
Общую формулу в таком случае можно задать, обозначая изменяющиеся связи в резонансных структурах пунктиром:
Получить оксид азота (I) в лаборатории можно разложением нитрата аммония:
Химические свойства оксида азота (I):
1. При нормальных условиях оксид азота (I) инертен. При нагревании проявляет свойства окислителя . Оксид азота (I) при нагревании окисляет водород, аммиак, металлы, сернистый газ и др. При этом азот восстанавливается в простое вещество.
N2O + Mg → N2 + MgO
Еще пример : оксид азота (I) окисляет углерод и фосфор при нагревании:
2. При взаимодействии с сильными окислителями N2O может проявлять свойства восстановителя.
Например , N2O окисляется раствором перманганата в серной кислоте:
Оксид азота (II)
Оксид азота (II) – это несолеобразующий оксид. В нормальных условиях это бесцветный ядовитый газ, плохо растворимый в воде. На воздухе коричневеет из-за окисления до диоксида азота. Сжижается с трудом; в жидком и твёрдом виде имеет голубой цвет.
Способы получения.
1. В лаборатории оксид азота (II) получают действием разбавленной азотной кислоты (30%) на неактивные металлы.
Например , при действии 30 %-ной азотной кислоты на медь образуется NO:
Также NO можно получить при окислении хлорида железа (II) или иодоводорода азотной кислотой:
3FeCl2 + NaNO3 + 4HCl → 3FeCl3 + NaCl + NO + 2H2O
2HNO3 + 6HI → 2NO + I2 + 4H2O
2. В природе оксид азота (II) образуется из азота и кислорода под действием электрического разряда, например, во время грозы:
3. В промышленности оксид азота (II) получают каталитическим окислением аммиака :
Химические свойства.
1. Оксид азота (II) легко окисляется под действием окислителей .
Например , горит в атмосфере кислорода:
Оксид азота (II) легко окисляется под действием хлора или озона:
2NO + Cl2 → 2NOCl
2. В присутствии более сильных восстановителей проявляет свойства окислителя . В атмосфере оксида азота (II) могут гореть водород, углерод и т.п.
Например , оксид азота (II) окисляет водород и сернистый газ:
Оксид азота (III)
Оксид азота (III), азотистый ангидрид – кислотный оксид . За счет азота со степенью окисления +3 проявляет восстановительные и окислительные свойства. Устойчив только при низких температурах, при более высоких температурах разлагается.
Способы получения: м ожно получить при низкой температуре из оксидов азота:
Химические свойства:
1. Оксид азота (III) взаимодействует с водой с образованием азотистой кислоты:
2. Оксид азота (III) взаимодействует с основаниями и основными оксидами :
Например , оксид азота (III) реагирует с гидроксидом и оксидом натрия с образованием нитрита натрия и воды:
Оксид азота (IV)
Оксид азота (IV) — бурый газ. Очень ядовит! Для NO2 характерна высокая химическая активность.
Способы получения.
1. Оксид азота (IV) образуется при окислении оксида азота (I) и оксида азота (II) кислородом или озоном:
2. Оксид азота (IV) образуется при действии концентрированной азотной кислоты на неактивные металлы.
Например , при действии концентрированной азотной кислоты на медь:
3. Оксид азота (IV) образуется также при разложении нитратов металлов, которые в ряду электрохимической активности расположены правее магния (включая магний) и при разложении нитрата лития.
Например , при разложении нитрата серебра:
Химические свойства.
1. Оксид азота (IV) реагирует с водой с образованием двух кислот — азотной и азотистой:
Если растворение NO2 в воде проводить в избытке кислорода , то образуется только азотная кислота:
Поскольку азотистая кислота неустойчива, то при растворении NO2 в теплой воде образуются HNO3 и NO:
2. При растворении оксида азота (IV) в щелочах образуются нитраты и нитриты:
В присутствии кислорода образуются только нитраты:
3. Оксид азота (IV) – сильный окислитель. В атмосфере оксида азота (IV) горят фосфор , уголь , сера , оксид серы (IV) окисляется до оксида серы (VI):
4. Оксид азота (IV) димеризуется :
Оксид азота (V)
N2O5 – оксид азота (V), ангидрид азотной кислоты – кислотный оксид.
Получение оксида азота (V).
1. Получить оксид азота (V) можно окислением диоксида азота :
2. Еще один способ получения оксида азота (V) – обезвоживание азотной кислоты сильным водоотнимающим веществом, оксидом фосфора (V) :
Химические свойства оксида азота (V).
1. При растворении в воде оксид азота (V) образует азотную кислоту:
2. Оксид азота (V), как типичный кислотный оксид, взаимодействует с основаниями и основными оксидами с образованием солей-нитратов.
Например , оксид азота (V) реагирует с гидроксидом натрия:
Еще пример : оксид азота (V) реагирует с оксидом кальция:
3. За счет азота со степенью окисления +5 оксид азота (V) – сильный окислитель .
Например , он окисляет серу:
4. Оксид азота (V) легко разлагается при нагревании (со взрывом):
Азотная кислота
Строение молекулы и физические свойства
Азотная кислота HNO3 – это сильная одноосновная кислота-гидроксид. При обычных условиях бесцветная, дымящая на воздухе жидкость, температура плавления −41,59 °C, кипения +82,6 °C ( при нормальном атмосферном давлении). Азотная кислота смешивается с водой во всех соотношениях. На свету частично разлагается.
Валентность азота в азотной кислоте равна IV, так как валентность V у азота отсутствует. При этом степень окисления атома азота равна +5. Так происходит потому, что атом азота образует 3 обменные связи и одну донорно-акцепторную, является донором электронной пары.
Поэтому строение молекулы азотной кислоты можно описать резонансными структурами:
Обозначим дополнительные связи между азотом и кислородом пунктиром. Этот пунктир по сути обозначает делокализованные электроны. Получается формула:
Способы получения
В лаборатории азотную кислоту можно получить разными способами:
1. Азотная кислота образуется при действии концентрированной серной кислоты на твердые нитраты металлов. При этом менее летучая серная кислота вытесняет более летучую азотную.
Например , концентрированная серная кислота вытесняет азотную из кристаллического нитрата калия:
2. В промышленности азотную кислоту получают из аммиака . Процесс осуществляется стадийно.
1 стадия. Каталитическое окисление аммиака.
2 стадия. Окисление оксида азота (II) до оксида азота (IV) кислородом воздуха.
3 стадия. Поглощение оксида азота (IV) водой в присутствии избытка кислорода.
Химические свойства
Азотная кислота – это сильная кислота . За счет азота со степенью окисления +5 азотная кислота проявляет сильные окислительные свойства .
1. Азотная кислота практически полностью диссоциирует в водном растворе.
2. Азотная кислота реагирует с основными оксидами, основаниями, амфотерными оксидами и амфотерными гидроксидами .
Например , азотная кислота взаимодействует с оксидом меди (II):
Еще пример : азотная кислота реагирует с гидроксидом натрия:
3. Азотная кислота вытесняет более слабые кислоты из их солей (карбонатов, сульфидов, сульфитов).
Например , азотная кислота взаимодействует с карбонатом натрия:
4. Азотная кислота частично разлагается при кипении или под действием света:
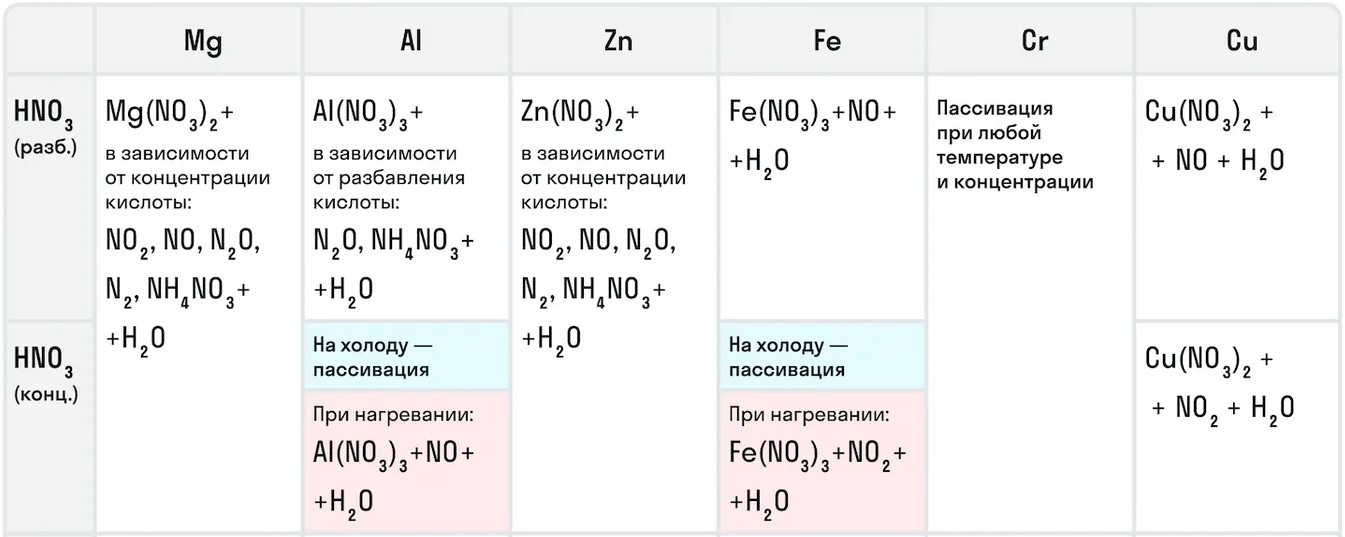
5. Азотная кислота активно взаимодействует с металлами. При этом никогда не выделяется водород! При взаимодействии азотной кислоты с металлами окислителем всегда выступает азот +5. Азот в степени окисления +5 может восстанавливаться до степеней окисления -3, 0, +1, +2 или +4 в зависимости от концентрации кислоты и активности металла.
металл + HNO3 → нитрат металла + вода + газ (или соль аммония)
С алюминием, хромом и железом на холоду концентрированная HNO3 не реагирует – кислота «пассивирует» металлы, т.к. на их поверхности образуется пленка оксидов, непроницаемая для концентрированной азотной кислоты. При нагревании реакция идет. При этом азот восстанавливается до степени окисления +4:
Золото и платина не реагируют с азотной кислотой, но растворяются в «царской водке» – смеси концентрированных азотной и соляной кислот в соотношении 1 : 3 (по объему):
HNO3 + 3HCl + Au → AuCl3 + NO + 2H2O
Концентрированная азотная кислота взаимодействует с неактивными металлами и металлами средней активности (в ряду электрохимической активности после алюминия). При этом образуется оксид азота (IV), азот восстанавливается минимально:
С активными металлами (щелочными и щелочноземельными) концентрированная азотная кислота реагирует с образованием оксида азота (I):
Разбавленная азотная кислота взаимодействует с неактивными металлами и металлами средней активности (в ряду электрохимической активности после алюминия). При этом образуется оксид азота (II).
С активными металлами (щелочными и щелочноземельными), а также оловом и железом разбавленная азотная кислота реагирует с образованием молекулярного азота:
При взаимодействии кальция и магния с азотной кислотой любой концентрации (кроме очень разбавленной) образуется оксид азота (I):
Очень разбавленная азотная кислота реагирует с металлами с образованием нитрата аммония:
Таблица . Взаимодействие азотной кислоты с металлами.
| Азотная кислота | ||||
| Концентрированная | Разбавленная | |||
| с Fe, Al, Cr | с неактивными металлами и металлами средней активности (после Al) | с щелочными и щелочноземельными металлами | с неактивными металлами и металлами средней активности (после Al) | с металлами до Al в ряду активности, Sn, Fe |
| пассивация при низкой Т | образуется NO2 | образуется N2O | образуется NO | образуется N2 |
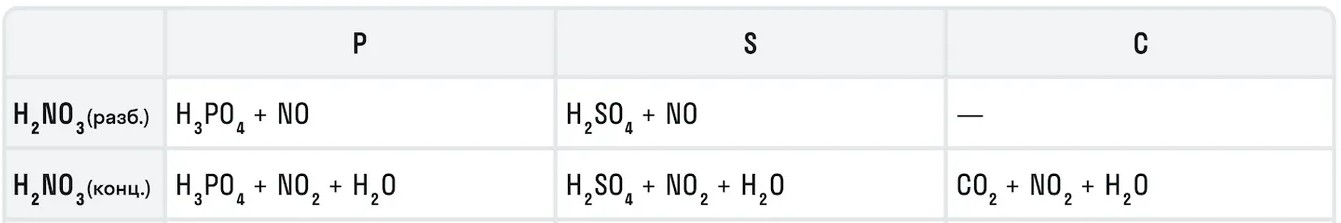
6. Азотная кислота окисляет и неметаллы (кроме кислорода, водорода, хлора, фтора и некоторых других). При взаимодействии с неметаллами HNO3 обычно восстанавливается до NO или NO2, неметаллы окисляются до соответствующих кислот, либо оксидов (если кислота неустойчива).
Например , азотная кислота окисляет серу, фосфор, углерод, йод:
Безводная азотная кислота – сильный окислитель. Поэтому она легко взаимодействует с красным и белым фосфором . Реакция с белым фосфором протекает очень бурно. Иногда она сопровождается взрывом.
Видеоопыт взаимодействия фосфора с безводной азотной кислотой можно посмотреть здесь.
Видеоопыт взаимодействия угля с безводной азотной кислотой можно посмотреть здесь.
7. Концентрированная а зотная кислота окисляет сложные вещества (в которых есть элементы в отрицательной, либо промежуточной степени окисления): сульфиды металлов, сероводород, фосфиды, йодиды, соединения железа (II) и др. При этом азот восстанавливается до NO2, неметаллы окисляются до соответствующих кислот (или оксидов), а металлы окисляются до устойчивых степеней окисления.
Например , азотная кислота окисляет оксид серы (IV):
Еще пример : азотная кислота окисляет йодоводород:
Азотная кислота окисляет углерод до углекислого газа, т.к. угольная кислота неустойчива.
3С + 4HNO3 → 3СО2 + 4NO + 2H2O
Сера в степени окисления -2 окисляется без нагревания до простого вещества, при нагревании до серной кислоты.
Например , сероводород окисляется азотной кислотой без нагревания до молекулярной серы:
При нагревании до серной кислоты:
Соединения железа (II) азотная кислота окисляет до соединений железа (III):
8. Азотная кислота окрашивает белки в оранжево-желтый цвет («ксантопротеиновая реакция»).
Ксантопротеиновую реакцию проводят для обнаружения белков, содержащих в своем составе ароматические аминокислоты. К раствору белка прибавляем концентрированную азотную кислоту. Белок свертывается. При нагревании белок желтеет. При добавлении избытка аммиака окраска переходит в оранжевую.
Видеоопыт обнаружения белков с помощью азотной кислоты можно посмотреть здесь.
Азотистая кислота
Азотистая кислота HNO2 — слабая, одноосновная, химически неустойчивая кислота.
Получение азотистой кислоты.
Азотистую кислоту легко получить вытеснением из нитритов более сильной кислотой.
Например , соляная кислота вытесняет азотистую кислоту из нитрита серебра:
AgNO2 + HCl → HNO2 + AgCl
Химические свойства.
1. Азотистая кислота HNO 2 существует только в разбавленных растворах, при нагревании она разлагается :
без нагревания азотистая кислота также разлагается :
2. Азотистая кислота взаимодействует с сильными основаниями .
Например , с гидроксидом натрия:
3. За счет азота в степени окисления +3 азотистая кислота проявляет слабые окислительные свойства . Окислительные свойства HNO2 проявляет только при взаимодействии с сильными восстановителями.
Например , HNO2 окисляет иодоводород:
2HNO2 + 2HI → 2NO + I2 + 2H2O
Азотистая кислота также окисляет иодиды в кислой среде:
Азотистая кислота окисляет соединения железа (II):
4. За счет азота в степени окисления +3 азотистая кислота проявляет сильные восстановительные свойства . Под действием окислителей азотистая кислота переходит в азотную.
Например , хлор окисляет азотистую кислоту до азотной кислоты:
Кислород и пероксид водорода также окисляют азотистую кислоту:
Соединения марганца (VII) окисляют HNO2:
Соли азотной кислоты — нитраты
Нитраты металлов — это твердые кристаллические вещества. Большинство очень хорошо растворимы в воде.
1. Нитраты термически неустойчивы , причем все они разлагаются на кислород и соединение, характер которого зависит от положения металла (входящего в состав соли) в ряду напряжений металлов:
- Нитраты щелочных и щелочноземельных металлов ( до Mg в электрохимическом ряду ) разлагаются до нитрита и кислорода.
Например , разложение нитрата натрия:
Исключение – литий .
Видеоопыт разложения нитрата калия можно посмотреть здесь.
- Нитраты тяжелых металлов ( от Mg до Cu, включая магний и медь ) и литий разлагаются до оксида металла, оксида азота (IV) и кислорода:
Например , разложение нитрата меди (II):
- Нитраты малоактивных металлов ( правее Cu ) – разлагаются до металла, оксида азота (IV) и кислорода.
Например , нитрат серебра:
Исключения:
Нитрит железа (II) разлагается до оксида железа (III):
Нитрат марганца (II) разлагается до оксида марганца (IV):
2. Водные растворы не обладают окислительно-восстановительными свойствами, расплавы – сильные окислители .
Например , смесь 75% KNO3, 15% C и 10% S называют «черным порохом»:
Соли азотистой кислоты — нитриты
Соли азотистой кислоты устойчивее самой кислоты, и все они ядовиты. Поскольку степень окисления азота в нитритах равна +3, то они проявляют как окислительные свойства, так и восстановительные.
Кислород, галогены и пероксид водорода окисляют нитриты до нитратов:
Лабораторные окислители — перманганаты , дихроматы — также окисляют нитриты до нитратов:
В кислой среде нитриты выступают в качестве окислителей .
При окислении йодидов или соединений железа (II) нитриты восстанавливаются до оксида азота (II):
При взаимодействии с очень сильными восстановителями ( алюминий или цинк в щелочной среде) нитриты восстанавливаются максимально – до аммиака:
Смесь нитратов и нитритов также проявляет окислительные свойства. Например , смесь нитрата и нитрита калия окисляет оксид хрома (III) до хромата калия:
Видео:Химические Цепочки — Решение Цепочек Химических Превращений // Химия 8 классСкачать

Генетическая взаимосвязь неорганических соединений. Азот, аммиак, азотная кислота.
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
Рабочие листы и материалы для учителей и воспитателей
Более 300 дидактических материалов для школьного и домашнего обучения
Карточка № 1. 9 класс.
Генетическая связь между классами соединений.
Азот. Аммиак. Азотная кислота.
Напишите реакции, с помощью которых можно осуществить превращения.
Карточка № 2 . 9 класс.
Генетическая связь между классами соединений.
Азот. Аммиак. Азотная кислота.
Напишите реакции, с помощью которых можно осуществить превращения.
Карточка № 3 . 9 класс.
Генетическая связь между классами соединений.
Азот. Аммиак. Азотная кислота.
Напишите реакции, с помощью которых можно осуществить превращения.
Карточка № 4. 9 класс.
Генетическая связь между классами соединений.
Азот. Аммиак. Азотная кислота.
Напишите реакции, с помощью которых можно осуществить превращения.
Карточка № 5. 9 класс.
Генетическая связь между классами соединений.
Азот. Аммиак. Азотная кислота.
Напишите реакции, с помощью которых можно осуществить превращения.
Карточка № 6 . 9 класс.
Генетическая связь между классами соединений.
Азот. Аммиак. Азотная кислота.
Напишите реакции, с помощью которых можно осуществить превращения.
Карточка № 7 . 9 класс.
Генетическая связь между классами соединений.
Азот. Аммиак. Азотная кислота.
Напишите реакции, с помощью которых можно осуществить превращения.
Карточка № 8 . 9 класс.
Генетическая связь между классами соединений.
Азот. Аммиак. Азотная кислота.
Напишите реакции, с помощью которых можно осуществить превращения.
Карточка № 9 . 9 класс.
Генетическая связь между классами соединений.
Азот. Аммиак. Азотная кислота.
Напишите реакции, с помощью которых можно осуществить превращения.
Карточка № 10 . 9 класс.
Генетическая связь между классами соединений.
Азот. Аммиак. Азотная кислота.
Напишите реакции, с помощью которых можно осуществить превращения.
Карточка № 11 . 9 класс.
Генетическая связь между классами соединений.
Азот. Аммиак. Азотная кислота.
Напишите реакции, с помощью которых можно осуществить превращения.
Карточка № 12. 9 класс.
Генетическая связь между классами соединений.
Азот. Аммиак. Азотная кислота.
Напишите реакции, с помощью которых можно осуществить превращения.
Карточка № 1 3 . 9 класс.
Генетическая связь между классами соединений.
Азот. Аммиак. Азотная кислота.
Напишите реакции, с помощью которых можно осуществить превращения.
Карточка № 1 4 . 9 класс.
Генетическая связь между классами соединений.
Азот. Аммиак. Азотная кислота.
Напишите реакции, с помощью которых можно осуществить превращения.
Карточка № 1 5 . 9 класс.
Генетическая связь между классами соединений.
Азот. Аммиак. Азотная кислота.
Напишите реакции, с помощью которых можно осуществить превращения.
Карточка № 1 6 . 9 класс.
Генетическая связь между классами соединений.
Азот. Аммиак. Азотная кислота.
Напишите реакции, с помощью которых можно осуществить превращения.
Карточка № 1 7 . 9 класс.
Генетическая связь между классами соединений.
Азот. Аммиак. Азотная кислота.
Напишите реакции, с помощью которых можно осуществить превращения.
Карточка № 1 8 . 9 класс.
Генетическая связь между классами соединений.
Азот. Аммиак. Азотная кислота.
Напишите реакции, с помощью которых можно осуществить превращения.
Карточка № 1 9 . 9 класс.
Генетическая связь между классами соединений.
Азот. Аммиак. Азотная кислота.
Напишите реакции, с помощью которых можно осуществить превращения.
Карточка № 2 0 . 9 класс.
Генетическая связь между классами соединений.
Азот. Аммиак. Азотная кислота.
Напишите реакции, с помощью которых можно осуществить превращения.
Краткое описание документа:
Карточка № 1. 9 класс.
Генетическая связь между классами соединений.
Азот. Аммиак. Азотная кислота.
Напишите реакции, с помощью которых можно осуществить превращения.
Карточка № 2 . 9 класс.
Генетическая связь между классами соединений.
Азот. Аммиак. Азотная кислота.
Напишите реакции, с помощью которых можно осуществить превращения.
Карточка № 3 . 9 класс.
Генетическая связь между классами соединений.
Азот. Аммиак. Азотная кислота.
Напишите реакции, с помощью которых можно осуществить превращения.
Карточка № 4. 9 класс.
Генетическая связь между классами соединений.
Азот. Аммиак. Азотная кислота.
Напишите реакции, с помощью которых можно осуществить превращения.
Карточка № 5. 9 класс.
Генетическая связь между классами соединений.
Азот. Аммиак. Азотная кислота.
Напишите реакции, с помощью которых можно осуществить превращения.
Карточка № 6 . 9 класс.
Генетическая связь между классами соединений.
Азот. Аммиак. Азотная кислота.
Напишите реакции, с помощью которых можно осуществить превращения.
Карточка № 7 . 9 класс.
Генетическая связь между классами соединений.
Азот. Аммиак. Азотная кислота.
Напишите реакции, с помощью которых можно осуществить превращения.
Карточка № 8 . 9 класс.
Генетическая связь между классами соединений.
Азот. Аммиак. Азотная кислота.
Напишите реакции, с помощью которых можно осуществить превращения.
Карточка № 9 . 9 класс.
Генетическая связь между классами соединений.
Азот. Аммиак. Азотная кислота.
Напишите реакции, с помощью которых можно осуществить превращения.
Карточка № 10 . 9 класс.
Генетическая связь между классами соединений.
Азот. Аммиак. Азотная кислота.
Напишите реакции, с помощью которых можно осуществить превращения.
Карточка № 11 . 9 класс.
Генетическая связь между классами соединений.
Азот. Аммиак. Азотная кислота.
Напишите реакции, с помощью которых можно осуществить превращения.
Карточка № 12. 9 класс.
Генетическая связь между классами соединений.
Азот. Аммиак. Азотная кислота.
Напишите реакции, с помощью которых можно осуществить превращения.
Карточка № 1 3 . 9 класс.
Генетическая связь между классами соединений.
Азот. Аммиак. Азотная кислота.
Напишите реакции, с помощью которых можно осуществить превращения.
Карточка № 1 4 . 9 класс.
Генетическая связь между классами соединений.
Азот. Аммиак. Азотная кислота.
Напишите реакции, с помощью которых можно осуществить превращения.
Карточка № 1 5 . 9 класс.
Генетическая связь между классами соединений.
Азот. Аммиак. Азотная кислота.
Напишите реакции, с помощью которых можно осуществить превращения.
Карточка № 1 6 . 9 класс.
Генетическая связь между классами соединений.
Азот. Аммиак. Азотная кислота.
Напишите реакции, с помощью которых можно осуществить превращения.
Карточка № 1 7 . 9 класс.
Генетическая связь между классами соединений.
Азот. Аммиак. Азотная кислота.
Напишите реакции, с помощью которых можно осуществить превращения.
Карточка № 1 8 . 9 класс.
Генетическая связь между классами соединений.
Азот. Аммиак. Азотная кислота.
Напишите реакции, с помощью которых можно осуществить превращения.
Карточка № 1 9 . 9 класс.
Генетическая связь между классами соединений.
Азот. Аммиак. Азотная кислота.
Напишите реакции, с помощью которых можно осуществить превращения.
Карточка № 2 0 . 9 класс.
Генетическая связь между классами соединений.
Азот. Аммиак. Азотная кислота.
Напишите реакции, с помощью которых можно осуществить превращения.
Курс повышения квалификации
Дистанционное обучение как современный формат преподавания
- Сейчас обучается 859 человек из 78 регионов
Курс повышения квалификации
Педагогическая деятельность в контексте профессионального стандарта педагога и ФГОС
- Сейчас обучается 49 человек из 21 региона
Курс профессиональной переподготовки
Химия: теория и методика преподавания в образовательной организации
- Сейчас обучается 376 человек из 64 регионов
«Мотивация здорового образа жизни. Организация секций»
Свидетельство и скидка на обучение каждому участнику
- Для всех учеников 1-11 классов
и дошкольников - Интересные задания
по 16 предметам
«Как закрыть гештальт: практики и упражнения»
Свидетельство и скидка на обучение каждому участнику
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Дистанционные курсы для педагогов
Самые массовые международные дистанционные
Школьные Инфоконкурсы 2022
33 конкурса для учеников 1–11 классов и дошкольников от проекта «Инфоурок»
Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
5 842 246 материалов в базе
Ищем педагогов в команду «Инфоурок»
Другие материалы
- 14.06.2017
- 2102
- 2
- 14.06.2017
- 2814
- 6
- 14.06.2017
- 3851
- 11
- 14.06.2017
- 9597
- 238
- 14.06.2017
- 1803
- 45
- 14.06.2017
- 2375
- 3
- 14.06.2017
- 2908
- 40
«Учись, играя: эффективное обучение иностранным языкам дошкольников»
Свидетельство и скидка на обучение
каждому участнику
Вам будут интересны эти курсы:
Оставьте свой комментарий
Авторизуйтесь, чтобы задавать вопросы.
Добавить в избранное
- 14.06.2017 3356
- DOCX 46.5 кбайт
- 29 скачиваний
- Рейтинг: 2 из 5
- Оцените материал:
Настоящий материал опубликован пользователем Микурова Ольга Александровна. Инфоурок является информационным посредником и предоставляет пользователям возможность размещать на сайте методические материалы. Всю ответственность за опубликованные материалы, содержащиеся в них сведения, а также за соблюдение авторских прав несут пользователи, загрузившие материал на сайт
Если Вы считаете, что материал нарушает авторские права либо по каким-то другим причинам должен быть удален с сайта, Вы можете оставить жалобу на материал.
Автор материала
- На сайте: 5 лет и 6 месяцев
- Подписчики: 0
- Всего просмотров: 68442
- Всего материалов: 17
Московский институт профессиональной
переподготовки и повышения
квалификации педагогов
Видео:Химические Цепочки — Решение Цепочек Химических Превращений // Химия 8 классСкачать

Дистанционные курсы
для педагогов
663 курса от 690 рублей
Выбрать курс со скидкой
Выдаём документы
установленного образца!
Учителя о ЕГЭ: секреты успешной подготовки
Время чтения: 11 минут
Минпросвещения рекомендует школьникам сдавать телефоны перед входом в школу
Время чтения: 1 минута
Минпросвещения проведет Всероссийский конкурс для органов опеки и попечительства
Время чтения: 1 минута
Госдума рассматривает проект о регулировании «продленок» в школах
Время чтения: 1 минута
Онлайн-конференция о профессиональном имидже педагога
Время чтения: 2 минуты
Российские школьники начнут изучать историю с первого класса
Время чтения: 1 минута
С 1 сентября в российских школах будут исполнять гимн России
Время чтения: 1 минута
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.
Видео:Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать

Генетическая связь между азотом и его важнейшими соединениями уравнения реакций
О чем эта статья:
11 класс, ЕГЭ/ОГЭ
Азот (N2) — первый представитель V группы главной подгруппы и 2 периода периодической системы химических элементов Д. И. Менделеева. Если рассматривать местоположение азота в длиннопериодной таблице Менделеева, то там он занимает лидирующее место в 15 группе. Для представителей этой группы было предложено название пниктогены (от греческого корня πνῑ́γω — удушливый, плохо пахнущий). Явно это относится к водородным соединениям представителей данной группы.
Видео:Как решать ОРГАНИЧЕСКИЕ ЦЕПОЧКИ? Основные типы химических реакцийСкачать

Электронное строение азота
Рассмотрим строение атома и электронную конфигурацию азота, а затем сделаем некоторые заключения.
Атомный или порядковый номер азота равен 7, что соответствует количеству электронов и протонов в ядре. Молярная масса равна 14,00728 г/моль, а количество нейтронов в атоме этого изотопа равно семи.
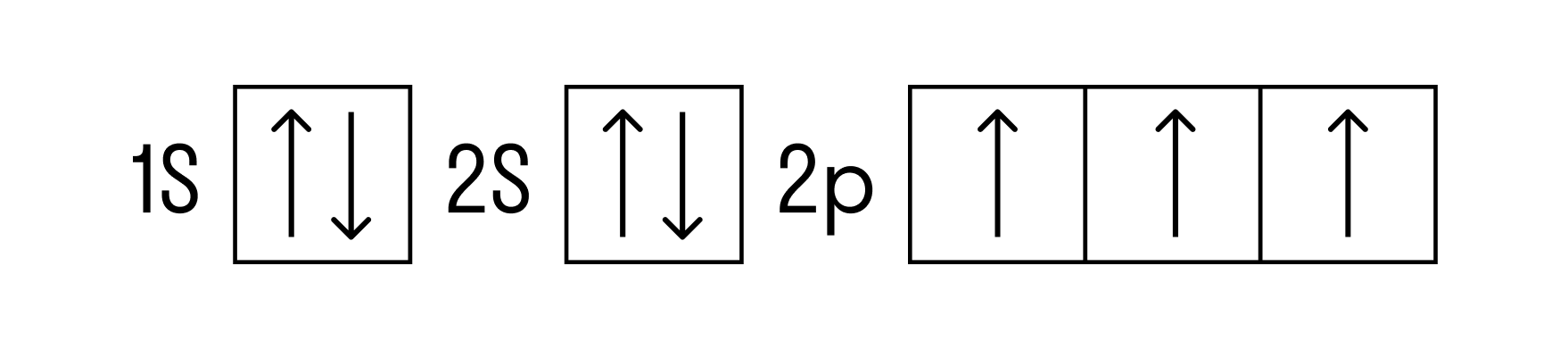
Теперь перейдем к электронному строению. В основном состоянии электронная формула азота: 1s 2 2s 2 2p 3 , в сокращенном виде — [He]2s 2 2p 3 . На внешнем энергетическом уровне 5 валентных электронов, среди которых 3 неспаренных p-электрона.
Исходя из такой конфигурации, азот может образовывать только 3 связи по обменному механизму и еще одну по донорно-акцепторному механизму. Это связано с тем, что на втором подуровне у азота больше нет вакантных орбиталей, куда могли бы распариться электроны с 2s-подуровня. Отсюда вытекает максимальная валентность азота IV.
Для азота характерен весь спектр возможных степеней окисления от −3 до +5.
Давайте рассмотрим шкалу, где отражены соединения азота в различных веществах.
Видео:Генетическая связь между классами неорганических веществ. Химия 8 классСкачать

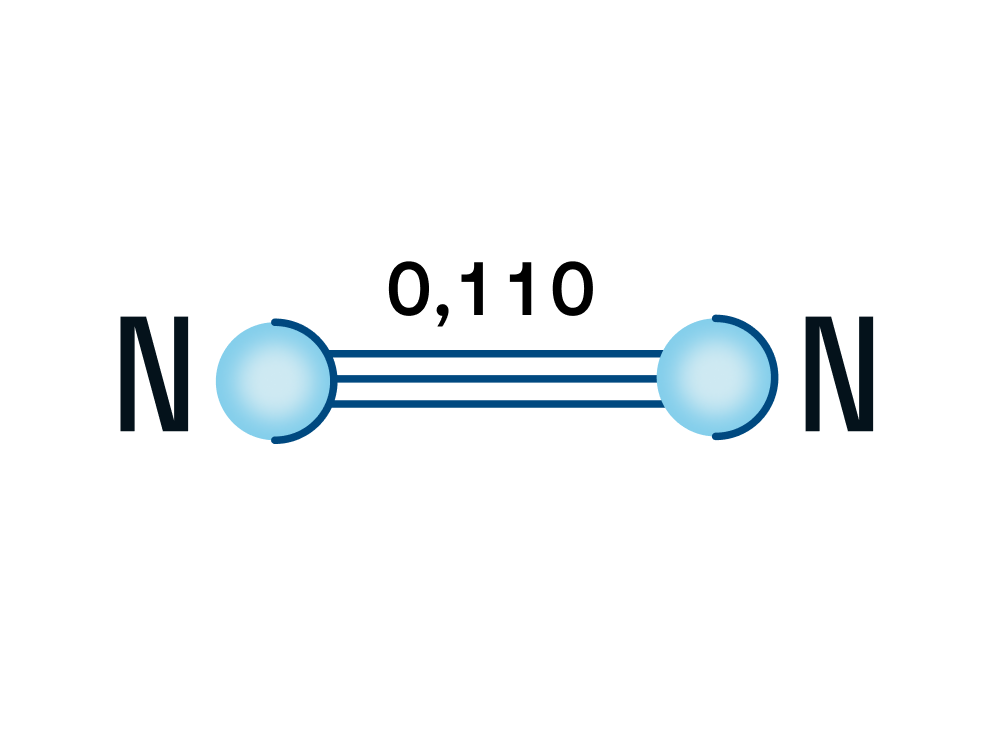
Строение молекулы азота
Азот — двухатомная молекула, атомы которой связаны между собой прочной тройной связью. Длина связи — 0,110 нм.
Почему именно тройная связь и из чего она состоит?
Напомним, что у каждого атома в молекуле азота 3 неспаренных электрона, которые и образуют впоследствии тройную связь, которая, в свою очередь, состоит из одной сигма-связи и двух пи-связей.
Видео:Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Физические свойства азота
Азот как простое вещество — бесцветный газ, который не имеет запаха и плохо растворяется в воде. По своей молярной массе азот легче, чем воздух. Благодаря наличию тройной неполярной связи и относительно маленьким радиусам атомов азот имеет низкие температуры кипения и плавления: tпл = −210 °С и tкип = −196 °С. Аллотропных модификаций азот не имеет. Несмотря на то, что основное состояние азота — газообразное, он бывает еще и жидким. Например, 1 литр жидкого азота при нагревании до 20 °С превращается в 700 литров газообразного азота. Более подробную информацию можно узнать в нашем видео:
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Химические свойства азота
Азот химически малоактивен из-за наличия все той же тройной связи. Она же обуславливает малую термическую устойчивость соединений азота при нагревании. В химических реакциях азот может проявлять себя и как окислитель, и как восстановитель благодаря широкому спектру возможных степеней окисления.
Как восстановитель азот реагирует:
Эти реакции проходят при температуре выше 1000 градусов Цельсия либо в электрическом заряде.
Как окислитель азот реагирует:
азот реагирует при обычных условиях только с литием, а с щелочноземельными металлами — только при нагревании;
реакция протекает обратимо в присутствии металлического железа в качестве катализатора.
Рассмотрим способы получения азота. В промышленности его получают фракционной перегонкой жидкого воздуха, а вот в лаборатории азот получают иначе. Вот лишь некоторые способы:
реакция взаимодействия хлорида аммония и нитрита натрия
NaNO2 + NH4Cl = N2 + NaCl + 2H2O
разложение некоторых солей аммония (на примере нитрита аммония)
NH4NO2 = N2 + 2H2O
Азот — основной компонент любого белка в организме человека. Давайте рассмотрим способы получения исходных компонентов для синтеза собственных белков.
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Важнейшие соединения азота
Аммиак
В первую очередь поговорим о водородном соединении азота — аммиаке. Аммиак — бесцветный газ с характерным резким запахом. Давайте рассмотрим строение молекулы аммиака:
Аммиак имеет форму тригональной пирамиды. Этот газ очень ядовит и способен вызывать химический ожог глаз, а пары сильно раздражают слизистые оболочки органов дыхания. В то же время аммиак обладает достаточно высокой растворимостью в воде из-за образования водородных связей с молекулами воды. Вас когда-нибудь приводили в чувства после потери сознания ваткой, смоченной чем-то гадко пахнущим? Поздравляю, это было ваше первое знакомство с раствором аммиака в воде.
Поговорим теперь о химических свойствах этого газа.
В отличие от самого азота, аммиак является крайне реакционноспособным соединением. Так как азот находится в аммиаке в своей низшей степени окисления (−3), то аммиак проявляет только восстановительные свойства.
Например, аммиак реагирует с кислородом (при нагревании):
Как видно из уравнений, аммиак вступает в реакции окисления, а продукты его окисления напрямую зависят от силы окислителя и условий проведения реакций.
Со сложными веществами — окислителями аммиак реагирует следующим образом:
С кислотами аммиак реагирует благодаря своим оснóвным свойствам, что приводит к образованию различных солей:
А теперь рассмотрим получение аммиака. Различают два типа способов: промышленный и лабораторный.
Промышленный способ — синтез из простых веществ:
В данном способе аммиак собирают в перевернутую вверх дном колбу, так как аммиак легче воздуха.
Азотная кислота
Азотная кислота — одна из важнейших неорганических кислот. Это летучая бесцветная жидкость с резким запахом, которая способна смешиваться с водой в любых пропорциях.
Получают ее в промышленности в несколько этапов. Рассмотрим подробнее каждый из них:
Окисление аммиака кислородом воздуха на платиновом катализаторе
4NH3 + 5O2 = 4NO + 6H2O
Окисление оксида азота (II)
2NO + O2 = 2NO2
Поглощение образующегося оксида азота (IV) водой в избытке воздуха
4NO2 + O2 + 2H2O = 4HNO3
Для азотной кислоты характерны особые химические свойства исходя из ее концентрации.
Например, с металлами данная кислота никогда не будет реагировать с выделением газообразного водорода. Рассмотрим таблицу с примерами металлов с различными концентрациями азотной кислоты:
Также азотная кислота как сильный окислитель способна окислять некоторые неметаллы до их кислот. Давайте рассмотрим примеры:
Азотная кислота в соотношении 1:3 с соляной кислотой образуют смесь под названием царская водка. Это желтовато-оранжевая дымящаяся жидкость, которая получила свое название от алхимиков благодаря способности растворять «царские» металлы — золото и платину.
Оксиды азота
В отличие от других химических элементов, азот образует большое число оксидов: N2O, NO, N2O3, NO2, N2O4 и N2O5, каждый из которых является кислотным. В таблице показали, какой оксид какой кислоте соответствует:
Оксид азота (I) N2O. Несолеобразующий оксид, представляет собой бесцветный газ с приятным запахом и сладковатым привкусом. По своей молярной массе тяжелее воздуха и растворим в воде. У этого оксида есть и другие названия, самое распространенное из них — закись азота. Оксид азота (I) применяли в медицине в качестве наркоза более 200 лет назад. При вдыхании этого газа человека охватывает радость и безудержный смех, отчего оксид получил еще одно название — веселящий газ.
Оксид азота (II) NO. Несолеобразующий оксид, который при нормальный условиях является бесцветным газом, плохо растворяется в воде и в больших концентрациях ядовит для человека.
Оксид азота (III) N2O3. Соединение очень неустойчивое и существует только при низких температурах. В твердом и жидком состоянии оксид азота (III) окрашен в ярко-синий цвет. При температуре выше 0 градусов разлагается до оксида азота (II) и оксида азота (IV).
Оксиды азота (IV) NO2 и N2O4. Твердый оксид азота (IV) бесцветный, так как состоит из молекул N2O4. При нагревании появляется коричневая окраска, которая усиливается с повышением температуры по мере увеличения NO2 в смеси. Эти оксиды хорошо растворимы в воде и взаимодействуют с ней.
Оксид азота (V) N2O5. Азотный ангидрид, который образуется в виде летучих бесцветных гигроскопичных кристаллов. Это крайне неустойчивое вещество, которое распадается в течение нескольких часов. При нагревании распадается со взрывом на оксид азота (IV) и газообразный кислород.
Видео:Решение цепочек превращений по химииСкачать

Вопросы для самопроверки
Какую связь образуют между собой атомы азота?
🎥 Видео
РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

8 класс. Цепочки превращений. Генетические ряды.Скачать

Генетическая связь между классами неорганических веществ. Видеоурок по химии 8 классСкачать

Решение задач на термохимические уравнения. 8 класс.Скачать

Типы химических реакций. 1 часть. 8 класс.Скачать

Типы Химических Связей — Как определять Вид Химической Связи? Химия 9 классСкачать

Проклятая химическая реакция 😜 #shortsСкачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

8 КЛАСС | Как решать ЦЕПОЧКИ ХИМИЧЕСКИХ РЕАКЦИЙ | Цепочки превращенийСкачать

8 класс. Химия. Генетическая связь между классами неорганических соединенийСкачать