Видео:Гашение извести (реакция оксида кальция с водой)Скачать

1) Исходя из уравнения реакции:
CaO + H2O = Ca (OH) 2 + 66M5 кДж; вычислите, сколько теплоты выделится при гашении водой 1 кг оксида кальция?
2) исходя из уравнения реакции: 2H2 + O2 = 2H2O + 572 кДж, вычислите, сколько теплоты выделится при сжигании 896 л водорода?
3) Термохимическое уравнение реакции горения метана:
CH4+2O2 = CO2 + 2H2O + 878 кДж
Сколько теплоты выделится если сжечь метан объемом 4.48 л (н. у.) ? Какой объем метана нужно сжечь, чтобы получить 4390 кДж теплоты?
Видео:СКОЛЬКО ВОДЫ для ГАШЕНИЯ ИЗВЕСТИСкачать

Примеры решения типовых задач по теме.
Пример 1.Реакция окисления глюкозы в организме может протекать так:
Какое количество теплоты выделится при окислении 800 г глюкозы?
ν(С6Н12О6) = 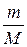
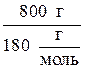
Пример 2. Вычислить тепловой эффект реакции получения гидроксида кальция из оксида кальция и воды, если стандартная энтальпия образования оксида кальция равна -635,7 кДж/моль, стандартная энтальпия образования воды равна -285,8 кДж/моль, а стандартная энтальпия образования гидроксида кальция равна -986,8 кДж/моль.
Уравнение реакции получения негашеной извести из гашеной извести имеет вид:
На основании первого следствия из закона Гесса:
ΔH 0 = ΔH 0 Ca(OH)2 – (Δ H 0 CaO + ΔH 0 H2O ) =
–986,8 – (– 635,7 – 285,8) = – 65,3 кДж/моль.
Ответ. При реакции гашения извести выделяется 65,3кДж теплоты.
Пример 3. Определите возможность самопроизвольного разложения известняка при стандартных условиях, протекающего по уравнению:
| CO2 | CaO | CaCO3 | |
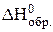 , кДж/моль , кДж/моль | -394 | -636 | -1207 |
| S 0 , Дж/(моль×K) |
Рассчитайте минимальную температуру, при которой данная реакция будет возможной.
Дата добавления: 2015-04-07 ; просмотров: 1178 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Видео:Взаимодействие углекислого газа с известковой водой (CO2 + Ca(OH)2 = CaCO3 + H2O)Скачать

Гашение извести описывается уравнением cao h2o ca oh 2
Курс общей и неорганической химии
(для студентов биологического факультета (биофизиков)
и для студентов факультета биоинженерии и биоинформатики)
Программа курса. Материалы лекций. Презентации лекций. Программа сетевых контрольных мероприятий
Лектор — Загорский Вячеслав Викторович — ст.н.сотр., к.х.н., д.п.н.
Видео:Получение осадка гидроксида магния | Mg2+ + 2OH- = Mg(OH)2Скачать

Гашение извести
(реакция оксида кальция с водой)
Посмотреть видео:
Гашение извести — реакция взаимодействия оксида кальция [CaO] с водой [H 2 O]. Типичная реакция между основным оксидом щелочноземельного металла и воды. Продукт реакции — соответствующая щелочь. В данном случае гидроксид кальция [Ca(OH) 2 ].
В фарфоровую чашку поместили заранее приготовленную прокаливанием мела негашеную известь. При помощи пипетки прикапали в чашку несколько капель воды. В ходе реакции образовался рыхлый гидроксид кальция [Ca(OH) 2 ].
Автор и оператор
Загорский В.В.
Ассистент
Петрова Е.П.
Подготовка публикации
Мочалыгин А.Г.
Редактирование
Миняйлов В.В.


Сервер создается при поддержке Российского фонда фундаментальных исследований
Не разрешается копирование материалов и размещение на других Web-сайтах
Вебдизайн: Copyright (C) И. Миняйлова и В. Миняйлов
Copyright (C) Химический факультет МГУ
Написать письмо редактору
🔍 Видео
Гашение извести - правила безопасностиСкачать

Взаимодействие углекислого газа с водой (CO2 + H2O = H2CO3)Скачать

Решение задач по теме "Растворы" | Химия ЕГЭ, ЦТСкачать

Тепловое излучение и закон смещения ВинаСкачать

Правильные коммунальные расчеты. Холодная и горячая водаСкачать
89 НЕ ЗНАЮТ этого в Физике: Что такое Количество Теплоты, Теплоемкость, Уравнение Теплового БалансаСкачать

Лабораторная работа №10. Изучение свойств раствора хлороводородной кислоты. 9 класс.Скачать

Решение задач на концентрации растворовСкачать

Расчёт количества теплоты. Видеоурок по физике 8 классСкачать

Уловка СО2: как очистить атмосферу от углекислого газа?Скачать

Теплосети, как тепло передают от ТЭЦ потребителямСкачать

Применение тест-полосок для определения концентрации рабочих растворовСкачать

Химия 9 класс (Урок№10 - Галогены. Хлор. Хлороводород. Соляная кислота и её соли.)Скачать

Физика 10 класс (Урок№23 - Внутренняя энергия. Работа. Количество теплоты.)Скачать

Решение задач на приготовление и смешивание растворов | ХимияСкачать

Константа кислотности (Ка) и рН для слабых кислот pH=1/2(lgKa-lg[HA])Скачать
![Константа кислотности (Ка) и рН для слабых кислот pH=1/2(lgKa-lg[HA])](https://i.ytimg.com/vi/joRCWgvvlXs/0.jpg)
