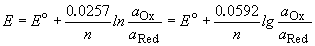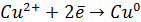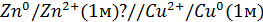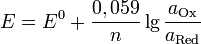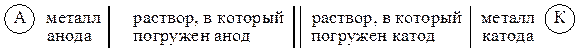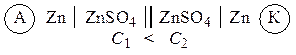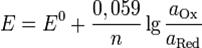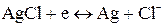ФИЗИЧЕСКАЯ И КОЛЛОИДНАЯ ХИМИЯ
Конспект лекций для студентов биофака ЮФУ (РГУ)
3.5 ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ
3.5.1 Электрические потенциалы на фазовых границах
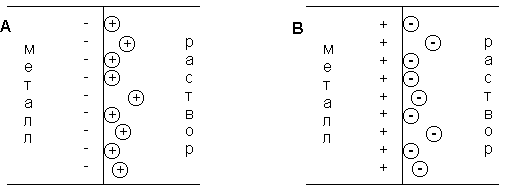
При соприкосновении проводника первого рода (электрода) с полярным растворителем (водой) либо раствором электролита на границе электрод – жидкость возникает т.н. двойной электрический слой (ДЭС). В качестве примера рассмотрим медный электрод, погруженный в воду либо в раствор сульфата меди.
При погружении медного электрода в воду часть ионов меди, находящихся в узлах кристаллической решетки, в результате взаимодействия с диполями воды будет переходить в раствор. Возникающий при этом на электроде отрицательный заряд будет удерживать перешедшие в раствор ионы в приэлектродном пространстве – образуется двойной электрический слой (рис. 3.12а; о моделях строения ДЭС смотрите п. 4.2.4). Отрицательный заряд на электроде будет препятствовать дальнейшему переходу ионов меди в раствор, и через некоторое время установится динамическое равновесие, которое можно однозначно охарактеризовать потенциалом электрического поля ДЭС Φ, зависящего от заряда на электроде, или некоторой равновесной концентрацией ионов в приэлектродном слое Сo. При погружении медного электрода в раствор СuSО4, содержащий ионы меди в концентрации С возможны три случая:
Рис. 3.12 Схема двойного электрического слоя на границе электрод-раствор
1. С Сo. Поскольку концентрация ионов меди в поверхностном слое больше равновесной, начнется переход ионов из раствора в электрод; на электроде возникает положительный заряд и в поверхностном слое преобладают анионы SО4 2- (рис. 3.12b).
3. С = Сo. Поскольку концентрация ионов меди в поверхностном слое равна равновесной (такие растворы называют нулевыми), заряд на электроде не возникает, двойной электрический слой не образуется.
3.5.2 Гальванический элемент. ЭДС гальванического элемента
Рассмотрим простейший гальванический элемент Даниэля – Якоби, состоящий из двух полуэлементов – цинковой и медной пластин, помещенных в растворы сульфатов цинка и меди соответственно, которые соединены между собой посредством электролитического ключа – например, полоски бумаги, смоченной раствором какого-либо электролита. Схематически данный элемент изображается следующим образом:
Zn / Zn 2+ // Cu 2+ / Cu
На поверхности каждого из электродов имеет место динамическое равновесие перехода ионов металла из электрода в раствор и обратно, характеризуемое потенциалом ДЭС (зарядом на электроде q). Если соединить медный и цинковый электроды металлическим проводником, немедленно произойдет перераспределение зарядов – электроны начнут перемещаться с электрода с более отрицательным зарядом (в нашем случае – цинкового) на электрод с более положительным зарядом (медный), т.е. в проводнике возникнет электрический ток. Изменение величины заряда каждого из электродов нарушает равновесие – на цинковом электроде начнется процесс перехода ионов из электрода в раствор (окисление металла), на медном – из раствора в электрод (восстановление металла); при этом протекание процесса на одном электроде обусловливает одновременное протекание противоположного процесса на другом:
Электрод, на котором при работе гальванического элемента протекает процесс окисления, называется анодом , электрод, на котором идет процесс восстановления – катодом . При схематическом изображении гальванических элементов слева записывают анод, справа – катод (стандартный водородный электрод всегда записывают слева). Суммарный окислительно-восстановительный процесс, происходящий в гальваническом элементе, выражается следующим уравнением:
Т.о., гальванический элемент можно определить как прибор для преобразования химической энергии окислительно-восстановительной реакции в электрическую за счет пространственного разделения процессов окисления и восстановления. Работа, которую может совершить электрический ток, вырабатываемый гальваническим элементом, определяется разностью электрических потенциалов между электродами (называемой обычно просто разностью потенциалов) ΔΦ и количеством прошедшего по цепи электричества q:
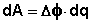
Работа тока гальванического элемента (и, следовательно, разность потенциалов), будет максимальна при его обратимой работе, когда процессы на электродах протекают бесконечно медленно и сила тока в цепи бесконечно мала. Максимальная разность потенциалов, возникающая при обратимой работе гальванического элемента, есть электродвижущая сила (ЭДС) гальванического элемента .
3.5.3 Электродный потенциал. Уравнение Нернста
ЭДС гальванического элемента E удобно представлять в виде разности некоторых величин, характеризующих каждый из электродов – электродных потенциалов; однако для точного определения этих величин необходима точка отсчета – точно известный электродный потенциал какого-либо электрода. Электродным потенциалом электрода ε э называется ЭДС элемента, составленного из данного электрода и стандартного водородного электрода (см. ниже), электродный потенциал которого принят равным нулю. При этом знак электродного потенциала считают положительным, если в таком гальваническом элементе испытуемый электрод является катодом, и отрицательным, если испытуемый электрод является анодом. Необходимо отметить, что иногда электродный потенциал определяют как «разность потенциалов на границе электрод – раствор», т.е. считают его тождественным потенциалу ДЭС, что не вполне правильно (хотя эти величины взаимосвязаны).
Величина электродного потенциала металлического электрода зависит от температуры и активности (концентрации) иона металла в растворе, в который опущен электрод; математически эта зависимость выражается уравнением Нернста (здесь F – постоянная Фарадея, z – заряд иона):
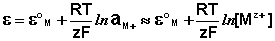
В уравнении Нернста ε ° – стандартный электродный потенциал , равный потенциалу электрода при активности иона металла, равной 1 моль/л. Стандартные электродные потенциалы электродов в водных растворах составляют ряд напряжений. Величина ε ° есть мера способности окисленной формы элемента или иона принимать электроны, т.е. восстанавливаться. Иногда различием между концентрацией и активностью иона в растворе пренебрегают, и в уравнении Нернста под знаком логарифма фигурирует концентрация ионов в растворе. Величина электродного потенциала определяет направление процесса, протекающего на электроде при работе гальванического элемента. На полуэлементе, электродный потенциал которого имеет большее (иногда говорят – более положительное) значение, будет протекать процесс восстановления, т.е. данный электрод будет являться катодом.
Рассмотрим расчёт ЭДС элемента Даниэля – Якоби с помощью уравнения Нернста. ЭДС всегда является положительной величиной и равна разности электродных потенциалов катода и анода:
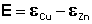
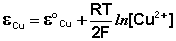
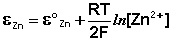
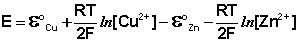
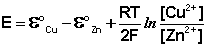
Как видно из уравнения (III.45), ЭДС элемента Даниэля – Якоби зависит от концентрации (точнее говоря, активности) ионов меди и цинка; при их равных концентрациях ЭДС элемента будет равна разности стандартных электродных потенциалов:
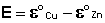
Анализируя уравнение (III.45), можно определить предел необратимой работы гальванического элемента. Поскольку на аноде идет процесс окисления цинка, концентрация ионов цинка при необратимой работе гальванического элемента постоянно увеличивается; концентрация ионов меди, напротив, уменьшается. Отношение концентраций ионов меди и цинка постоянно уменьшается и логарифм этого отношения при [Сu 2+ ] 2+ ] становится отрицательным. Т.о., разность потенциалов при необратимой работе гальванического элемента непрерывно уменьшается; при E = 0 (т.е. ε к = ε а) гальванический элемент не может совершать работу (необратимая работа гальванического элемента может прекратиться также и в результате полного растворения цинкового анода).
Уравнение (III.45) объясняет также и работоспособность т.н. концентрационных цепей – гальванических элементов, состоящих из двух одинаковых металлических электродов, опущенных в растворы соли этого металла с различными активностями а1 > а2. Катодом в этом случае будет являться электрод с большей концентрацией, т.к. стандартные электродные потенциалы обоих электродов равны; для ЭДС концентрационного гальванического элемента получаем:
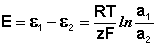
Единственным результатом работы концентрационного элемента является перенос ионов металла из более концентрированного раствора в менее концентрированный. Т.о., работа электрического тока в концентрационном гальваническом элементе – это работа диффузионного процесса, который проводится обратимо в результате пространственного разделения его на два противоположных по направлению обратимых электродных процесса.
Copyright © С. И. Левченков, 1996 — 2005.
Видео:Разбор схемы гальванического элементаСкачать

Гальванический элемент якоби даниэля уравнения процессов протекающих на электродах тор расчет эдс
Для гальванического элемента принята следующая форма записи (на примере элемента Даниэля):
где вертикальная линия | обозначает границу раздела фаз, а двойная вертикальная линия || — солевой мостик. Электрод, на котором происходит окисление, называется анодом; электрод, на котором происходит восстановление, называется катодом. Гальванический элемент принято записывать так, чтобы анод находился слева.
Электродные полуреакции принято записывать как реакции восстановления (таблица 12.1), поэтому общая реакция в гальваническом элементе записывается как разность между реакциями на правом и левом электродах:
Правый электрод: Cu 2+ + 2e = Cu
Левый электрод: Zn 2+ + 2e = Zn
Общая реакция: Cu 2+ + Zn = Cu + Zn 2+
Потенциал E электрода рассчитывается по формуле Нернста:
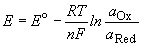
где aOx и aRed — активности окисленной и восстановленной форм вещества, участвующего в полуреакции; E o — стандартный потенциал электрода (при aOx = aRed =1); n — число электронов, участвующих в полуреакции; R — газовая постоянная; T — абсолютная температура; F — постоянная Фарадея. При 25 o C
Стандартные электродные потенциалы электродов измеряются относительно стандартного водородного электрода, потенциал которого принят равным нулю. Значения некоторых стандартных электродных потенциалов приведены в таблице 12.1.
Электродвижущая сила (ЭДС) элемента равна разности потенциалов правого и левого электродов:
Если ЭДС элемента положительна, то реакция (так, как она записана в элементе) протекает самопроизвольно. Если ЭДС отрицательна, то самопроизвольно протекает обратная реакция.
Стандартная ЭДС равна разности стандартных потенциалов:
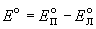
Для элемента Даниэля стандартная ЭДС равна
E o = E o (Cu 2+ /Cu) — E o (Zn 2+ /Zn) = +0.337 — (-0.763) = +1.100 В.
ЭДС элемента связана с 

Зная стандартную ЭДС, можно рассчитать константу равновесия протекающей в элементе реакции:
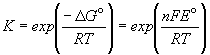
Константа равновесия реакции, протекающей в элементе Даниэля, равна
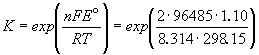
Зная температурный коэффициент ЭДС 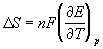




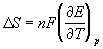
Таблица 12.1. Стандартные электродные потенциалы при 25 o С.
Электрод
Электродная реакция
E o , В
PbSO4 + 2H2O
Пример 12-1. Рассчитать стандартный электродный потенциал пары Cu 2+ /Cu + по данным таблицы 11.1 для пар Cu 2+ /Cu и Cu + /Cu.
Cu 2+ + 2e = Cu 
Cu + + e = Cu 
Cu 2+ + e = Cu + 
откуда E o = +0.153 В.
Пример 12-2. Составить схему гальванического элемента, в котором протекает реакция
Рассчитать стандартную ЭДС элемента при 25 o C, 
Ag | AgBr| Br — || Ag + | Ag
Правый электрод: Ag + + e = Ag E o = 0.7792 В
Левый электрод: AgBr + e = Ag + Br — E o = 0.0732 В
Общая реакция: Ag + + Br — = AgBr E o = 0.7260 В

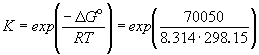
1/K= a(Ag + ) . a(Br — ) = m(Ag + ) . m(Br — ) . ( 



Отсюда, полагая 

Пример 12-3. 




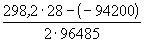
Ответ. 
12-1. Рассчитать стандартный электродный потенциал пары Fe 3+ /Fe по данным таблицы 12.1 для пар Fe 2+ /Fe и Fe 3+ /Fe 2+ . (ответ)
12-2. Рассчитать произведение растворимости и растворимость AgCl в воде при 25 o C по данным таблицы 12.1. (ответ)
12-3. Рассчитать произведение растворимости и растворимость Hg2Cl2 в воде при 25 o C по данным о стандартных электродных потенциалах. (ответ)
12-4. Рассчитать константу равновесия реакции диспропорционирования 2Cu + 
12-5. Рассчитать константу равновесия реакции ZnSO4 + Cd = CdSO4 + Zn при 25 o C по данным о стандартных электродных потенциалах. (ответ)
12-6. ЭДС элемента, в котором обратимо протекает реакция 0.5 Hg2Cl2 + Ag = AgCl + Hg, равна 0.456 В при 298 К и 0.439 В при 293 К. Рассчитать 


12-7. Вычислить тепловой эффект реакции Zn + 2AgCl = ZnCl2 + 2Ag, протекающей в гальваническом элементе при 273 К, если ЭДС элемента E= 1.015 В и температурный коэффициент ЭДС = — 4.02 . 10 -4 В . K -1 . (ответ)
12-8. В гальваническом элементе при температуре 298 К обратимо протекает реакция Cd + 2AgCl = CdCl2 + 2Ag. Рассчитать изменение энтропии реакции, если стандартная ЭДС элемента E o = 0.6753 В, а стандартные энтальпии образования CdCl2 и AgCl равны -389.7 и -126.9 кДж . моль -1 соответственно. (ответ)
12-9. ЭДС элемента Pt | H2 | HCl | AgCl | Ag при 25 o C равна 0.322 В. Чему равен pH раствора HCl . (ответ)
12-10. Растворимость Cu3(PO4)2 в воде при 25 o C равна 1.6 . 10 -8 моль . кг -1 . Рассчитать ЭДС элемента Pt | H2 | HCl (pH = 0) | Cu3(PO4)2 (насыщ. р-р) | Cu при 25 o C. (ответ)
12-11. Три гальванических элемента имеют стандартную ЭДС соответственно 0.01, 0.1 и 1.0 В при 25 o C. Рассчитать константы равновесия реакций, протекающих в этих элементах, если количество электронов для каждой реакции n = 1. (ответ)
12-12. ЭДС элемента Pt | H2 | HBr | AgBr | Ag в широком интервале температур описывается уравнением: E o (В) = 0.07131 — 4.99 . 10 -4 (T — 298) — 3.45 . 10 -6 (T — 298) 2 . Рассчитать 


12-13. Для измерения pH раствора можно применять хингидронный электрод. (Хингидрон, Q . QH2, представляет собой комплекс хинона, Q = C6H4O2, и гидрохинона, QH2 = C6H4O2H2). Электродная полуреакция записывается как Q + 2H + + 2e 
12-14. В гальваническом элементе обратимо протекает реакция CuSO4 + Zn = ZnSO4 + Cu. Рассчитать 

12-15. В элементе Вестона протекает реакция Cd + Hg2SO4 = Cd 2+ + 2Hg. Рассчитать ЭДС этого элемента при 303 K, если 

12-16. 


Сервер создается при поддержке Российского фонда фундаментальных исследований
Не разрешается копирование материалов и размещение на других Web-сайтах
Вебдизайн: Copyright (C) И. Миняйлова и В. Миняйлов
Copyright (C) Химический факультет МГУ
Написать письмо редактору
Видео:Электрохимия. Гальванический элемент Даниэля-ЯкобиСкачать

Элемент Даниэля-Якоби. Приведите уравнение реакции, протекающей в данном элементе. Уравнение Нернста, связь ЭДС с концентрациями потенциалопределяющих ионов.
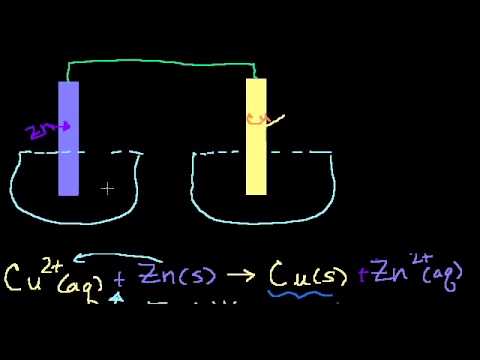
Гальванический элемент — химический источник электрического тока, основанный на взаимодействии двух металлов и (или) их оксидов в электролите, приводящем к возникновению в замкнутой цепи электрического тока. Способен преобразовать энергию химической реакции в электрическую. Рассмотрим устройство и принцип работы гальванического элемента Даниэля-Якоби. Он состоит из корпуса 1 (рис. 22), разделенного на две части пористой перегородкой 2. В каждую из частей помещаются электроды: медный 3 и цинковый 4. Медный электрод погружается в раствор сульфата меди, цинковый – в раствор сульфата цинка. Пористая перегородка предотвращает смешивание соприкасающихся растворов и пространственно разделяет окислительно-восстановительную реакцию, протекающую при замкнутой внешней цепи: окисление цинка и восстановление меди.
2ē переходят по цепи.
Итак, при работе элемента Даниэля-Якоби протекают процессы:
Восстановление ионов меди:
Процессы восстановления называют в электрохимии катодными, а электроды, на которых идут процессы восстановления – катодами.
Уравнение Нернста — уравнение, связывающее окислительно-восстановительный потенциал системы с активностями веществ, входящих в электрохимическое уравнение, и стандартными электродными потенциалами окислительно-восстановительных пар.
Вывод уравнения Нернста
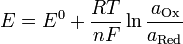
§ 
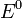
§ 
§ 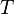
§ 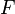
§ 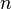
§ 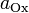
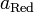
Если в формулу Нернста подставить числовые значения констант 
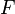

Химические гальванические элементы, понятие и примеры. Зависимость ЭДС от активностей участников электрохимической реакции, протекающей в гальваническом элементе. Вывод и анализ уравнения Нернста
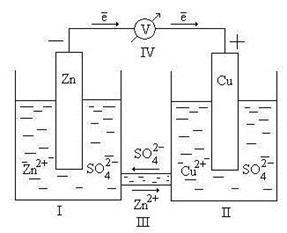
Гальванический элемент – это химический источник тока, в котором энергия, выделяющаяся при протекании на электродах окислительно-восстановительной реакции, непосредственно преобразуется в электрическую энергию. Принцип работы гальванического элемента можно рассмотреть на примере Даниэля Якоби (рис 9.2).
Рис. 9.2. Схема гальванического элемента Даниэля – Якоби
Здесь I – стакан, содержащий раствор ZnSO4 в воде с погруженной в него цинковой пластинкой; II – стакан, содержащий раствор CuSO4 в воде с погруженной в него медной пластинкой; III – солевой мостик (электролитический ключ), который обеспечивает перемещение катионов и анионов между растворами; IV – вольтметр (нужен для измерения ЭДС, но в состав гальванического элемента не входит).
Стандартный электродный потенциал цинкового электрода 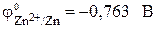
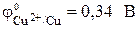

| Zn – 2? = Zn 2+ . | (а) |
Электрод, на котором идет реакция окисления или который посылает катионы в электролит, называется анодом. У рассматриваемого гальванического элемента в роли анода выступает цинковый электрод. Так как стандартный электродный потенциал цинка ниже, чем у меди, цинковому электроду приписывается условный заряд «–», а медному – «+».
Электроны, освободившиеся в результате окисления, по внешней цепи переходят на медь (возникает электрический ток).
На медном электроде происходит процесс восстановления катионов электролита Cu 2+ :
| Cu 2+ +2? = Cu. | (б) |
Электрод, на котором идет реакция восстановления или который принимает катионы из электролита, называется катодом.
Через электролитический ключ происходит движение ионов в растворе: анионов SO4 2– к аноду, катионов Zn 2+ к катоду. Движение ионов в растворе замыкает электрическую цепь гальванического элемента.
Реакции (а) и (б) называются электродными реакциями.
Складывая уравнения процессов, протекающих на электродах, получаем суммарное уравнение окислительно-восстановительной реакции, протекающей в гальваническом элементе:
| Zn + Cu 2+ = Zn 2+ + Cu | (в) |
или, с учетом анионов раствора:
| Zn + CuSO4= ZnSO4+ Cu. | (г) |
В общем случае, суммарное уравнение окислительно-восстановительной реакции, протекающей в произвольном гальваническом элементе, можно представить в виде:
| MeА + MeК n+ Á MeА n+ + MeК, | (д) |
где индексы А и К относятся к металлам анода и катода соответственно.
Реакции (в) – (д) называются токообразующими реакциями.
Символическая запись (схема) гальванического элемента имеет вид:
Часто вместо растворов обозначают только катионы, содержащиеся в растворе:
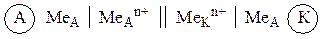 | (9.3) |
Схема гальванического элемента Даниэля – Якоби имеет вид:
Максимальная разность потенциалов электродов, которая может быть получена при работе гальванического элемента, называется электродвижущей силой (ЭДС) элемента Е. Она вычисляется по формуле;
| Е= φк – φа, | (9.4) |
где φк и φа – электродные потенциалы катода и анода соответственно.
Величина ЭДС элемента Даниэля – Якоби при стандартных условиях равна:
Электродвижущая сила Е характеризует способность гальванического элемента совершать электрическую работу во внешней цепи.
Электрическая работа определяется максимальной полезной работой, совершаемой химической реакцией, которая равна изменению изобарно-изотермического потенциала ?G процесса. Связь между величиной ?G и ЭДС описывается уравнением:
| ?G = –nFE, | (9.5) |
где n – число электронов в элементарном окислительно-восстановительном акте, F – число Фарадея.
Величина изменения изобарно-изотермического потенциала токообразующей реакции при стандартных условиях ?G 0 связана с константой равновесия этой реакции Кравн соотношением
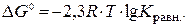 | (9.6) |
Гальванические элементы являются первичными (однократно используемыми) химическими источниками тока (ХИТ). Вторичными (многократно используемыми) ХИТ являются аккумуляторы. Процессы, протекающие при разряде и заряде аккумуляторов, взаимно обратны.
Гальванические элементы, у которых электроды выполнены из одного и того же металла и опущены в растворы своих солей разной концентрации, называются концентрационными. Функцию анода в таких элементах выполняет металл, опущенный в раствор соли с меньшей концентрацией, например:
Нернст изучал поведение электролитов при пропускании электрического тока и открыл закон. Закон устанавливает зависимость между электродвижущей силой ( разностью потенциалов ) и ионной концентрацией. Уравнение Нернста позволяет предсказать максимальный рабочий потенциал, который может быть получен в результате электрохимического взаимодействия, когда известны давление и температура. Таким образом, этот закон связывает термодинамику с электрохимической теорией в области решения проблем, касающихся сильно разбавленных растворов. 
· 
· 
· 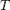
· 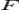
· 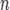
· 
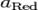
Если в формулу Нернста подставить числовые значения констант 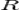
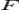

Химические гальванические элементы. Приведите пример гальванического элемента, составленного из электродов первого и второго рода, электрохимическая цепь без жидкостных соединений — «без переноса». Запишите уравнения электродных полуреакций и уравнение химической реакции, самопроизвольно протекающей при включении данного гальванического элемента во внешнюю цепь.
Процессы, протекающие в этом элементе:
(–) Анод Sn 2+ – 2ē →Sn 4+
(+) Катод 2Fe 3+ + 2ē → 2Fe 2+
Sn 2+ + 2Fe 3+ = Sn 4+ + 2Fe 2+
Цепь без переноса–это цепь без жидкостной границы. Например, 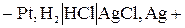
катод
анод
Поскольку электролит является общим для обоих электродов, диффузионный потенциал в таких цепях не возникает.
Химические гальванические элементы. Приведите пример элемента, составленного из газового электрода и электрода первого рода, электрохимическая цепь с переносом. Зависимость ЭДС элемента от давления газообразного участника реакции, протекающей в элементе
Цепь с переносом – это цепь с жидкостной границей. Например:
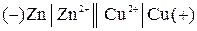
В состав электродов входят растворы различной природы или различной концентрации. Контакт между двумя растворами обеспечивается с помощью специальных приспособлений, например, солевым мостиком, состоящим из трубки, заполненной смесью влажного желеобразного вещества агар-агара с солью сильного электролита (КСl). Диффузионный потенциал на границе раздела раствор-раствор в этом случае устраняется.
Зависимость эдс от давления:
66. Химические гальванические элементы, основные типы. Применение измерений ЭДС для определения тепловых эффектов и энтропий химических реакций, самопроизвольно протекающих в гальванических элементах.
Гальвани́ческий элеме́нт — химический источник электрического тока, основанный на взаимодействии двух металлов и/или их оксидов в электролите, приводящем к возникновению в замкнутой цепи электрического тока. Назван в честь Луиджи Гальвани. Переход химической энергии в электрическую энергию происходит в гальванических элементах.
Типы гальванических элементов:
Гальванические первичные элементы — это устройства для прямого преобразования химической энергии, заключенных в них реагентов (окислителя и восстановителя), в электрическую. Реагенты, входящие в состав источника, расходуются в процессе его работы, и действие прекращается после расхода реагентов. Примером гальванического элемента является элемент Даниэля—Якоби.
Широкое распространение получили марганцево-цинковые элементы, не содержащие жидкого раствора электролита (сухие элементы, батарейки). Так, в солевых элементах Лекланше: цинковый электрод служит катодом, электрод из смеси диоксида марганца с графитом служит анодом, графит служит токоотводом. Электролитом является паста из раствора хлорида аммония с добавкой муки или крахмала в качестве загустителя.
Щелочные марганцево-цинковые элементы, в которых в качестве электролита используется паста на основе гидроксида калия, обладают целым рядом преимуществ (в частности, существенно большей ёмкостью, лучшей работой при низких температурах и при больших токах нагрузки).
Солевые и щелочные элементы широко применяются для питания радиоаппаратуры и различных электронных устройств.
Вторичные источники тока (аккумуляторы) — это устройства, в которых электрическая энергия внешнего источника тока превращается в химическую энергию и накапливается, а химическая — снова превращается в электрическую.
Одним из наиболее распространённых аккумуляторов является свинцовый (или кислотный). Электролитом является 25—30 % раствор серной кислоты. Электродами кислотного аккумулятора являются свинцовые решётки, заполненные оксидом свинца, который при взаимодействии с электролитом превращается в сульфат свинца (II) — PbSO4.
Также существуют щелочные аккумуляторы: наибольшее применение получили никель-кадмиевые и никель-металлгидридные аккумуляторы, в которых электролитом служит гидроксид калия (K-OH).
В различных электронных устройствах (мобильные телефоны, планшеты, ноутбуки), в основном, применяются литий-ионные и литий-полимерные аккумуляторы, характеризующиеся высокой ёмкостью и отсутствием эффекта памяти.
Электрохимические генераторы (топливные элементы) — это элементы, в которых происходит превращение химической энергии в электрическую. Окислитель и восстановитель хранятся вне элемента, в процессе работы непрерывно и раздельно подаются к электродам. В процессе работы топливного элемента, электроды не расходуются. Восстановителем является водород (H2), метанол(CH3OH), метан (CH4); в жидком или газообразном состоянии. Окислителем обычно является кислород — из воздуха или чистый. В кислородно-водородном топливном элементе с щелочным электролитом, происходит превращение химической энергии в электрическую. Энергоустановки применяются на космических кораблях: они обеспечивают энергией космический корабль и космонавтов
🎬 Видео
Гальванические элементы. 1 часть. 10 класс.Скачать

Задачи на гальванический элемент. Продукты в ОВР. Ч.5-4.Скачать

Гальванические элементыСкачать
Гальванический элементСкачать

Гальванический элементСкачать

Гальванический элемент Даниэля-Якоби (Зайцев Александр, 10 класс)Скачать

ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТСкачать

Уравнение Нернста. Задачи на расчет потенциалов. Продукты в ОВР. Ч.5-2.Скачать

Использование таблиц потенциалов и расчет ЭДС реакции. Продукты в ОВР. Ч.5-1.Скачать

Электроды и гальванические элементыСкачать

Гальванические элементы. Практическая часть. 10 класс.Скачать

Продукты в ОВР. Ч.2-3. Гальванический элемент.Скачать

Продукты в ОВР. Ч.2-1. Электродный потенциал металлов.Скачать

6. Химические источники тока. Гальванический элементСкачать
Основы электрохимииСкачать

Технологический институт - гальванический элемент, электролиз, коррозия. Задачи.Скачать

Гальванические элементы. 10 класс.Скачать

Коррозия металловСкачать