В книжной версии
Том 33. Москва, 2017, стр. 639
Скопировать библиографическую ссылку:
ФТОР (лат. Fluorum), F, химич. элемент VII группы короткой формы (17-й группы длинной формы) периодич. системы; относится к галогенам ; ат. н. 9, ат. м. 18,9984032. В природе один стабильный изотоп 19 F; получены радиоизотопы с массовыми числами 14–18, 20–31; как источник позитронов применение находит 18 F ( T 1/2 109,77 мин, электронный захват).
- История открытия галогенов
- Открытие фтора
- Открытие хлора
- Открытие брома
- Открытие йода
- Открытие астата
- Содержание
- История
- Происхождение названия
- Распространение в природе
- Физические свойства
- Электронное строение
- Строение молекулы
- Кристаллы
- Изотопный состав
- Ядерные свойства изотопов фтора
- Магнитные свойства ядер
- Химические свойства
- Получение
- Лабораторный метод
- Промышленный метод
- Хранение
- Применение
- Ракетная техника
- Применение в медицине
- Биологическая и физиологическая роль
- Токсикология
- 🔥 Видео
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

История открытия галогенов
Галогены буквально означает “солерождающие” (от лат. “галос” – соль и “генус” – рождать). Это название элементы получили за способность взаимодействовать с металлами с образованием типичных солей, например, хлорида натрия.
Открытие фтора
О его существовании догадывались многие химики конца XVIII – начала XIX века. “Фторос” – разрушение, гибель (греч.). В 1771 г. Карл Шееле получил HF. Сам фтор был открыт в 1886 г. французским химиком А. Муассаном электролизом безводного фтороводорода:
Однако в присутствии комиссии фтор получить не удалось из-за слишком тщательной очистки фтороводорода. Дело в том, что сам фтороводород не электропроводен (связь ковалентно-полярная), электропроводность обеспечивается присутствием KF, который образует с HF комплекс KF + HF → KHF2. Ион HF2 – достаточно устойчив, поэтому расплав HF, содержащий KF, содержит ионы K + и HF2 – , которые и обеспечивают электропроводность. Через 20 лет за открытие фтора А. Муассан получил Нобелевскую премию.
Открытие хлора
Впервые хлор был получен и описан К. Шееле в 1774 г. Получен он был действием концентрированной соляной кислоты на пиролюзит (MnO2·H2O):
Однако ни сам Шееле, ни его современники не считали этот газ самостоятельным химическим элементом. После победы кислородной теории А. Лавуазье над теорией флогистона хлор стали считать оксидом еще неоткрытого элемента мурия (А. Лавуазье, К. Бертолле, Г. Дэви). После 3-х лет попыток получить мурий Г. Дэви пришел к выводу, что это – простое вещество (1810 г.), которое назвал хлорином (“хлорос” – желто-зеленый, греч.). В 1811 г. Ж. Л. Гей-Люссак назвал его хлором. Считается, что первооткрыателем хлора был К. Шееле.
Открытие брома
Впервые был получен Ю. Либихом, но он “проглядел” открытие, приняв бром за смесь хлора и йода. Поэтому открытие принадлежит французу А. Балару (30 ноября 1825 г.).
А. Балар при обработке хлорной водой щелока из золы морских водорослей выделил красно-бурую жидкость с резким, неприятным запахом. Балар предположил, что это вещество хлорид иода и тщетно пытался обнаружить иод. Однако ему не удалось разложить это вещество. Изучив физические и химические свойства нового вещества, Балар пришел к выводу, что обнаружил новое простое вещество, очень пoхожее на хлор и иод по его химическим свойствам, образующее аналогичные соединения, но имеющее различия в физических свойствах и химическом поведении.
А. Балар назвал новое вещество муридом (от латинского слова muria – рассол). 15 ноября 1825 г. исследователь отправил сообщение об открытии в Парижскую Академию наук, которое было заслушано 3 июля 1826 г. Специальная комиссия, в состав которой вошли знаменитые химики Ж. Гей-Люссак, Л. Теннар и Л. Воклен, 14 августа 1826 г. подтвердила открытие Балара. Комиссия, получив новое вещество согласно методам Балара и изучив его свойства, пришла к единодушному выводу, что бром является новым простым веществом. Комиссией было предложено для этого вещества другое название – бром (от греческого слова “бромос” – зловонный, дурно пахнущий). В то время соляная кислота называлась муриевой, а соли ее – муриатами, так что название, предложенное А. Баларом, могло привести к недоразумениям.
Открытие йода
Открыт в 1811 г. французским химиком-селитроваром Б. Куртуа.
Согласно легенде, на заводе, где вырабатывалась селитра, рабочие как-то погнались за кошкой. Убегая от преследователей, кошка случайно опрокинула сосуд с серной кислотой на остатки солей от выработки селитры, и тогда вдруг из образовавшейся смеси выделились густые фиолетовые пары.
Куртуа заинтересовался этим явлением и внимательно стал изучать новое вещество. Он нашел, что фиолетовые пары при охлаждении оседают в виде черных с металлическим блеском кристаллов, новое вещество соединяется с водородом, фосфором, металлами, а с аммиаком образует крайне взрывчатое вещество.
О своих наблюдениях и выводах Куртуа сообщил двум своим друзьям из Дижона – Н. Клеману и Ш. Б. Дезорму. Клеман проделал все эксперименты, о которых ему рассказал Куртуа, убедился в полной справедливости его выводов и в январе 1813 г. сделал небольшое сообщение ученым Парижа о загадочном веществе.
Новое вещество привлекло внимание двух знаменитых ученых – французского Ж. Л. Гей-Люссака и английского Г. Дэви, которые независимо друг от друга принялись изучать его свойства. Ученые пришли к выводу, что открытое Куртуа вещество новый элемент. Гей-Люссак назвал его йодом, а Дэви – йодином (“йоэйдэс” – “фиолетовый”, древнегреч.). Во всем мире прижилось первое название и лишь в Англии йод называют йодином.
Открытие астата
Второй после технеция элемент. Получен в 1940 г. американскими учеными Т. (Д.) Корсоном, У. (К.) Макензи и Э. Сегре:
209 Bi + α → 211 At + 2n 0
“Астатос” – “неустойчивый, нестабильный”, греч.
Унунсептий — Uus был получен в 2009-2010 годах в Объединённом институте ядерных исследований в Дубне (Россия). Это 117-й элемент с периодом полураспада — 78 миллисекунд.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

| Фтор | |
|---|---|
| Жёлтая жидкость (при криогенных температурах), бесцветный газ (в толстых слоях — зеленовато-жёлтый, н. у.) | |
 |
(молярная масса)
(первый электрон)
ж.: 1,516 −188 г/см³,
тв.: 1,7 −228 г/см³ или 1,810 −225 г/см³
β -фтор: a = 5,5314(15)
Фтор (устар. флюор ; F, лат. fluorum ) — химический элемент 17-й группы, второго периода периодической системы (по устаревшей короткой форме периодической системы принадлежит к главной подгруппе VII группы, или к группе VIIA) с атомным номером 9. Самый химически активный неметалл и сильнейший окислитель, самый лёгкий элемент из группы галогенов. Как простое вещество при нормальных условиях фтор представляет собой двухатомный газ (формула F2) бледно-жёлтого цвета с резким запахом, напоминающим озон или хлор. Токсичен.
Видео:Галогены: фтор, хлор, бром и иод | Химические свойства #галогены #химия #видеоурок #егэхимияСкачать

Содержание
- 1 История
- 1.1 Происхождение названия
- 2 Распространение в природе
- 3 Физические свойства
- 3.1 Электронное строение
- 3.1.1 Строение молекулы
- 3.2 Кристаллы
- 3.3 Изотопный состав
- 3.3.1 Ядерные свойства изотопов фтора
- 3.3.2 Магнитные свойства ядер
- 3.1 Электронное строение
- 4 Химические свойства
- 5 Получение
- 5.1 Лабораторный метод
- 5.2 Промышленный метод
- 6 Хранение
- 7 Применение
- 7.1 Ракетная техника
- 7.2 Применение в медицине
- 8 Биологическая и физиологическая роль
- 9 Токсикология
Видео:Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

История
Первое соединение фтора — флюорит (плавиковый шпат) CaF2 — описано в конце XV века под названием «флюор». В 1771 году Карл Шееле получил плавиковую кислоту. При обработке минерала флюорита CaF2 серной кислотой он выделил HF в виде водного раствора. Это событие рассматривается в истории химии как открытие фтора. Аналогию с хлором предложил в 1810 г. Андре Ампер, его поддержал Гемфри Дэви. Дэви изучил растворения стекла в плавиковой кислоте.
Как химический элемент, входящий в состав плавиковой кислоты, фтор был предсказан в 1810 году, а выделен в свободном виде лишь 76 лет спустя Анри Муассаном в 1886 году электролизом жидкого безводного фтористого водорода, содержащего примесь кислого фторида калия KHF2.
Происхождение названия
Название «фтор» (от др.-греч. φθόρος — «разрушение, порча, вред»), предложенное Андре Ампером в 1810 году, употребляется в русском и некоторых других языках; во многих странах приняты названия, производные от лат. fluorum (от fluere — «течь», — по способности некоторых соединений фтора, например флюорита (CaF2), понижать температуру плавления металлургического шлака, образующегося при восстановлении металлов из руд, и увеличивать его текучесть.
Видео:25. Схема реакции и химическое уравнениеСкачать

Распространение в природе
Содержание фтора в атомных процентах в природе показано в таблице:
| Объект | Содержание |
|---|---|
| Почва | 0,02 |
| Воды рек | 0,00002 |
| Воды океана | 0,0001 |
| Зубы человека | 0,01 |
В природе значительные скопления фтора содержатся, в основном, в минерале флюорите (CaF2), содержащем по массе 51,2 % Ca и 48,8 % F. Кларк в земной коре 650 г/т.
Из растений относительно богаты фтором чечевица и лук.
В почве фтор накапливается в результате вулканической деятельности, в составе вулканических газов обычно содержится большое количество фтороводорода.
Видео:Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

Физические свойства
При нормальных условиях представляет собой бледно-жёлтый газ. В малых концентрациях в воздухе его запах напоминает одновременно озон и хлор. Очень агрессивен и ядовит.
Фтор имеет аномально низкую температуру кипения (85,03 К, −188,12 °C) и плавления (53,53 К, −219,70 °C). Это связано с тем, что фтор не имеет d-подуровня и не способен образовывать полуторные связи, в отличие от остальных галогенов (кратность связи в остальных галогенах примерно 1,1).
Ниже температуры плавления образует кристаллы бледно-жёлтого цвета.
Электронное строение
Электронная конфигурация атома фтора: 1s 2 2s 2 2p 5 .
Атомы фтора в соединениях могут проявлять степень окисления, равную −1. Положительные степени окисления в соединениях неизвестны, так как фтор является самым электроотрицательным элементом.
Квантовохимический терм атома фтора — 2 P3/2.
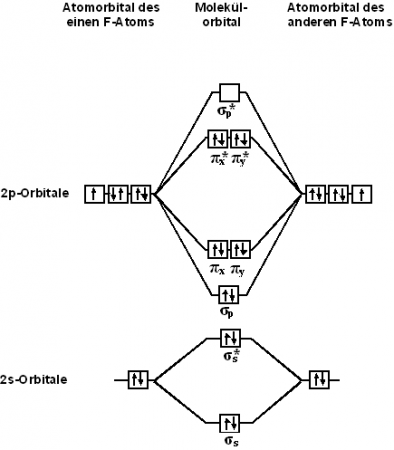
Строение молекулы
С точки зрения теории молекулярных орбиталей, строение двухатомной молекулы фтора можно охарактеризовать следующей диаграммой. В молекуле присутствует 4 связывающих орбитали и 3 разрыхляющих. Порядок связи в молекуле равен 1.
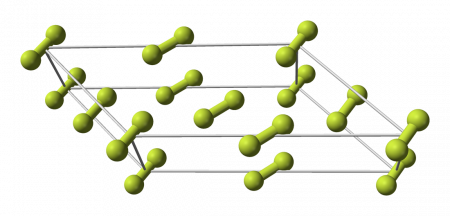
Кристаллы
Фтор образует молекулярные кристаллы с двумя кристаллическими модификациями, стабильными при атмосферном давлении:
- α -фтор, непрозрачный, твёрдый и хрупкий, существует при температуре ниже 45,6 K, кристаллическая решётка моноклинной сингонии, пространственная группа C 2/c, параметры ячейки a = 0,54780(12) нм , b = 0,32701(7) нм , c = 0,72651(17) нм , β = 102,088(18)° , Z = 4 , d = 1,98 г/см 3 с объёмом элементарной ячейки 0,12726(5) нм 3 (при 10 К);
- β -фтор, прозрачный и менее плотный и твёрдый, существует в интервале температур от 45,6 К до точки плавления 53,53 K , кристаллическая решётка кубической сингонии (примитивная решётка), пространственная группа Pm 3 n, параметры ячейки a = 0,65314(15) нм , Z = 8 , d = 1,81 г/см 3 с объёмом элементарной ячейки 0,27862(11) нм 3 (при 48 К ), решётка изотипична γ -фазе O2 и δ -фазе N2. Следует отметить, что в раннем (но единственном проведённом до 2019 года) эксперименте по изучению структуры β -фтора рентгенографическая плотность кристалла была оценена как 1,70(5) г/см 3 , и эта плотность твёрдого фтора цитируется в большинстве справочников. Более точное современное измерение даёт 1,8104(12) г/см 3 .
Фазовый переход между этими кристаллическими фазами фтора более экзотермичен, чем затвердевание жидкого фтора. Фаза ромбической сингонии у твёрдого фтора не обнаружена, в отличие от всех прочих галогенов. Молекулы α -фтора разупорядочены по направлению. Длина связи F—F в молекулах составляет 0,1404(12) нм .
Даже при столь низких температурах взаимодействие кристаллов фтора со многими веществами приводит к взрыву.
Изотопный состав
Фтор является моноизотопным элементом: в природе существует только один стабильный изотоп фтора 19 F. Известны ещё 17 радиоактивных изотопов фтора с массовым числом от 14 до 31, и один ядерный изомер — 18m F. Самым долгоживущим из радиоактивных изотопов фтора является 18 F с периодом полураспада 109,771 минуты, важный источник позитронов, использующийся в позитрон-эмиссионной томографии.
Ядерные свойства изотопов фтора
| Изотоп | Относительная масса, а. е. м. | Период полураспада | Тип распада | Ядерный спин | Ядерный магнитный момент |
|---|---|---|---|---|---|
| 17 F | 17,0020952 | 64,5 c | β + -распад в 17 O | 5/2 | 4,722 |
| 18 F | 18,000938 | 1,83 часа | β + -распад в 18 O | 1 | |
| 19 F | 18,99840322 | Стабилен | — | 1/2 | 2,629 |
| 20 F | 19,9999813 | 11 c | β − -распад в 20 Ne | 2 | 2,094 |
| 21 F | 20,999949 | 4,2 c | β − -распад в 21 Ne | 5/2 | |
| 22 F | 22,00300 | 4,23 c | β − -распад в 22 Ne | 4 | |
| 23 F | 23,00357 | 2,2 c | β − -распад в 23 Ne | 5/2 |
Магнитные свойства ядер
Ядра изотопа 19 F имеют полуцелый спин, поэтому возможно применение этих ядер для ЯМР-исследований молекул. Спектры ЯМР- 19 F являются достаточно характеристичными для фторорганических соединений.
Видео:68 учеников этого НЕ ЗНАЮТ! Таблица Менделеева — Как пользоваться?Скачать

Химические свойства
Самый активный неметалл, бурно взаимодействует почти со всеми веществами (кроме фторидов в высших степенях окисления и редких исключений — фторопластов) и с большинством из них — с горением и взрывом. Образует соединения со всеми химическими элементами, кроме гелия, неона, аргона.
К воздействию фтора при комнатной температуре устойчивы некоторые металлы за счёт образования на их поверхности плотной плёнки фторида, тормозящей реакцию со фтором, например, Al, Mg, Cu, Ni. Контакт фтора с водородом приводит к воспламенению и взрыву в кварцевых сосудах даже при очень низких температурах (до −252 °C), в магниевых сосудах для начала реакции нужен небольшой нагрев.
В атмосфере фтора горят даже вода и платина.
Продукты реакции фтора с водой, в зависимости от условий её протекания, могут различаться:
К реакциям, в которых фтор формально является восстановителем, относятся реакции разложения высших фторидов, например:
Фтор также способен окислять в электрическом разряде кислород, образуя дифторид кислорода OF2 и диоксидифторид O2F2. Под давлением или при облучении ультрафиолетом реагирует с криптоном и ксеноном с образованием фторидов благородных газов.
Во всех соединениях фтор проявляет степень окисления −1. Чтобы фтор проявлял положительную степень окисления, требуется создание эксимерных молекул или иные экстремальные условия. Это требует искусственной ионизации атомов фтора.
Не реагирует с гелием, неоном, аргоном, азотом, кислородом, тетрафторметаном. При комнатной температуре не реагирует с сухим сульфатом калия, углекислым газом и закисью азота. Без примеси фтороводорода при комнатной температуре не действует на стекло.
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Получение
Промышленный способ получения фтора включает добычу и обогащение флюоритовых руд, сернокислотное разложение их концентрата с образованием безводного HF и его электролитическое разложение.
Для лабораторного получения фтора используют разложение некоторых соединений, но все они не встречаются в природе в достаточном количестве, и их получают с помощью свободного фтора.
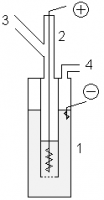
Лабораторный метод
- В лабораторных условиях фтор можно получать с помощью показанной установки. В медный сосуд 1, заполненный расплавом KF·3HF, помещают медный сосуд 2, имеющий отверстия в дне. В сосуд 2 помещают толстый никелевый анод. Катод помещается в сосуд 1. Таким образом, в процессе электролиза газообразный фтор выделяется из трубки 3, а водород — из трубки 4. Важным требованием является обеспечение герметичности системы, для этого используют пробки из фторида кальция со смазкой из оксида свинца(II) и глицерина.
- В 1986 году, во время подготовки к конференции по поводу празднования 100-летия открытия фтора, Карл Кристе открыл способ чисто химического получения фтора с использованием реакции во фтороводородном растворе K2MnF6 и SbF5 при 150 °C:
2K2MnF6 + 4SbF5 → 4KSbF6 + 2MnF3 + F2↑
Хотя этот метод не имеет практического применения, он демонстрирует, что электролиз необязателен; кроме того, все компоненты для данных реакций могут быть получены без использования газообразного фтора.
Также для лабораторного получения фтора можно использовать нагрев фторида кобальта(III) до 300 °C, разложение фторидов серебра и некоторые другие способы.
Промышленный метод
Промышленное производство фтора осуществляется электролизом расплава кислого фторида калия KF·2HF (часто с добавлениями фторида лития), который образуется при насыщении расплава KF фтористым водородом до содержания 40—41 % HF. Процесс электролиза проводят при температурах около 100 °C в стальных электролизёрах со стальным катодом и угольным анодом.
Видео:Реакции присоединения | Химия 10 класс | УмскулСкачать

Хранение
Фтор хранят в газообразном состоянии (под давлением) и в жидком виде (при охлаждении жидким азотом) в аппаратах из никеля и сплавов на его основе (монель-металл), из меди, алюминия и его сплавов, латуни, нержавеющей стали (это возможно потому, что эти металлы и сплавы покрываются плёнкой фторидов, которая защищает от дальнейшей реакции с фтором).
Видео:Экзо- и эндотермические реакции. Тепловой эффект химических реакций. 8 класс.Скачать

Применение
Фтор используется для получения:
- фреонов — широко распространённых хладагентов;
- фторопластов — химически инертных полимеров;
- элегаза SF6 — газообразного изолятора, применяемого в высоковольтной электротехнике;
- гексафторида урана UF6, применяемого для разделения изотопов урана в ядерной промышленности;
- гексафтороалюмината натрия — электролита для получения алюминия электролизом;
- фторидов металлов (например, W и V), которые обладают некоторыми полезными свойствами;
Ракетная техника
Фтор и некоторые его соединения являются сильными окислителями, поэтому могут применяться в качестве окислителя в ракетных топливах. Очень высокая эффективность фтора вызывала значительный интерес к нему и его соединениям. На заре космической эры в СССР и других странах существовали программы исследования фторсодержащих ракетных топлив. Однако продукты горения с фторсодержащими окислителями токсичны. Поэтому топлива на основе фтора не получили распространения в современной ракетной технике.
Применение в медицине
Фторированные углеводороды (например перфтордекалин) применяются в медицине как кровезаменители. Существует множество лекарств, содержащих фтор в структуре (фторотан, фторурацил, флуоксетин, галоперидол и др.). Фториды натрия, калия и др. применяются для профилактики кариеса (см. ниже).
Видео:ВАЛЕНТНОСТЬ. Графические формулы веществ | Химия | TutorOnlineСкачать

Биологическая и физиологическая роль
Фтор является жизненно необходимым для организма элементом. В организме человека фтор в основном содержится в эмали зубов в составе фторапатита — Ca5F(PO4)3 — и в костях. Общее содержание составляет 2,6 г, в том числе в костях 2,5 г. Нормальное суточное поступление фтора в организм человека равно 2,5—3,5 мг. При недостаточном (менее 0,5 мг/литр питьевой воды) или избыточном (более 1 мг/литр) потреблении фтора организмом могут развиваться заболевания зубов: кариес и флюороз (крапчатость эмали) и остеосаркома, соответственно.
Малое содержание фтора разрушает эмаль за счёт вымывания фтора из фторапатита с образованием гидроксоапатита, и наоборот.
Для профилактики кариеса рекомендуется использовать зубные пасты с добавками фторидов (натрия и/или олова) или употреблять фторированную воду (до концентрации 1 мг/л), или применять местные аппликации 1—2 % раствором фторида натрия или фторида олова. Такие действия могут сократить вероятность появления кариеса на 30—50 %.
Предельно допустимая концентрация связанного фтора (в виде фторидов и фторорганических соединений) в воздухе промышленных помещений равна 0,0005 мг/литр воздуха.
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Токсикология
Фтор представляет собой чрезвычайно агрессивное ядовитое вещество. Является сильным окислителем. Раздражающие свойства в несколько раз сильнее, чем у фтороводорода. Резорбтивное действие объясняется возможностью фтора вступать в свободнорадикальные реакции с тканями организма. Контакт кожи с газом в течение 2 секунд вызывает термический ожог II степени; воздействие в концентрации 0,15-0,30 мг/л приводит к раздражению открытых участков кожи. При обследовании 252 человек, подвергающихся воздействию фтора, у 57 обнаружены конъюнктивиты или экзема век.
🔥 Видео
Решение задач на термохимические уравнения. 8 класс.Скачать

РЕАКЦИИ ИОННОГО ОБМЕНА и условия их протекания | Как составлять молекулярные и ионные уравненияСкачать

Реакции ионного обмена. 9 класс.Скачать

Химия 9 класс (Урок№10 - Галогены. Хлор. Хлороводород. Соляная кислота и её соли.)Скачать

Галогены (F, Cl, Br, I). Химические свойства. Правило вытеснения галогенов.Скачать

Химия | Тепловой эффект химической реакции (энтальпия)Скачать

Расстановка коэффициентов в химических реакциях: как просто это сделатьСкачать

Характеристика элемента по положению в Периодической системе и строению атома. 1 часть. 8 класс.Скачать