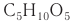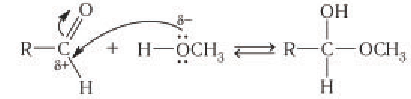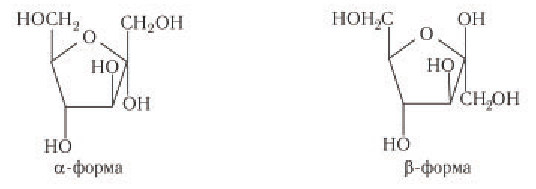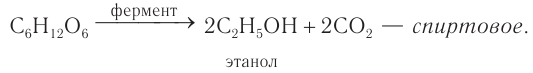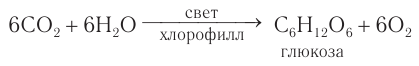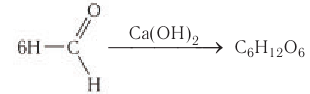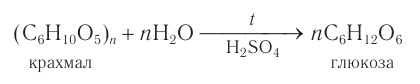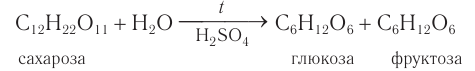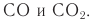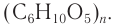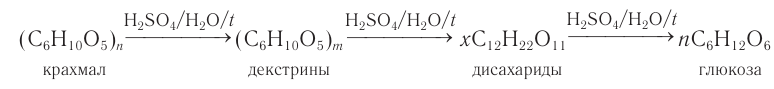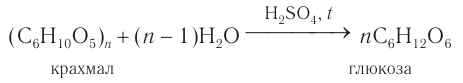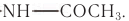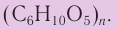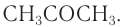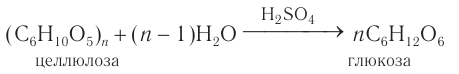Теория по теме Углеводы. Краткие конспект по углеводам. Классификация углеводов, химические свойства углеводов, способы получения углеводов. Свойства и получение моносахаридов (глюкоза, фруктоза), олигосахаридов (сахароза и др.), полисахаридов.
| Углеводы (сахара) – органические соединения, имеющие сходное строение, состав большинства которых отражает формула Cx(H2O)y, где x, y ≥ 3. |
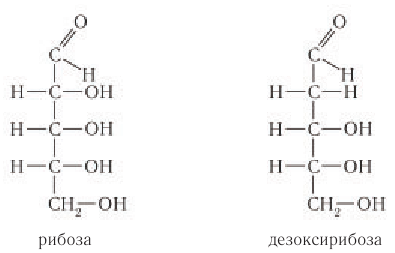
Исключение составляет дезоксирибоза, которая имеют формулу С5Н10O4 (на один атом кислорода меньше, чем рибоза).
- Классификация углеводов
- По числу структурных звеньев
- По числу атомов углерода в молекуле
- По размеру кольца в циклической форме молекулы
- Химические свойства, общие для всех углеводов
- 1. Горение
- 2. Взаимодействие с концентрированной серной кислотой
- Моносахариды
- Глюкоза
- Химические свойства глюкозы
- Водный раствор глюкозы
- Качественная реакция на многоатомные спирты: реакция со свежеосажденным гидроксидом меди (II)
- Реакции на карбонильную группу — CH=O
- Получение глюкозы
- Гидролиз крахмала
- Синтез из формальдегида
- Фотосинтез
- Фруктоза
- Дисахариды
- Сахароза (свекловичный или тростниковый сахар) С12Н22О11
- Мальтоза С12Н22О11
- Полисахариды
- Крахмал
- Свойства крахмала
- Целлюлоза
- Свойства целлюлозы
- 3.8.3. Углеводы (моносахариды, дисахариды, полисахариды).
- Классификация углеводов
- Химические свойства моносахаридов на примере глюкозы и фруктозы
- Химические свойства глюкозы и фруктозы как карбонильных соединений
- Химические свойства глюкозы и фруктозы как многоатомных спиртов
- Реакции брожения глюкозы
- Спиртовое брожение
- Молочнокислое брожение
- Особенности существования моносахаридов в водных растворах
- Дисахариды. Химические свойства.
- Общее описание дисахаридов
- Гидролиз дисахаридов
- Дисахариды как многоатомные спирты
- Полисахариды. Крахмал и целлюлоза
- Химические свойства крахмала и целлюлозы
- Горение
- Образование глюкозы
- Качественная реакция на крахмал
- Углеводы в химии — свойства, формула, получение, номенклатура и определение с примерами
- Строение глюкозы
- Фруктоза
- Физические свойства моносахаридов
- Химические свойства, получение и применение глюкозы
- Дисахариды и сахароза
- Полисахариды и крахмал
- Химические свойства, получение и применение крахмала
- Целлюлоза
- Химические свойства и применение целлюлозы
Видео:Реакции металлов с кислородом и водой. 8 класс.Скачать

Классификация углеводов
Видео:Водород/химические свойства водорода/8 классСкачать

По числу структурных звеньев
- Моносахариды — содержат одно структурное звено.
- Олигосахариды — содержат от 2 до 10 структурных звеньев (дисахариды, трисахариды и др.).
- Полисахариды — содержат n структурных звеньев.
Некоторые важнейшие углеводы:
| Моносахариды | Дисахариды | Полисахариды |
| Глюкоза С6Н12О6 Дезоксирибоза С5Н10О4 | Сахароза С12Н22О11 Целлобиоза С12Н22О11 | Целлюлоза (С6Н10О5)n Крахмал(С6Н10О5)n |
Видео:Водород. 8 класс.Скачать

По числу атомов углерода в молекуле
- Пентозы — содержат 5 атомов углерода.
- Гексозы — содержат 6 атомов углерода.
- И т.д.
Видео:Водород и кислород. 1 часть. 8 класс.Скачать

По размеру кольца в циклической форме молекулы
- Пиранозы — образуют шестичленное кольцо.
- Фуранозы — содержат пятичленное кольцо.
Видео:Уравнивание реакций горения углеводородовСкачать

Химические свойства, общие для всех углеводов
Видео:Свойства и применение водорода. 8 класс.Скачать

1. Горение
Все углеводы горят до углекислого газа и воды.
| Например, при горении глюкозы образуются вода и углекислый газ |
Видео:Химия | ВодородСкачать

2. Взаимодействие с концентрированной серной кислотой
Концентрированная серная кислота отнимает воду от углеводов, при этом образуется углерод С («обугливание») и вода.
| Например, при действии концентрированной серной кислоты на глюкозу образуются углерод и вода |
Видео:Получение водорода и проверка его на чистотуСкачать

Моносахариды
| Моносахариды – гетерофункциональные соединения, в состав их молекул входит одна карбонильная группа (группа альдегида или кетона) и несколько гидроксильных. |
Моносахариды являются структурными звеньями олигосахаридов и полисахаридов.
Важнейшие моносахариды
| Название и формула | Глюкоза C6H12O6 | Фруктоза C6H12O6 | Рибоза C5H10O5 |
| Структурная формула |  |  |  |
| Классификация |
|
|
|
Видео:Термоядерные реакции на солнце. Химия – просто.Скачать

Глюкоза
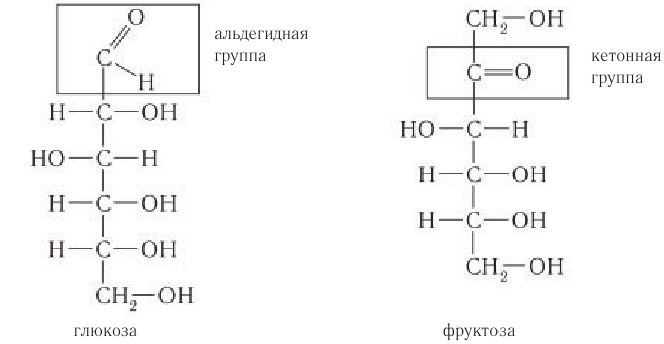
Глюкоза – это альдегидоспирт (альдоза).
Она содержит шесть атомов углерода, одну альдегидную и пять гидроксогрупп.
Глюкоза существует в растворах не только в виде линейной, но и циклических формах (альфа и бета), которые являются пиранозными (содержат шесть звеньев):
| α-глюкоза | β-глюкоза |
 |  |
Видео:Химия 8 класс (Урок№13 - Водород: нахождение в природе, получение, его физ. и хим. свойства.)Скачать

Химические свойства глюкозы
Водный раствор глюкозы
В водном растворе глюкозы существует динамическое равновесие между двумя циклическими формами — α и β и линейной формой:
Качественная реакция на многоатомные спирты: реакция со свежеосажденным гидроксидом меди (II)
При взаимодействии свежеосажденного гидроксида меди (II) с глюкозой (и другими моносахаридами происходит растворение гидроксида с образованием комплекса синего цвета.
Реакции на карбонильную группу — CH=O
Глюкоза проявляет свойства, характерные для альдегидов.
- Реакция «серебряного зеркала»
- Реакция с гидроксидом меди (II) при нагревании. При взаимодействии глюкозы с гидроксидом меди (II) выпадает красно-кирпичный осадок оксида меди (I):
- Окисление бромной водой. При окислении глюкозы бромной водой образуется глюконовая кислота:
- Также глюкозу можно окислить хлором, бертолетовой солью, азотной кислотой.
| Концентрированная азотная кислота окисляет не только альдегидную группу, но и гидроксогруппу на другом конце углеродной цепи. |
- Каталитическое гидрирование. При взаимодействии глюкозы с водородом происходит восстановление карбонильной группы до спиртового гидроксила, образуется шестиатомный спирт – сорбит:
- Брожение глюкозы. Брожение — это биохимический процесс, основанный на окислительно-восстановительных превращениях органических соединений в анаэробных условиях.
Спиртовое брожение. При спиртовом брожении глюкозы образуются спирт и углекислый газ:
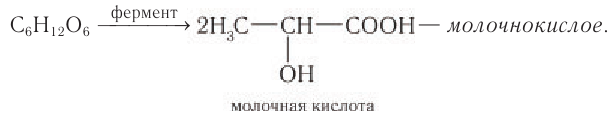
Молочнокислое брожение. При молочнокислом брожении глюкозы образуется молочная кислота:
Маслянокислое брожение. При маслянокислом брожении глюкозы образуется масляная кислота (внезапно):
- Образование эфиров глюкозы (характерно для циклической формы глюкозы).
Глюкоза способна образовывать простые и сложные эфиры.
Наиболее легко происходит замещение полуацетального (гликозидного) гидроксила.
Например, α-D-глюкоза взаимодействует с метанолом.
При этом образуется монометиловый эфир глюкозы (α-O-метил-D-глюкозид):
| Простые эфиры глюкозы получили название гликозидов. |
В более жестких условиях (например, с CH3-I) возможно алкилирование и по другим оставшимся гидроксильным группам.
Моносахариды способны образовывать сложные эфиры как с минеральными, так и с карбоновыми кислотами.
| Например, β-D-глюкоза реагирует с уксусным ангидридом в соотношении 1:5 с образованием пентаацетата глюкозы (β-пентаацетил-D-глюкозы): |
Видео:Моносахариды за 45 минут | Химия ЕГЭ 10 класс | УмскулСкачать

Получение глюкозы
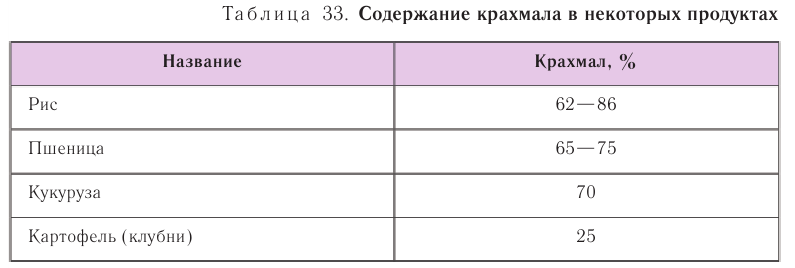
Гидролиз крахмала
В присутствии кислот крахмал гидролизуется:
Синтез из формальдегида
Реакция была впервые изучена А.М. Бутлеровым. Синтез проходит в присутствии гидроксида кальция:
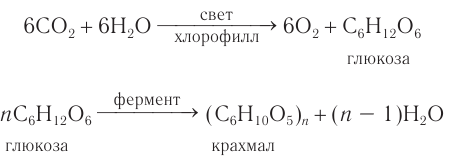
Фотосинтез
В растениях углеводы образуются в результате реакции фотосинтеза из CO2 и Н2О:
Видео:25. Схема реакции и химическое уравнениеСкачать

Фруктоза
| Фруктоза — структурный изомер глюкозы. Это кетоноспирт (кетоза): она тоже может существовать в циклических формах (фуранозы). |
Она содержит шесть атомов углерода, одну кетоновую группу и пять гидроксогрупп.
| Фруктоза | α-D-фруктоза | β-D-фруктоза |
 |  |  |
Фруктоза – кристаллическое вещество, хорошо растворимое в воде, более сладкое, чем глюкоза.
В свободном виде содержится в мёде и фруктах.
Химические свойства фруктозы связаны с наличием кетонной и пяти гидроксильных групп.
При гидрировании фруктозы также получается сорбит.
Видео:Водород химический элемент и простое вещество Получение водородаСкачать

Дисахариды
| Дисахариды – это углеводы, молекулы которых состоят из двух остатков моносахаридов, соединенных друг с другом за счет взаимодействия гидроксильных групп (двух полуацетальных или одной полуацетальной и одной спиртовой). |
Видео:Аэробный и анаэробный гликолиз. Реакции катаболизма глюкозы. Расчет выхода АТФ в гликолизеСкачать

Сахароза (свекловичный или тростниковый сахар) С12Н22О11
Молекула сахарозы состоит из остатков α-глюкозы и β-фруктозы, соединенных друг с другом:
В молекуле сахарозы гликозидный атом углерода глюкозы связан из-за образования кислородного мостика с фруктозой, поэтому сахароза не образует открытую (альдегидную) форму.
| Поэтому сахароза не вступает в реакции альдегидной группы – с аммиачным раствором оксида серебра с гидроксидом меди при нагревании. Такие дисахариды называют невосстанавливающими, т.е. не способными окисляться. |
Сахароза подвергается гидролизу подкисленной водой. При этом образуются глюкоза и фруктоза:
Видео:Реакции присоединения и полимеризации в органике | Химия ЕГЭ | УмскулСкачать

Мальтоза С12Н22О11
Это дисахарид, состоящий из двух остатков α-глюкозы, она является промежуточным веществом при гидролизе крахмала.
| Мальтоза является восстанавливающим дисахаридом (одно из циклических звеньев может раскрываться в альдегидную группу) и вступает в реакции, характерные для альдегидов. |
При гидролизе мальтозы образуется глюкоза.
Видео:Биохимия. Лекция 48. Углеводы. Превращение фруктозы и галактозы в глюкозу. Гликогенез. Гликогенолиз.Скачать

Полисахариды
| Полисахариды — это природные высокомолекулярные углеводы, макромолекулы которых состоят из остатков моносахаридов. |
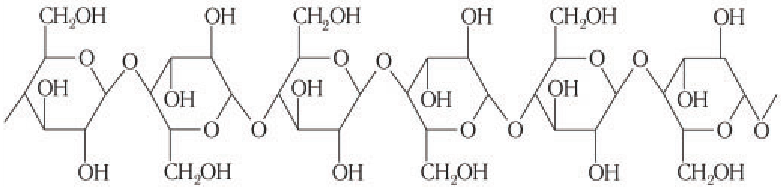
Основные представители — крахмал и целлюлоза — построены из остатков одного моносахарида — глюкозы.
Крахмал и целлюлоза имеют одинаковую молекулярную формулу: (C6H10O5)n, но совершенно различные свойства.
Это объясняется особенностями их пространственного строения.
Крахмал состоит из остатков α-глюкозы, а целлюлоза – из β-глюкозы, которые являются пространственными изомерами и отличаются лишь положением одной гидроксильной группы:
Видео:Составление уравнений реакций горения. 11 класс.Скачать

Крахмал
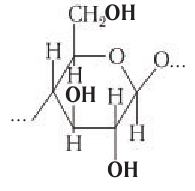
Крахмалом называется полисахарид, построенный из остатков циклической α-глюкозы.
В его состав входят:
- амилоза (внутренняя часть крахмального зерна) – 10-20%
- амилопектин (оболочка крахмального зерна) – 80-90%
Цепь амилозы включает 200 — 1000 остатков α-глюкозы (средняя молекулярная масса 160 000) и имеет неразветвленное строение.
Амилопектин имеет разветвленное строение и гораздо большую молекулярную массу, чем амилоза.
Свойства крахмала
- Гидролиз крахмала: при кипячении в кислой среде крахмал последовательно гидролизуется:
- Крахмал не дает реакцию “серебряного зеркала” и не восстанавливает гидроксид меди (II).
- Качественная реакция на крахмал: синее окрашивание с раствором йода.
Видео:Очищение организма + чистка печени + лечение аллергии = 3 шага за 300 рублей. "Забытое лечение".Скачать

Целлюлоза
Целлюлоза (клетчатка) – наиболее распространенный растительный полисахарид. Цепи целлюлозы построены из остатков β-глюкозы и имеют линейное строение.
Свойства целлюлозы
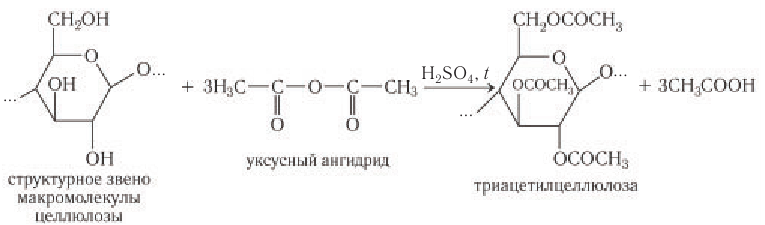
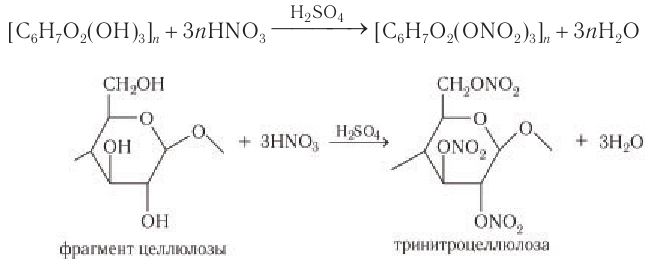
- Образование сложных эфиров с азотной и уксусной кислотами.
Нитрование целлюлозы.
Так как в звене целлюлозы содержится 3 гидроксильные группы, то при нитровании целлюлозы избытком азотной кислоты возможно образование тринитрата целлюлозы, взрывчатого вещества пироксилина:
Ацилирование целлюлозы.
При действии на целлюлозу уксусного ангидрида (упрощённо-уксусной кислоты) происходит реакция этерификации, при этом возможно участие в реакции 1, 2 и 3 групп ОН.
Получается ацетат целлюлозы – ацетатное волокно.
- Гидролиз целлюлозы.
Целлюлоза, подобно крахмалу, в кислой среде может гидролизоваться, в результате тоже получается глюкоза. Но процесс идёт гораздо труднее.
Видео:Взаимодействие кислорода с водородомСкачать

3.8.3. Углеводы (моносахариды, дисахариды, полисахариды).
Углеводы — органические соединения, чаще всего природного происхождения, состоящие только из углерода, водорода и кислорода.
Углеводы играют огромную роль в жизнедеятельности всех живых организмов.
Свое название данный класс органических соединений получил за то, что первые изученные человеком углеводы имели общую формулу вида Cx(H2O)y . Т.е. их условно посчитали соединениями углерода и воды. Однако позднее оказалось, что состав некоторых углеводов отклоняется от этой формулы. Например, такой углевод как дезоксирибоза имеет формулу С5Н10О4. В то же время существуют некоторые соединения, формально соответствующие формуле Cx(H2O)y, однако к углеводам не относящиеся, как, например, формальдегид (СН2О) и уксусная кислота (С2Н4О2).
Тем не менее, термин «углеводы» исторически закрепился за данным классом соединений, в связи с чем повсеместно используется и в наше время.
Видео:Взаимодействие хлора с водородомСкачать

Классификация углеводов
В зависимости от способности углеводов расщепляться при гидролизе на другие углеводы с меньшей молекулярной массой их делят на простые (моносахариды) и сложные (дисахариды, олигосахариды, полисахариды).
Как легко догадаться, из простых углеводов, т.е. моносахаридов, нельзя гидролизом получить углеводы с еще меньшей молекулярной массой.
При гидролизе одной молекулы дисахарида образуются две молекулы моносахарида, а при полном гидролизе одной молекулы любого полисахарида получается множество молекул моносахаридов.
Химические свойства моносахаридов на примере глюкозы и фруктозы
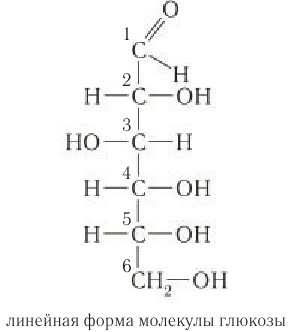
Самыми распространенными моносахаридами являются глюкоза и фруктоза, имеющие следующие структурные формулы:
Как можно заметить, и в молекуле глюкозы, и в молекуле фруктозы присутствует по 5 гидроксильных групп, в связи с чем их можно считать многоатомными спиртами.
В составе молекулы глюкозы имеется альдегидная группа, т.е. фактически глюкоза является многоатомным альдегидоспиртом.
В случае фруктозы можно обнаружить в ее молекуле кетонную группу, т.е. фруктоза является многоатомным кетоспиртом.
Химические свойства глюкозы и фруктозы как карбонильных соединений
Все моносахариды могут реагировать в присутствии катализаторов с водородом. При этом карбонильная группа восстанавливается до спиртовой гидроксильной. Так, в частности, гидрированием глюкозы в промышленности получают искусственный подсластитель – гексаатомный спирт сорбит:
Молекула глюкозы содержит в своем составе альдегидную группу, в связи с чем логично предположить, что ее водные растворы дают качественные реакции на альдегиды. И действительно, при нагревании водного раствора глюкозы со свежеосажденным гидроксидом меди (II) так же, как и в случае любого другого альдегида, наблюдается выпадение из раствора кирпично-красного осадка оксида меди (I). При этом альдегидная группа глюкозы окисляется до карбоксильной – образуется глюконовая кислота:
Также глюкоза вступает и в реакцию «серебряного зеркала» при действии на нее аммиачного раствора оксида серебра. Однако, в отличие от предыдущей реакции вместо глюконовой кислоты образуется ее соль – глюконат аммония, т.к. в растворе присутствует растворенный аммиак:
Фруктоза и другие моносахариды, являющиеся многоатомными кетоспиртами, в качественные реакции на альдегиды не вступают.
Химические свойства глюкозы и фруктозы как многоатомных спиртов
Поскольку моносахариды, в том числе глюкоза и фруктоза, имеют в составе молекул несколько гидроксильных групп. Все они дают качественную реакцию на многоатомные спирты. В частности, в водных растворах моносахаридов растворяется свежеосажденный гидроксид меди (II). При этом вместо голубого осадка Cu(OH)2 образуется темно-синий раствор комплексных соединений меди.
Реакции брожения глюкозы
Спиртовое брожение
При действии на глюкозу некоторых ферментов глюкоза способна превращаться в этиловый спирт и углекислый газ:
Молочнокислое брожение
Помимо спиртового типа брожения существует также и немало других. Например, молочнокислое брожение, которое протекает при скисании молока, квашении капусты и огурцов:
Особенности существования моносахаридов в водных растворах
Моносахариды существуют в водном растворе в трех формах – двух циклических (альфа- и бета-) и одной нециклической (обычной). Так, например, в растворе глюкозы существует следующее равновесие:
Как можно видеть, в циклических формах отсутствует альдегидная группа, в связи с тем что она участвует в образовании цикла. На ее основе образуется новая гидроксильная группа, которую называют ацетальным гидроксилом. Аналогичные переходы между циклическими и нециклической формами наблюдаются и для всех других моносахаридов.
Дисахариды. Химические свойства.
Общее описание дисахаридов
Дисахаридами называют углеводы, молекулы которых состоят из двух остатков моносахаридов, связанных между собой за счет конденсации двух полуацетальных гидроксилов либо же одного спиртового гидроксила и одного полуацетального. Связи, образующиеся таким образом между остатками моносахаридов, называют гликозидными. Формулу большинства дисахаридов можно записать как C12H22O11.
Наиболее часто встречающимся дисахаридом является всем знакомый сахар, химиками называемый сахарозой. Молекула данного углевода образована циклическими остатками одной молекулы глюкозы и одной молекулы фруктозы. Связь между остатками дисахаридов в данном случае реализуется за счет отщепления воды от двух полуацетальных гидроксилов:
Поскольку связь между остатками моносахаридов образована при конденсации двух ацетальных гидроксилов, для молекулы сахара невозможно раскрытие ни одного из циклов, т.е. невозможен переход в карбонильную форму. В связи с этим сахароза не способна давать качественные реакции на альдегиды.
Подобного рода дисахариды, которые не дают качественные реакции на альдегиды, называют невосстанавливающими сахарами.
Тем не менее, существуют дисахариды, которые дают качественные реакции на альдегидную группу. Такая ситуация возможна, когда в молекуле дисахарида остался полуацетальный гидроксил из альдегидной группы одной из исходных молекул моносахаридов.
В частности, в реакцию с аммиачным раствором оксида серебра, а также гидроксидом меди (II) подобно альдегидам вступает мальтоза. Связано это с тем, что в её водных растворах существует следующее равновесие:
Как можно видеть, в водных растворах мальтоза существует в виде двух форм – с двумя циклами в молекуле и одним циклом в молекуле и альдегидной группой. По этой причине мальтоза, в отличие от сахарозы, дает качественную реакцию на альдегиды.
Гидролиз дисахаридов
Все дисахариды способны вступать в реакцию гидролиза, катализируемую кислотами, а также различными ферментами. В ходе такой реакции из одной молекулы исходного дисахарида образуется две молекулы моносахарида, которые могут быть как одинаковыми, так и различными в зависимости от состава исходного моносахарида.
Так, например, гидролиз сахарозы приводит к образованию глюкозы и фруктозы в равных количествах:
А при гидролизе мальтозы образуется только глюкоза:
Дисахариды как многоатомные спирты
Дисахариды, являясь многоатомными спиртами, дают соответствующую качественную реакцию с гидроксидом меди (II), т.е. при добавлении их водного раствора ко свежеосажденному гидроксиду меди (II) нерастворимый в воде голубой осадок Cu(OH)2 растворяется с образованием темно-синего раствора.
Полисахариды. Крахмал и целлюлоза
Полисахариды — сложные углеводы, молекулы которых состоят из большого числа остатков моносахаридов, связанных между собой гликозидными связями.
Есть и другое определение полисахаридов:
Полисахаридами называют сложные углеводы, молекулы которых образуют при полном гидролизе большое число молекул моносахаридов.
В общем случае формула полисахаридов может быть записана как (C6H10O5)n.
Крахмал – вещество, представляющее собой белый аморфный порошок, не растворимый в холодной воде и частично растворимый в горячей с образованием коллоидного раствора, называемого в быту крахмальным клейстером.
Крахмал образуется из углекислого газа и воды в процессе фотосинтеза в зеленых частях растений под действием энергии солнечного света. В наибольших количествах крахмал содержится в картофельных клубнях, пшеничных, рисовых и кукурузных зернах. По этой причине указанные источники крахмала и являются сырьем для его получения в промышленности.
Целлюлоза – вещество, в чистом состоянии представляющее собой белый порошок, не растворимый ни в холодной, ни в горячей воде. В отличие от крахмала целлюлоза не образует клейстер. Практически из чистой целлюлозы состоит фильтровальная бумага, хлопковая вата, тополиный пух. И крахмал, и целлюлоза являются продуктами растительного происхождения. Однако, роли, которые они играют в жизни растений, различны. Целлюлоза является в основном строительным материалом, в частности, главным образом ей образованы оболочки растительных клеток. Крахмал же несет в основном запасающую, энергетическую функцию.
Химические свойства крахмала и целлюлозы
Горение
Все полисахариды, в том числе крахмал и целлюлоза, при полном сгорании в кислороде образуют углекислый газ и воду:
Образование глюкозы
При полном гидролизе как крахмала, так и целлюлозы образуется один и тот же моносахарид – глюкоза:
Качественная реакция на крахмал
При действии йода на что-либо, в чем содержится крахмал, появляется синее окрашивание. При нагревании синяя окраска исчезает, при охлаждении появляется вновь.
При сухой перегонке целлюлозы, в частности древесины, происходит ее частичное разложение с образованием таких низкомолекулярных продуктов как метиловый спирт, уксусная кислота, ацетон и т.д.
Поскольку и в молекулах крахмала, и в молекулах целлюлозы имеются спиртовые гидроксильные группы, данные соединения способны вступать в реакции этерификации как с органическими, так и с неорганическими кислотами:
Углеводы в химии — свойства, формула, получение, номенклатура и определение с примерами
Содержание:
Углеводы:
В зависимости от числа атомов углерода в молекуле моносахариды разделяют на несколько групп: тетрозы (четыре атома углерода); пентозы (пять атомов углерода); гексозы (шесть атомов углерода).
К пентозам относятся рибоза
К наиболее известным гексозам относятся глюкоза и фруктоза.
Строение глюкозы
Состав глюкозы выражается молекулярной формулой 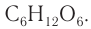
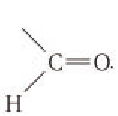
Глюкоза в линейной (открытой) форме содержит альдегидную группу 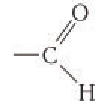
По систематической номенклатуре ИЮПАК альдегидная группа по сравнению с гидроксильной группой является старшей функциональной группой. По этой причине нумерация атомов углерода в молекуле глюкозы начинается с атома углерода альдегидной группы.
Изучение строения глюкозы показало, что приведенная выше линейная форма молекулы существует только в разбавленных растворах небольшой концентрации. В твердом виде глюкоза существует в циклических формах.
Образование циклической формы глюкозы легче понять, если рассмотреть межмолекулярную реакцию присоединения спирта к альдегиду:
Следует обратить внимание, что в результате реакции присоединения из карбонильного атома кислорода альдегида образуется новая гидроксильная группа. Образование связей в молекуле глюкозы происходит таким же образом, но внутримолекулярное так как в ее составе имеются и альдегидная, и гидроксильные группы.
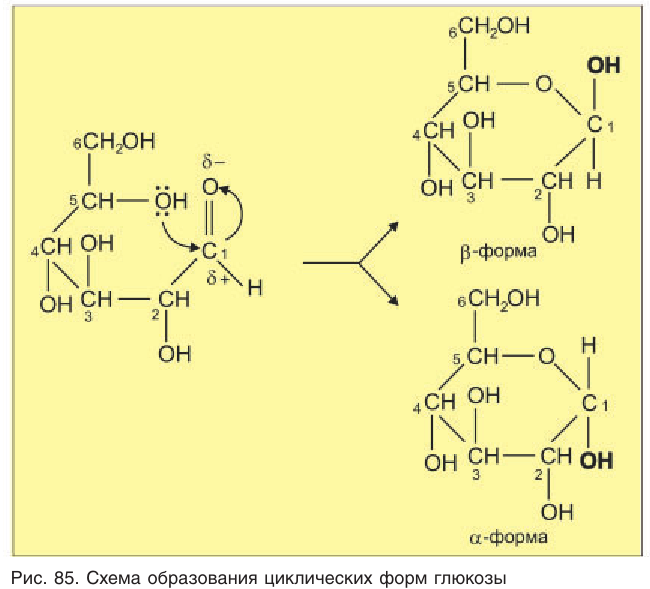
Образование циклической формы происходит за счет взаимодействия неподеленной пары электронов атома кислорода гидроксильной группы с атомом углерода карбонильной группы молекулы глюкозы (рис. 85).
Двойная связь при этом разрывается, и атом водорода гидроксильной группы присоединяется к кислороду карбонильной группы.
Расположение групп атомов в циклической форме молекулы глюкозы не является произвольным, а строго соответствует ее пространственному строению. При таком способе записи циклической формы молекулы глюкозы предполагается, что плоскость цикла перпендикулярна плоскости листа бумаги, а заместители у атомов углерода расположены над и под плоскостью цикла.
Образовавшаяся новая гидроксильная группа (выделена шрифтом) может находиться под циклом или над циклом, что приводит к двум циклическим формам молекулы глюкозы: 
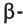
Две циклические формы молекулы глюкозы являются разными веществами. Они отличаются друг от друга физическими свойствами (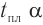
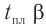
В 
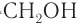
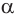
Почему образуются две циклические формы глюкозы? Все три атома альдегидной группы молекулы глюкозы в пространстве находятся в одной плоскости. По этой причине неподеленная электронная пара атома кислорода гидроксильной группы углерода С5 может образовывать химические связи с атомом углерода альдегидной группы как сверху — образуется одна форма, так и снизу — образуется другая форма, т. е. образуются разные пространственные изомеры.
Таким образом, в водном растворе глюкоза одновременно находится в линейной и циклических формах, между которыми устанавливается равновесие.
Модель молекулы глюкозы приведена на рисунке 86.
Фруктоза
Изомерия моносахаридов: В природе существуют другие моносахариды, имеющие такой же молекулярный состав, как и глюкоза, одним из которых является фруктоза. Молекулярная формула фруктозы такая же, как и глюкозы, — 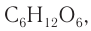
Из структурных формул двух моносахаридов видно отличие в их строении. В молекуле фруктозы содержится кетонная группа 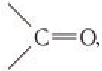
В отличие от молекулы глюкозы, в цикле которой находится пять атомов углерода, цикл молекулы фруктозы содержит четыре атома. Строение циклических форм фруктозы (не для запоминания) изображают следующим образом (обратите внимание, что с целью упрощения символы атомов углерода и связанных с ними атомов водорода опущены):
Физические свойства моносахаридов
Глюкоза и фруктоза — бесцветные кристаллические вещества, хорошо растворимые в воде, сладкие на вкус. В свободном состоянии глюкоза и фруктоза находятся в ягодах, фруктах и сладких овощах. Особенно много глюкозы и фруктозы в равных концентрациях содержится в винограде. В сладких яблоках, грушах и арбузах фруктозы содержится приблизительно в два раза больше, чем глюкозы. Мед (рис. 87) состоит из смеси глюкозы и фруктозы.
В крови человека также содержится глюкоза, ее массовая доля составляет примерно 0,1 %. Содержание глюкозы в крови в процессе жизнедеятельности регулируется естественно образующимся гормоном инсулином. При диабете (сахарной болезни) глюкоза содержится в крови и моче в повышенной концентрации, поэтому людям, страдающим от диабета, требуются ежедневные инъекции инсулина.
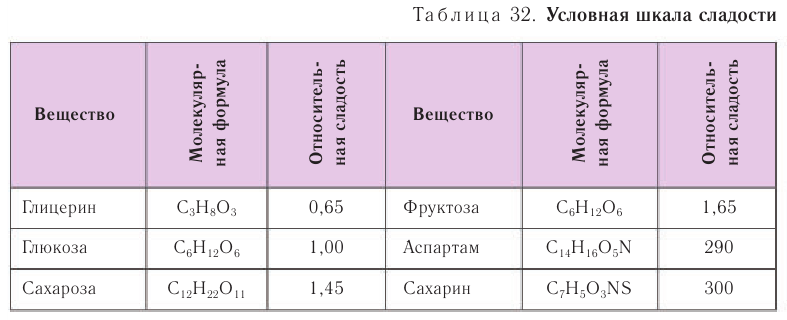
Среди всех моносахаридов фруктоза обладает самым сладким вкусом (табл. 32).
Молекула глюкозы содержит альдегидную группу и пять гидроксильных групп.
В твердом виде глюкоза существует в двух циклических формах. Глюкоза и фруктоза являются изомерами.
Химические свойства, получение и применение глюкозы
Химические свойства. Глюкоза является представителем бифункциональных органических соединений, содержащих в составе молекул две разные функциональные группы 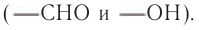
1) Окисление. При взаимодействии раствора глюкозы даже с таким слабым окислителем, как бромная вода, образуется глюконовая кислота: 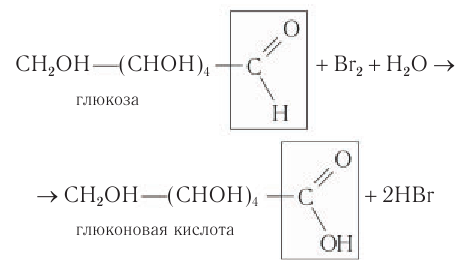
При этом происходит обесцвечивание раствора брома, поэтому данную реакцию можно использовать для определения присутствия альдегидной группы в молекулах глюкозы.
Качественной реакцией на присутствие альдегидной группы служит взаимодействие водного раствора глюкозы с аммиачным раствором оксида серебра(1) при нагревании. Если проводить эту реакцию в пробирке при слабом нагревании, то в результате на стенках пробирки появляется зеркальный налет серебра — реакция серебряного зеркала. Глюкозу относят по этой причине к восстанавливающим сахарам.
Если к свежеполученному гидроксиду меди(II) прибавить раствор глюкозы, появляется интенсивное синее окрашивание, характерное для соединений, содержащих в молекуле две и более гидроксильные группы (качественная реакция на многоатомные спирты). При нагревании вещества наблюдается еще одна качественная реакция окисления глюкозы с образованием красного осадка оксида меди(I). Эту реакцию применяют для количественного определения глюкозы.
Глюкоза при нагревании с аммиачным раствором оксида серебра(1) или щелочным раствором гидроксида меди(II) окисляется в сложную смесь продуктов.
2) Восстановление. Восстановление глюкозы происходит с образованием шестиатомного спирта — сорбита: 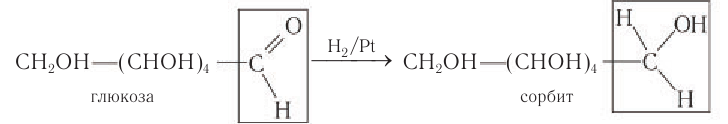
3) Брожение. Глюкоза обладает также некоторыми специфическими свойствами, такими как брожение — деструктивное разложение под действием ферментов. Возможны несколько типов брожения:
Реакции спиртового брожения лежат в основе производства спирта, вин, пива, хлебопечения.
Молочнокислое брожение, вызываемое бактериями рода Lactobacillus, происходит в процессах получения ряда пищевых продуктов (простокваша, кефир и др.), в текстильной и кожевенной промышленности, а также при силосовании кормов.
Получение и применение: В природе глюкоза образуется в процессе фотосинтеза — взаимодействия оксида углерода(IV) и воды в зеленых частях растений под действием солнечного света и в присутствии хлорофилла:
Впервые синтез сахаристых веществ из муравьиного альдегида осуществил в 1861 г. русский ученый А. М. Бутлеров:
В промышленности глюкозу получают гидролизом крахмала в присутствии серной кислоты:
Глюкоза — ценный питательный продукт. Наиболее важная функция глюкозы в организме — обеспечение энергией. При окислении глюкозы в организме выделяется энергия, необходимая для жизнедеятельности человека.
Глюкозу применяют в медицине как питательное вещество и компонент кровозаменяющих противошоковых жидкостей. Кроме того, в медицине широко применяется кальциевая соль глюконовой кислоты (глюконат кальция).
Глюкоза используется для получения витамина С (аскорбиновая кислота), сорбита и биополимеров, а также в кондитерской промышленности.
Для глюкозы характерны реакции окисления, восстановления и ферментативного брожения.
В промышленности глюкозу получают гидролизом крахмала в присутствии серной кислоты.
Глюкоза используется для получения витамина С (аскорбиновая кислота), сорбита и биополимеров, в кондитерской промышленности.
Дисахариды и сахароза
Дисахариды — углеводы, в состав которых входят остатки двух молекул моносахаридов.
Наиболее известными дисахаридами являются сахароза 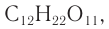
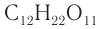
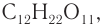
Около 80 % людей, особенно в пожилом возрасте, страдают «непереносимостью» молока и молочных продуктов, и это объясняется небольшой концентрацией или отсутствием фермента лактазы, который участвует в расщеплении углевода лактозы на два моносахарида. У младенцев в организме образуется достаточно лактазы, однако с возрастом ее количество уменьшается.
Сахарозу в быту называют сахаром, это общеизвестный продукт питания. Сахароза содержится в сахарной свекле (17—19 %) и сахарном тростнике (13—15%), из которых и получают свекловичный или тростниковый сахар.
Строение: Молекулярная формула сахарозы 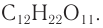
Нагревание раствора сахарозы с аммиачным раствором оксида серебра(1) или с гидроксидом меди(II) не приводит к реакции серебряного зеркала и образованию осадка оксида меди(I). Это говорит о том, что в молекуле сахарозы отсутствует альдегидная группа. Сахарозу по этой причине, в отличие от глюкозы, относят к невосстанавливающим углеводам.
Физические свойства: Сахароза — бесцветное кристаллическое вещество с температурой плавления от 160 до 185 °С, хорошо растворимое в воде, сладкое на вкус. Расплавленная сахароза при застывании превращается в смесь аморфных веществ — карамель, а при выливании на вращающийся холодный барабан превращается в сахарную вату.
Химические свойства: Доказательством того, что сахароза представляет собой дисахарид, служит реакция кислотного гидролиза. При нагревании раствора сахарозы с разбавленной серной кислотой образуются глюкоза и ее изомер фруктоза.
Установлено, что в молекуле сахарозы глюкоза содержится в циклической 
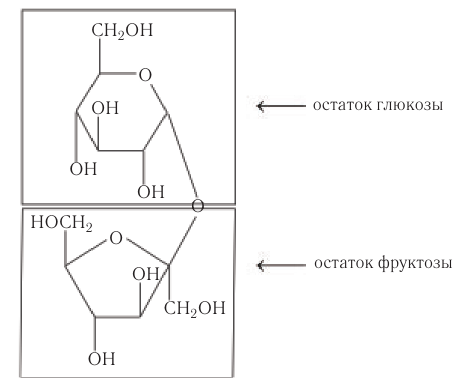
Упрощенное уравнение кислотного гидролиза:
Продукты кислотного гидролиза сахарозы дают реакцию серебряного зеркала.
Под действием концентрированной серной кислоты сахароза способна отщеплять воду (дегидратироваться) с образованием продуктов черного цвета (рис. 88), имеющих сложное циклическое строение. Кроме того, в процессе реакции выделяются значительные количества
Получение и применение: В промышленных масштабах сахарозу получают из сока сахарной свеклы или сахарного тростника. Эти два растения обеспечивают около 90 % мирового производства сахарозы.
Производство сахарозы из сахарной свеклы состоит из нескольких этапов. Вначале клубни сахарной свеклы отмывают от различных загрязнений, измельчают в тонкие стружки, помещают в специальные сосуды, куда пропускают горячую воду. В результате экстракции водой в раствор переходит почти вея сахароза, но одновременно туда переходят различные органические кислоты, белки и красящие вещества.
Полученный раствор обрабатывают известковым молоком (раствор 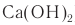
Сахароза является важным продуктом питания, а также используется для приготовления некоторых лекарственных веществ и сиропов для детей. Смесь глюкозы и фруктозы, получающаяся после кислотного гидролиза сахарозы, называют искусственным медом и используют в пищевой промышленности.
Представителями дисахаридов являются сахароза, или обыкновенный сахар, мальтоза и лактоза. Сахароза относится к невосстанавливающим углеводам. При кислотном гидролизе сахарозы образуются глюкоза и фруктоза.
Полисахариды и крахмал
Полисахариды — углеводы, в состав которых входят остатки большого числа молекул моносахаридов.
К полисахаридам относятся крахмал, гликоген и целлюлоза. Полисахариды играют двойственную роль в живой природе: являются источниками химической энергии в организме (крахмал и гликоген) и элементом структуры растений (целлюлоза). Гликоген — резервный полисахарид животных организмов, синтезируется и хранится в печени и мышцах.
В зеленых листьях растений в процессе фотосинтеза образуется глюкоза, из которой в результате реакции поликонденсации, протекающей под действием ферментов, получается крахмал:
Крахмал является наиболее распространенной на земле биомолекулой после целлюлозы. Он содержится во многих растениях и находится в них в виде крахмальных зерен. Больше всего крахмала в злаках. Рис, например, содержит
до 86 % крахмала. В клубнях картофеля крахмала меньше (около 25 %) (табл. 33).
Строение: Крахмальные зерна отличаются по форме и размеру для каждого рода растений и представляют собой смесь двух разных по строению и свойствам полисахаридов: амилозы (20 % по массе) и амилопектина (80 %).
Амилоза — полимер линейного, неразветвленного строения, амилопектин — полимер разветвленного строения. Как амилоза, так и амилопектин состоят из остатков глюкозы в циклической 
Макромолекулы крахмала построены из остатков глюкозы в циклической 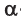
Образование фрагмента макромолекулы крахмала неразветвленного строения в растениях можно представить следующим образом:
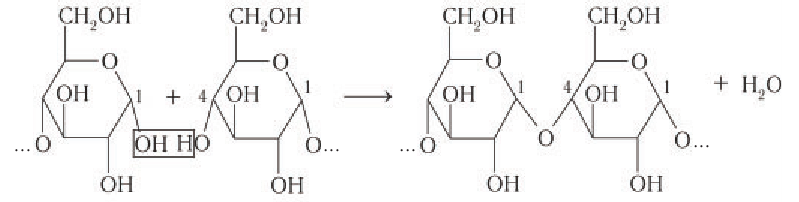
Формулу крахмала изображают в виде
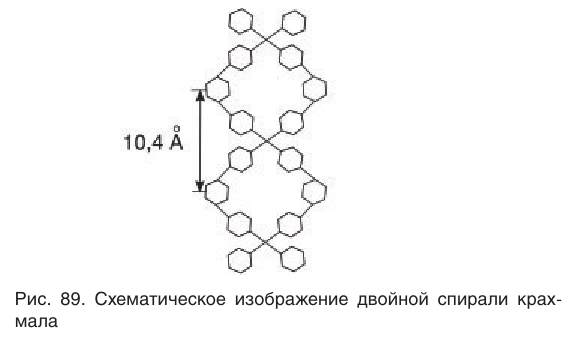
Образование крахмала в растениях является примером реакции поликонденсации, которая сопровождается выделением побочного продукта — молекул воды. Макромолекулы крахмала имеют вид левозакрученной простой или двойной спирали. Каждое звено двойной спирали состоит из шести остатков глюкозы, соединенных друг с другом кислородными мостиками. Упрощенная схема двойной спирали показана на рисунке 89.
Шесть звеньев спирали образуют пространственную структуру крахмала, внутри которой имеются пустоты, частично заполненные молекулами воды («водяные каналы»).
Физические свойства: Крахмал — белый аморфный порошок, нерастворимый в холодной воде. При комнатной температуре крахмал может содержать около 20% воды. Если приготовить суспензию крахмала в воде и нагревать ее, поглощается большее количество воды, и гранулы могут увеличиваться в 100 раз по сравнению с исходным объемом. Крахмал набухает, образуя вязкий гелеподобный раствор, который называют клейстером.
Средняя относительная молекулярная масса амилозы 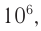
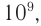
Макромолекулы крахмала состоят из остатков молекул глюкозы в циклической 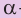
Крахмал состоит как из макромолекул линейного строения (амилоза), так и макромолекул разветвленного строения (амилопектин).
Химические свойства, получение и применение крахмала
Химические свойства:
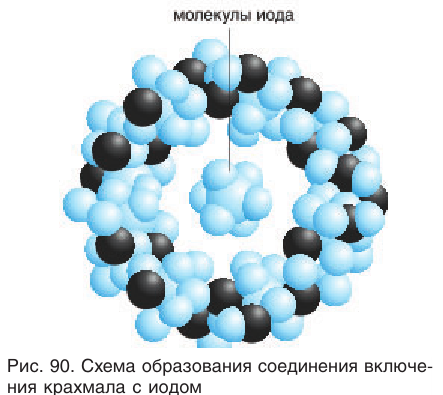
1) Взаимодействие с раствором иода. Характерной реакцией крахмала является его взаимодействие с раствором иода. При действии спиртового раствора иода на раствор клейстера образуется синее окрашивание (качественная реакция). Эта окраска исчезает при нагревании и вновь появляется при охлаждении. Реакция применяется для качественного определения крахмала в пищевых и других продуктах, содержащих крахмал.
Как видно из рисунка 90, молекулы иода входят в полости макромолекулы крахмала с образованием соединений сложного строения (соединения включения). Подобные соединения крахмал образует также с некоторыми спиртами (например, бутанолом-1), жирами и растворителями линейного строения.
Селективное поглощение крахмалом определенных веществ является частным случаем «молекулярного узнавания», когда молекулы некоторых органических соединений реагируют (процесс «узнавания») только с конкретными неорганическими или органическими веществами.
2) Гидролиз. Гидролиз крахмала при кипячении с небольшим количеством серной кислоты (кислотный гидролиз) идет через несколько стадий. Конечным продуктом гидролиза является моносахарид глюкоза.
Промежуточными продуктами кислотного гидролиза крахмала являются декстрины, имеющие молекулярную массу меньше, чем у крахмала, и дисахарид мальтоза.
Общая схема процесса:
Так как происходит постепенное расщепление макромолекул крахмала на более короткие цепи, число 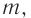
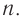
При ферментативном гидролизе образуется преимущественно дисахарид мальтоза, что широко применяется в производстве спирта и пива.
Если вначале выполним гидролиз крахмала, а затем нейтрализуем раствор и при нагревании проведем реакцию с гидроксидом меди(II), то сможем наблюдать осадок оксида меди(I) красного цвета. Это доказывает, что происходит расщепление макромолекул крахмала и образуются вещества, содержащие альдегидную группу Исходный крахмал не образует осадок красного цвета при нагревании с гидроксидом меди(II), так как не содержит альдегидную группу.
Получение и применение: В промышленности крахмал получают из картофеля, кукурузы или риса. Способ выделения заключается в промывании водой, которая растворяет крахмал легче, чем остальные компоненты.
Крахмал является важнейшим источником углеводов для организма. Углеводы, необходимые организму, поступают в достаточном количестве в виде крахмала, содержащегося в хлебе, картофеле и различных крупах. Поддействи-ем ферментов пищеварительного тракта крахмал и дисахариды подвергаются гидролизу до глюкозы. Избыток глюкозы сохраняется организмом в мышцах и печени в виде полисахарида гликогена.
Крахмал применяется в пищевой и фармацевтической промышленности, в качестве клеев в текстильной, бумажной и полиграфической промышленности, для производства глюкозы.
Качественной реакцией на крахмал является реакция с иодом. Промежуточными продуктами гидролиза крахмала являются декстрины и мальтоза. Конечным продуктом гидролиза является глюкоза.
Целлюлоза
Целлюлоза, как крахмал и гликоген, относится к природным полимерам. Макромолекулы целлюлозы входят в состав оболочек клеток всех растений. Название вещества происходит от латинского слова «cellula», что в переводе означает «клетка». Волокна хлопка, льна и конопли в основном состоят из целлюлозы (до 99 %), а в древесине она составляет около 50 % в расчете на сухое вещество. Образцом практически чистой целлюлозы является вата, полученная из хлопка.
Строение: Формула целлюлозы 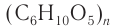
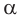
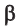
Макромолекулы целлюлозы построены из остатков глюкозы в циклической 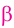
Схема строения макромолекулы целлюлозы:
Обратите внимание, что в структуре макромолекул целлюлозы каждое второе кольцо остатка глюкозы повернуто на 180° относительно первого, что обеспечивает плотную упаковку цепей макромолекул целлюлозы. Так как каждый остаток глюкозы содержит три гидроксильные группы, то между цепями макромолекул целлюлозы образуются прочные межмолекулярные водородные связи. Это также увеличивает механическую прочность целлюлозы но сравнению с прочностью крахмала. Благодаря механической прочности целлюлоза служит конструкционным материалом растений.
Подобно целлюлозе в растениях, основным компонентом наружного скелета ракообразных (рис. 91) и некоторых насекомых является аминополисахарид хитин. Отличие хитина от целлюлозы в том, что каждый остаток глюкозы вместо одной из гидроксильных групп содержит ацетамидную группу —
В организме человека отсутствует фермент, способный расщеплять химические связи целлюлозы, образованные за счет остатков глюкозы в циклической 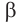
Кроме остатков глюкозы, в составе древесины находятся другие органические вещества, среди которых наиболее известен лигнин. Макромолекула лигнина в основном состоит из остатков ароматических соединении. Древесина хвойных пород содержит до 30 % лигнина. Лигнин является негидролизуемой частью древесины.
Изучение строения целлюлозы свидетельствует о том, что каждый остаток глюкозы в макромолекуле целлюлозы содержит три гидроксильные группы. Поэтому формулу структурного звена целлюлозы можно записать в таком виде:
Наличие гидроксильных групп в структурном звене макромолекулы целлюлозы позволяет получать различные ее производные, которые будут описаны в следующем параграфе.
Физические свойства: Целлюлоза представляет собой белое аморфное вещество. Она не растворяется ни в воде, ни в обычных органических растворителях, однако может поглощать около 10 % воды. При нагревании целлюлоза обугливается и образует смеси различных органических соединений.
Формула целлюлозы
Макромолекулы целлюлозы построены из остатков глюкозы в циклической 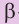
Химические свойства и применение целлюлозы
Целлюлоза является чрезвычайно важным сырьем для различных отраслей промышленности, хотя и имеет низкую реакционную способность. Например, текстильная промышленность использует природные волокна льна, хлопка и др., не подвергая их химической обработке.
Наиболее старым химическим способом переработки древесины является сухая перегонка. Нагреванием древесины без доступа воздуха получают древесный уголь. В этих условиях при разложении древесины одновременно образуются метан, метанол, уксусная кислота и ацетон
Для получения искусственных волокон целлюлозу подвергают химической обработке. Химической переработке подвергается в основном целлюлоза, получаемая из древесины, хотя в некоторых случаях можно использовать целлюлозу соломы или различных трав. Вначале из древесины сульфитной или сульфатной варкой в жестких условиях получают сырую целлюлозу, которую затем отбеливают различными способами. Для получения вискозных волокон целлюлозу в щелочном растворе обрабатывают сероуглеродом 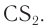
1) Гидролиз. Целлюлоза так же, как и крахмал, может подвергаться гидролизу с образованием конечного продукта — глюкозы:
Глюкозу, полученную из остатков древесины в результате спиртового брожения, перерабатывают в этиловый спирт и используют в смеси с бензином в качестве биотоплива. Полученный этиловый спирт называют гидролизным и используют также в качестве технического спирта, потому что он может содержать небольшое количество токсичного метилового спирта.
2) Образование сложных эфиров. Для целлюлозы, благодаря наличию гидроксильных групп, характерна реакция этерификации с образованием сложных эфиров. Для получения три-ацетилцеллюлозы целлюлозу обрабатывают ангидридом уксусной кислоты 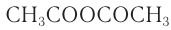
Этерификация целлюлозы уксусным ангидридом приводит к тому, что триацетилцеллюлоза оказывается способной растворяться в органических растворителях.
При использовании в качестве ацилирующего агента уксусной кислоты из целлюлозы образуется смесь моно- и диацетилцеллюлозы.
При частичном омылении триацетилцеллюлозы получают ацетилцеллюлозу, раствор которой в ацетоне применяют для формования нитей ацетатного волокна. Ацетатное волокно относится к химическим искусственным волокнам (см. рис. 77).
Сложные эфиры образуются также при обработке целлюлозы азотной кислотой в присутствии серной кислоты:
Тринитропроизводные целлюлозы (пироксилин) находят применение в качестве сырья для производства бездымного пороха.
Хлопковые, льняные и другие волокна используются как текстильное сырье, а древесина в основном применяется для производства бумаги.
Целлюлоза подвергается гидролизу с образованием конечного продукта — глюкозы.
Благодаря наличию гидроксильных групп целлюлоза реагирует с кислотами с образованием сложных эфиров.
| Рекомендую подробно изучить предметы: |
|
| Ещё лекции с примерами решения и объяснением: |
- Амины в химии
- Белки в химии
- Группа углерода
- Углеводороды в химии
- Альдегиды в химии
- Карбоновые кислоты в химии
- Сложные эфиры в химии
- Жиры в химии
При копировании любых материалов с сайта evkova.org обязательна активная ссылка на сайт www.evkova.org
Сайт создан коллективом преподавателей на некоммерческой основе для дополнительного образования молодежи
Сайт пишется, поддерживается и управляется коллективом преподавателей
Whatsapp и логотип whatsapp являются товарными знаками корпорации WhatsApp LLC.
Cайт носит информационный характер и ни при каких условиях не является публичной офертой, которая определяется положениями статьи 437 Гражданского кодекса РФ. Анна Евкова не оказывает никаких услуг.