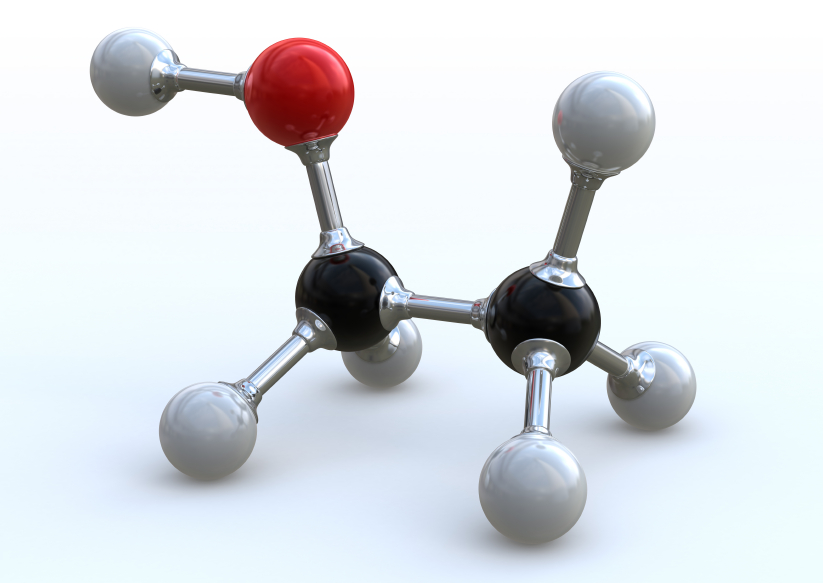
Этанол C2H5OH или CH3CH2OH, этиловый спирт – это органическое вещество, предельный одноатомный спирт .
Общая формула предельных нециклических одноатомных спиртов: CnH2n+2O.
- Строение этанола
- Водородные связи и физические свойства спиртов
- Изомерия спиртов
- Структурная изомерия
- Химические свойства этанола
- 1.1. Взаимодействие с раствором щелочей
- 1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
- 2. Реакции замещения группы ОН
- 2.1. Взаимодействие с галогеноводородами
- 2.2. Взаимодействие с аммиаком
- 2.3. Этерификация (образование сложных эфиров)
- 2.4. Взаимодействие с кислотами-гидроксидами
- 3. Реакции замещения группы ОН
- 3.1. Внутримолекулярная дегидратация
- 3.2. Межмолекулярная дегидратация
- 4. Окисление этанола
- 4.1. Окисление оксидом меди (II)
- 4.2. Окисление кислородом в присутствии катализатора
- 4.3. Жесткое окисление
- 4.4. Горение спиртов
- 5. Дегидрирование этанола
- Получение этанола
- 1. Щелочной гидролиз галогеналканов
- 2. Гидратация алкенов
- 3. Гидрирование карбонильных соединений
- 4. Получение этанола спиртовым брожением глюкозы
- Формула вещества C2H5OH написать уравнение химической реакции подтверждающие его химические свойства?
- Запишите уравнения химических реакций, подтверждающих химические свойства кислот (на примере соляной кислоты)?
- MGO и H2SO4 составить уравнение реакции подтверждающие их свойства и определить типы химических реакций?
- Написать 5 уравнений химических реакций, подтверждающих химические свойства алканов, на примере бутана?
- Уравнения реакций подтверждающих химические свойства Na (натрий)?
- Составьте уравнения реакций подтверждающих химические свойства пропана?
- СРОЧНО?
- Написать уравнение реакций химические свойства KOH?
- Напишите уравнения реакций, подтверждающих отличие химических свойств фенола от предельных одноатомных спиртов?
- Составить уравнения реакций подтверждающие химические свойства раствора серной кислоты?
- Приведите уравнения реакций, подтверждающие важнейшие химические свойства алкенов на примере пропета?
- С2Н5ОН: название вещества, получение, свойства этанола, виды, безопасность, применение и назначение
- Внешний вид С2Н5ОН
- Основные свойства
- Получение
- Виды этанола
- Безопасность
- Применение и назначение
- Заключение
Видео:Химические Цепочки — Решение Цепочек Химических Превращений // Химия 8 классСкачать

Строение этанола
В молекулах спиртов, помимо связей С–С и С–Н, присутствуют ковалентные полярные химические связи О–Н и С–О.
| Электроотрицательность кислорода (ЭО = 3,5) больше электроотрицательности водорода (ЭО = 2,1) и углерода (ЭО = 2,4). |
Электронная плотность обеих связей смещена к более электроотрицательному атому кислорода:
| Атом кислорода в спиртах находится в состоянии sp 3 -гибридизации. |
В образовании химических связей с атомами C и H участвуют две 2sp 3 -гибридные орбитали, а еще две 2sp 3 -гибридные орбитали заняты неподеленными электронными парами атома кислорода.
Поэтому валентный угол C–О–H близок к тетраэдрическому и составляет почти 108 о .
Водородные связи и физические свойства спиртов
Спирты образуют межмолекулярные водородные связи. Водородные связи вызывают притяжение и ассоциацию молекул спиртов:
Поэтому этанол – жидкость с относительно высокой температурой кипения (температура кипения этанола +78 о С).
Водородные связи образуются не только между молекулами спиртов, но и между молекулами спиртов и воды. Поэтому спирты очень хорошо растворимы в воде. Молекулы спиртов в воде гидратируются:
| Чем больше углеводородный радикал, тем меньше растворимость спирта в воде. Чем больше ОН-групп в спирте, тем больше растворимость в воде. |
Этанол смешивается с водой в любых соотношениях.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Изомерия спиртов
Видео:Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Структурная изомерия
Для этанола характерна структурная изомерия – межклассовая изомерия.
Межклассовые изомеры — это вещества разных классов с различным строением, но одинаковым составом. Спирты являются межклассовыми изомерами с простыми эфирами. Общая формула и спиртов, и простых эфиров — CnH2n+2О.
| Например. Межклассовые изомеры с общей формулой С2Н6О этиловый спирт СН3–CH2–OH и диметиловый эфир CH3–O–CH3 |
| Этиловый спирт | Диметиловый эфир |
| СН3–CH2–OH | CH3–O–CH3 |
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Химические свойства этанола
Спирты – органические вещества, молекулы которых содержат, помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.
1. Кислотные свойства
| Спирты – неэлектролиты, в водном растворе не диссоциируют на ионы; кислотные свойства у них выражены слабее, чем у воды. |
1.1. Взаимодействие с раствором щелочей
При взаимодействии этанола с растворами щелочей реакция практически не идет, т. к. образующийся алкоголят почти полностью гидролизуется водой.
Равновесие в этой реакции так сильно сдвинуто влево, что прямая реакция не идет. Поэтому этанол не взаимодействуют с растворами щелочей.
1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
Этанол взаимодействует с активными металлами (щелочными и щелочноземельными).
| Например, этанол взаимодействует с калием с образованием этилата калия и водорода . |
Алкоголяты под действием воды полностью гидролизуются с выделением спирта и гидроксида металла.
| Например, этилат калия разлагается водой: |
Видео:СОЛИ ХИМИЯ 8 КЛАСС: Химические Свойства Солей и Получение // Реакция Солей с Кислотами и МеталламиСкачать

2. Реакции замещения группы ОН
2.1. Взаимодействие с галогеноводородами
При взаимодействии спиртов с галогеноводородами группа ОН замещается на галоген и образуется галогеналкан.
| Например, этанол реагирует с бромоводородом. |
2.2. Взаимодействие с аммиаком
Гидроксогруппу спиртов можно заместить на аминогруппу при нагревании спирта с аммиаком на катализаторе.
| Например, при взаимодействии этанола с аммиаком образуется этиламин. |
2.3. Этерификация (образование сложных эфиров)
Одноатомные и многоатомные спирты вступают в реакции с карбоновыми кислотами, образуя сложные эфиры.
| Например, этанол реагирует с уксусной кислотой с образованием этилацетата (этилового эфира уксусной кислоты): |
2.4. Взаимодействие с кислотами-гидроксидами
Спирты взаимодействуют и с неорганическими кислотами, например, азотной или серной.
| Например, при взаимодействии этанола с азотной кислотой образуется сложный эфир этилнитрат : |
Видео:ВСЕ ПРО АЛКАНЫ за 8 минут: Химические Свойства и ПолучениеСкачать

Видео:Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

3. Реакции замещения группы ОН
В присутствии концентрированной серной кислоты от спиртов отщепляется вода. Процесс дегидратации протекает по двум возможным направлениям: внутримолекулярная дегидратация и межмолекулярная дегидратация.
3.1. Внутримолекулярная дегидратация
При высокой температуре (больше 140 о С) происходит внутримолекулярная дегидратация и образуется соответствующий алкен.
| Например, из этанола под действием концентрированной серной кислоты при температуре выше 140 градусов образуется этилен: |
Видео:Химия 9 класс (Урок№14 - Азот: свойства и применение. Аммиак. Физические и химические свойства.)Скачать

В качестве катализатора этой реакции также используют оксид алюминия.
3.2. Межмолекулярная дегидратация
При низкой температуре (меньше 140 о С) происходит межмолекулярная дегидратация по механизму нуклеофильного замещения: ОН-группа в одной молекуле спирта замещается на группу OR другой молекулы. Продуктом реакции является простой эфир.
| Например, при дегидратации этанола при температуре до 140 о С образуется диэтиловый эфир: |
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

4. Окисление этанола
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на каталитическое, мягкое и жесткое.
| При окислении первичных спиртов они последовательно превращаются сначала в альдегиды, а потом в карбоновые кислоты. Глубина окисления зависит от окислителя. Первичный спирт → альдегид → карбоновая кислота |
Типичные окислители — оксид меди (II), перманганат калия KMnO4, K2Cr2O7, кислород в присутствии катализатора.
4.1. Окисление оксидом меди (II)
Cпирты можно окислить оксидом меди (II) при нагревании. При этом медь восстанавливается до простого вещества.
| Например, этанол окисляется оксидом меди до уксусного альдегида |
4.2. Окисление кислородом в присутствии катализатора
Cпирты можно окислить кислородом в присутствии катализатора (медь, оксид хрома (III) и др.).
4.3. Жесткое окисление
При жестком окислении под действием перманганатов или соединений хрома (VI) первичные спирты окисляются до карбоновых кислот.
| Например, при взаимодействии этанола с перманганатом калия в серной кислоте образуется уксусная кислота |
4.4. Горение спиртов
Образуются углекислый газ и вода и выделяется большое количество теплоты.
| Например, уравнение сгорания этанола: |
Видео:Решение цепочек превращений по химииСкачать

5. Дегидрирование этанола
При нагревании спиртов в присутствии медного катализатора протекает реакция дегидрирования.
| Например, при дегидрировании этанола образуется этаналь |
Видео:Расчеты по уравнениям химических реакций. 1 часть. 8 класс.Скачать

Получение этанола
Видео:Как составлять ХИМИЧЕСКИЕ УРАВНЕНИЯ | 4 лайфхака - 95 ВСЕХ РЕАКЦИЙ в химии!Скачать

1. Щелочной гидролиз галогеналканов
При взаимодействии галогеналканов с водным раствором щелочей образуются спирты. Атом галогена в галогеналкане замещается на гидроксогруппу.
| Например, при нагревании хлорэтана с водным раствором гидроксида натрия образуется этанол |
Видео:Химические уравнения. Как составлять химические уравнения.Скачать

2. Гидратация алкенов
Гидратация (присоединение воды) алкенов протекает в присутствии минеральных кислот. При присоединении воды к алкенам образуются спирты.
| Например, при взаимодействии этилена с водой образуется этиловый спирт. |
Видео:Это Самый Простой Урок Химии. Химия с нуля — АмфотерностьСкачать

3. Гидрирование карбонильных соединений
Присоединение водорода к альдегидам и кетонам протекает при нагревании в присутствии катализатора. При гидрировании альдегидов образуются первичные спирты, при гидрировании кетонов — вторичные спирты, а из формальдегида образуется метанол.
| Например, при гидрировании этаналя образуется этанол |
Видео:Как составить формулу вещества по названию. Как записать химическую формулу.Скачать

Видео:Химическая формула вещества. Видеоурок по химии 8 классСкачать

4. Получение этанола спиртовым брожением глюкозы
Для глюкозы характерно ферментативное брожение, то есть распад молекул на части под действием ферментов. Один из вариантов — спиртовое брожение.
Видео:Химические уравнения. Урок 15. Химия 7 классСкачать

Формула вещества C2H5OH написать уравнение химической реакции подтверждающие его химические свойства?
Химия | 10 — 11 классы
Формула вещества C2H5OH написать уравнение химической реакции подтверждающие его химические свойства.
Сгорает с выделением тепла
C2H5OH + 3O2 = 2CO2 + 3H2O
взаимодействует с щелочными металлами
2С2Н5ОН + 2К = 2С2Н5ОК + Н2.
Видео:Химия 8 класс (Урок№5 - Закон постоянства состава веществ. Химические формулы.)Скачать

Запишите уравнения химических реакций, подтверждающих химические свойства кислот (на примере соляной кислоты)?
Запишите уравнения химических реакций, подтверждающих химические свойства кислот (на примере соляной кислоты).
Видео:Химия | Тепловой эффект химической реакции (энтальпия)Скачать

MGO и H2SO4 составить уравнение реакции подтверждающие их свойства и определить типы химических реакций?
MGO и H2SO4 составить уравнение реакции подтверждающие их свойства и определить типы химических реакций.
Видео:25. Схема реакции и химическое уравнениеСкачать

Написать 5 уравнений химических реакций, подтверждающих химические свойства алканов, на примере бутана?
Написать 5 уравнений химических реакций, подтверждающих химические свойства алканов, на примере бутана.
Дать названия всем органическим веществам.
Уравнения реакций подтверждающих химические свойства Na (натрий)?
Уравнения реакций подтверждающих химические свойства Na (натрий).
Составьте уравнения реакций подтверждающих химические свойства пропана?
Составьте уравнения реакций подтверждающих химические свойства пропана.
СРОЧНО?
Химические свойства спиртов.
Помогите, пожалуйста, дописать уравнения реакций.
Написать уравнение реакций химические свойства KOH?
Написать уравнение реакций химические свойства KOH.
Напишите уравнения реакций, подтверждающих отличие химических свойств фенола от предельных одноатомных спиртов?
Напишите уравнения реакций, подтверждающих отличие химических свойств фенола от предельных одноатомных спиртов.
Составить уравнения реакций подтверждающие химические свойства раствора серной кислоты?
Составить уравнения реакций подтверждающие химические свойства раствора серной кислоты.
Приведите уравнения реакций, подтверждающие важнейшие химические свойства алкенов на примере пропета?
Приведите уравнения реакций, подтверждающие важнейшие химические свойства алкенов на примере пропета.
Назовите все вещества.
Вопрос Формула вещества C2H5OH написать уравнение химической реакции подтверждающие его химические свойства?, расположенный на этой странице сайта, относится к категории Химия и соответствует программе для 10 — 11 классов. Если ответ не удовлетворяет в полной мере, найдите с помощью автоматического поиска похожие вопросы, из этой же категории, или сформулируйте вопрос по-своему. Для этого ключевые фразы введите в строку поиска, нажав на кнопку, расположенную вверху страницы. Воспользуйтесь также подсказками посетителей, оставившими комментарии под вопросом.
Ответ : 25 лДано : V(N₂) = 50 лV(NO) — ? Объяснение : N₂ + O₂ = 2NOИз уравнения реакции видно, что V(N₂) = 0, 5V(NO)V(N₂) = 0, 5 * 50 л = 25 лОтвет : 25 л.
Вот смотри и щас еще кинк.
Амфотерные — АL(OH)3, Zn(OH)2, Fe(OH)3. Основные — Ca(OH)2. Кислоты — H3SO4, HNO3. СТАВЬ СПАСИБО.
[Ca(NH₃)₃(H₂O)]Cl₂ хлорид акватриамминкальция.
Плюсовий, його заряд завжди такий.
Дано m(ppa NaOH) = 200 g W(NaOH) = 2% m(ppa HCL) = 100 g W(HCL) = 4% — — — — — — — — — — — — — — — — — — — — — — — — — — — m(NaCL) — ? M(NaOH) = 200 * 2% / 100% = 4 g m(HCL) = 100 * 4% / 100% = 4g M(NaOH) = 40 g / mol n(NaOH) = m / M = 4 / 40 = 0. ..
Решение находится на фото.
Да, потому что Ca является металлом , а к. О SO4 не металл.
36 + 10 = 56 г 55 разделить 5 = 11.
А) 3 молекулы воды б) 2 молекулы диоксида углерода в) 5 молекул карбоната кальция г) 3 молекулы серной кислоты д) 4 молекулы хлорида натрия.
С2Н5ОН: название вещества, получение, свойства этанола, виды, безопасность, применение и назначение
- 14 Апреля, 2019
- Прочие препараты
- Ольга Ямзакова
Многим из нас известно, что такое С2Н5ОН. Название вещества — этиловый спирт. Не одно десятилетие данное соединение успешно используется в самых разных сферах деятельности человека, и, пожалуй, каждому доводилось сталкиваться с ним. Поэтому ниже расскажем более подробно о свойствах вещества, его назначении и мерах безопасности.
Внешний вид С2Н5ОН
Название вещества, которое употребляется обывателями чаще других, — просто «спирт». Соединение интересно своими свойствами. Чтобы ответить на вопрос о том, что это — c2h5oh, нужно изучить его внешний вид и ряд особенностей.
Визуально вещество представляет собой бесцветный прозрачный раствор, который имеет резкий алкогольный запах и жгучий вкус.
Основные свойства
Соединение является летучим, очень легко воспламеняется, смешивается с водой во всех соотношениях. Температура кипения спирта составляет +78 градусов Цельсия, а замерзания — минус 117. Структурная формула соединения представлена на рисунке, а обозначается по-научному как С2Н5ОН.
Названий вещества существует несколько. Его можно именовать как метилкарбинол, винный спирт, алкоголь и так далее. Глядя на формулу, становится понятно, что спирт состоит из двух атомов углерода, шести атомов водорода и одного — кислорода.
Получение
Несмотря на то что названий вещества С2Н5ОН существует множество, образуется оно всего лишь двумя путями:
- Синтетический, когда применяются химические реактивы.
- Натуральный, для чего используется природное сырье.
Синтетический путь более выгоден экономически. Реакция получения вещества С2Н5ОН проводится в две стадии:
- Сначала на этилен воздействуют сульфатной кислотой, в результате чего образуется сульфатноэтиловый эфир.
- Затем этот эфир взаимодействует с водой, и появляется этиловый спирт и кислота как побочный продукт.
Существует также способ получения спирта из природного сырья. Рассмотрим его более подробно. В качестве источника необходимо использовать сахаристые вещества, которые затем подвергаются брожению. Это может быть картофель, маис, рожь и тому подобное.
- Сырье отмывают, помещают в специальное устройство, в котором оказывается воздействие давлением в 2-3 атм. рт. ст. При этом крахмал, содержащийся, например, в картофеле, превращается в клейстер.
- Полученную массу энергетически размешивают и охлаждают до температуры 50 градусов.
- Затем добавляют солод, перемешивают. Получается так называемая «бражка». Содержание спирта в ней составляет примерно 18 %.
- Всю остальную массу представляют собой побочные продукты брожения: глицерол, этаналь (ацетатный альдегид), высшие спирты, эфиры и т. д.
- Бражку подвергают процессу ректификации (разделения смеси на компоненты за счет теплообмена между паром и жидкостью). Причем сначала образуется спирт с концентрацией 70 %. Постепенно эта цифра увеличивается до 96 %.
- Для закрепления результата раствор прогоняют через адсорбент. Например, активированный уголь.
Виды этанола
Чтобы узнать, какое вещество С2Н5ОН, следует разобрать его состав. В зависимости от характеристик этанол можно поделить на четыре основных вида:
- Сырец. Второе наименование вещества С2Н5ОН в этом случае — неочищенный спирт. Концентрация этанола варьируется от 92 до 95 градусов. Он считается очищенным от примесей и сивушных масел в недостаточной степени.
- Ректифицированный (95-96 °С). Данный вид практически не содержит в себе посторонних соединений.
- Абсолютный спирт. Название c2h5oh в этом случае — чистый этанол. Такое соединение практически безводно.
- И последний вид — спирт денатурированный. Это неочищенное вещество с добавлением азотистых оснований пиридина. Такое вещество подойдет для использования в технических целях.
Безопасность
Дело в том, что этиловый спирт — токсичное соединение. В высоких концентрациях оно оказывает сильное влияние на работу центральной нервной, сердечно-сосудистой и пищеварительной систем. Поэтому очень важно соблюдать правила безопасности при обращении с С2Н5ОН.
- Конечно, спирт очень токсичен в высоких концентрациях. Стоит учитывать такую закономерность: чем менее очищен спирт, тем он более вреден. Касается это как употребления внутрь, так и вдыхания паров.
- Этиловый спирт может быть опасен не только при приеме внутрь, но и при вдыхании его паров. При превышении допустимой предельной концентрации паров спирта в воздухе (1 000 мг/м3) возможен ожог и повреждение слизистой верхних дыхательных путей. Поэтому на производстве этанола сотрудники большую часть времени должны находиться в противогазе.
- В случае повреждения дыхательных путей человека нужно вывести на свежий воздух, при необходимости сделать искусственное дыхание. При отравлении спиртом в результате приема внутрь следует промыть желудок водой или раствором соды в концентрации 2 %.
- При воздействии на целостные кожные покровы спирт не оказывает токсичного воздействия. Однако поверхность тела может стать сухой, шелушащейся, с многочисленными трещинами.
- Этиловый спирт достаточно легко воспламеняется, поэтому категорически запрещено подносить его к источнику открытого огня.
- Всем известно, что этиловый спирт можно употреблять внутрь для расслабления. Однако стоит сказать, что злоупотреблять этим нельзя. Дело в том, что этанол очень быстро может вызвать стойкую зависимость у человека, а также изменение психики и сознания.
- Нужно следить за тем, чтобы тара с опасным веществом всегда хранилась вне зоны доступа маленьких детей.
Применение и назначение
Этиловый спирт имеет довольно широкую область применения, основное значение уделяется ему в медицине. Вещество c2h5oh с названием «этанол» может быть использовано:
- Как антисептик. Благодаря тому что спирт эффективно уничтожает все патогенные микроорганизмы, его широко используют в медицинской практике. Например, обрабатывают операционное поле перед хирургическим вмешательством или перед забором крови. Протирая участок кожи, медик добивается этим стерильности, чтобы снизить риск развития инфекции до минимума.
- Еще одно широкое медицинское применение спирта — в качестве растворителя. На основе спирта делается огромное количество настоек. Он сохраняет полезные свойства целебных трав.
- Также спирт известен своими согревающими свойствами, поэтому часто его используют для изготовления лечебных компрессов при травмах.
- Кроме того, этиловый спирт является лучшим противоядием при отравлении таким жизненно опасным веществом, как метилен.
- В косметических целях спирт и настойки на нем эффективно применяются для лечения акне, угревой сыпи. Однако стоит помнить, что этанол сильно сушит кожу, поэтому злоупотреблять процедурой не нужно.
И это далеко не все варианты возможного применения этанола.
Заключение
Этиловый спирт — универсальное средство, с которым приходилось сталкиваться любому человеку. Во многих ситуациях данное соединение значительно облегчает жизнь. Однако всегда стоит учитывать свойства вещества и меры безопасности при использовании этанола.