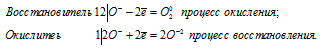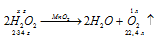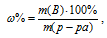Задача 797.
Указать способы получения пероксида водорода, привести уравнения реакций.
Решение:
В промышленности пероксид водорода получают электрохимическим методами, например, анодным окислением растворов H2SO4 или (NH4)HSO4 с последующим гидролизом образующейся при этом пероксодвусерной ислоты H2S2O8.
При электролизе H2SO4 (50% раствор) на катоде разряжаются ионы водорода Н + , а на аноде — HSО4 — . Последние, теряя свои заряды, соединяясь попарно, образуют перокусодвусерную кислоту:
На катоде: 2Н + + 2 
На аноде: 2HSО4 — — 2 
или 2H2SO4 = H2S2O8 + 2H + + 2
При электролизе (NH4)HSO4 на катоде разряжается молекулы воды, а на аноде — HSО4 — . Последние, теряя свои заряды, соединяясь попарно, образуют перокусодвусерную кислоту:
На катоде: 2Н2О + 2 
На аноде: 2HSО4 — — 2 
Далее перокидвусерная кислота подвергается гидролизу, сопровождающемуся образованием серной кислоты и пероксида водорода:
Фактически электролиз протекает до тех пор пока в рабочем растворе не закончится или H2SO4, или (NH4)HSO4.
Задача 798.
Можно ли получить Н2О2. непосредственным взаимодействием водорода и кислорода? Ответ обосновать.
Решение:
Пероксид водорода образуется в качестве промежуточного продукта при горении водорода:
Но ввиду высокой температуры водородного пламени тотчас же разлагается на воду и кислород (2Н2О2 ) ⇔ 2Н2О + О2). Однако, если направить водородное пламя на кусок льда, то в образующейся воде можно обнаружить следы пероксида водорода. Пероксид водорода можно получить при действии атомарного водорода на кислород.
Таким образом, непосредственным взаимодействием водорода и кислорода пероксид водорода невыгодно получать ни в лаборатории, ни в промышленности.
Задача 799.
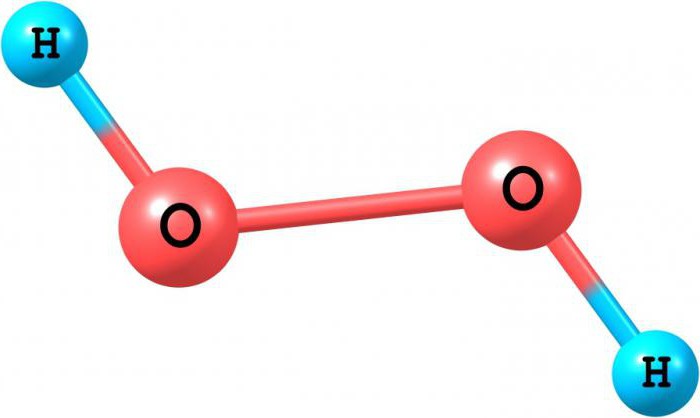
Описать строение молекулы Н2О2. Почему эта молекула полярна?
Решение:
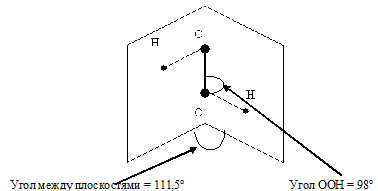
Молекула H2O2 неплоская, имеет строение H−O−O−H с 
Степень окисления кислорода равна −I, валентность атома O равна 2. Группу −O−O− называют пероксогруппой. Энергия связи О—О (210 кДж/моль) почти в 2 раза меньше энергии связи О—Н (468 кДж/моль), длина связи О—О равна 0,145нм. Из-за несимметричного распределения связей Н — О молекула Н2О2 сильно полярна. Между молекулами Н2О2 возникает довольно прочная водородная связь, поэтому в обычных условиях Н2О2 – сиропообразная светло-голубая жидкость с высокой температурой кипения равной 150 °С. Температура плавления 0,41°С. Почти в 1.5 раза тяжелее воды, поверхностное натяжение ( 
Задача 800.
Написать уравнение реакции разложения пероксида водорода. К какому типу окислительно-восстановительных реакций она относится?
Решение:
Уравнение реакции разложения пероксида водорода имеет вид:
Данная реакция относится к окислительно-восстановительным реакциям самоокисления-самовосстановления, потому что пероксид водорода в реакции разложения является и восстановителем, и окислителем одновременно. Степень окисления кислорода изменяется от -1 до -2 (восстановление) и от -1 до 0 (окисление), потому что кислород в пероксиде водорода находится в своей промежуточной степени окисления (-1).
Уравнения электронного баланса:
4О — = О2 0 + 2О 2-
Задача 801.
К 150 г раствора Н2О2 прибавили немного диоксида марганца. Выделившийся кислород при нормальных условиях занял объем 10 -3 м 3 . Вычислить массовую долю Н2О2 в исходном растворе.
Решение:
Уравнение реакции имеет вид:
М(Н2О2) = 34г/моль; m(H2O2) = 34г.
Находим массу разложившегося пероксида водорода из пропорции:
х : 68 = 1 : 22,4;
х = (1,68)/22,4 = 3,04г.
Массовую долю пероксида водорода находим из уравнения:
где w% — массовая доля вещества В; m(B) – масса вещества В; m(р-ра) – масса раствора.
- Разложение пероксида водорода
- Каталитическое разложение пероксида водорода
- Лабораторное разложение перекиси водорода
- Активность катализатора
- Опыт разложение пероксида водорода
- Физические свойства пероксида водорода Н2О2
- Можно ли получить перекись водорода из водорода и кислорода
- Похожие страницы:
- Leave a Comment
- H2O2 — что это за вещество?
- H2O2 – что это за вещество?
- Химические свойства Н2О2
- Реакция разложения как метод получения кислорода
- История открытия перекиси
- Перекись водорода в XX веке
- Где применяется Н2О2 сейчас?
- Применение Н2О2 в быту
- Перекись водорода в природе
- Опасность перекиси при употреблении внутрь
- Меры безопасности в обращении с Н2О2
- 📹 Видео
Видео:Опыты по химии. Каталитическое разложение пероксида водородаСкачать

Разложение пероксида водорода
Разложение пероксида водорода это процесс разделения молекулы пероксида водорода на воду и кислород, так как концентрированная перекись непрочное соединение, уже при комнатной температуре на свету разлагается по реакции (формула разложения пероксида водорода):
Реакция ускоряется со прикосновением с катализаторами ( MnO2 , PbO2 и другие ).
Видео:Разложение пероксида водородаСкачать

Каталитическое разложение пероксида водорода
Пероксид водорода весьма удобный объект для иллюстрации каталитического процесса, влияния различных катализаторов на скорость химической реакции.
Измерение объема кислорода, выделяющегося при разложении пероксида водорода, позволяет проводить этот опыт количественно, притом с достаточной степенью точности.
Активные вещества которые участвуют в интенсивном распаде молекулы пероксида водорода являются металлы переменной валентности (Fe, Сu, Мn, Со, Сr) и их соли.
Разложение пероксида водорода катализаторами сводится к увеличению электролитической диссоциации пероксида водорода, что содействует образованию свободного гидроксид – иона и ускорению распада пероксида водорода.
Разложение пероксида водорода обратимая или нет.
Экспериментально доказано, что добавление к перекиси катализатора приводит к полному разложения молекулы пероксида водорода на воду и кислород. Процесс разложения на прямую зависит от температуры вещества.
А также какой катализатор добавлен, также установлено, что на каталитический процесс разложения влияет добавление некоторых кислот и зависимость концентрации перекиси.
Лабораторное разложение перекиси водорода

То, что было осуществлено в науке химии как нечто новое, может быть повторено на внеурочных и факультативных занятиях как интересные ученические исследования.
Pис. 2 Установка для количественного опыта разложения пероксида водорода:
1-колба для перегонки, 2 — пробирка с катализатором. 3 — чаша кристаллизационная, 4 — эвдиометр.
Во время проведения демонстрационных экспериментов следует знать о пероксиде водорода (обычно 3%-ном) как о веществе, которое подвергается бурному разложению под действием различных катализаторов.
С этой целью в демонстрационные пробирки приливают по 30 мл раствора пероксида водорода и в каждый вносят одно из следующих веществ: оксид марганца (IV), оксид железа (III), активированный уголь, раствор перманганата калия, раствор хлорида железа (III), раствор дихромата калия, кусочек сырого мяса, содержащий фермент каталазу, находящуюся обычно в крови млекопитающих и человека.
Наблюдают за выделением пузырьков газа. Выделение кислорода подтверждают тлеющей лучинкой. Демонстрационные пробирки размещают в штативе с подсветом.
Количественный опыт каталитического разложения пероксида водорода может быть осуществлен в установке, показанной на рисунке 2.
Для собирания газа можно использовать промышленный эвдиометр, имеющий градуировку. Различную скорость образования кислорода можно наблюдать в приборе, описание которого дано В. С. Полосиным, с использованием двух медицинских шприцев, а также с помощью установки для проецирования опытов на экран.
Активность катализатора

Рис. 3. Определение активности различных катализаторов:
1 — пробирка с пероксидом водорода, 2 — колба с катализатором, 3 — стеклянная трубка с пробкой, 4 — Г образная газоотводная трубка, 5 — колба с водой, 6 — сифон, 7 — стакан с водой, 8 — зажимы.
Опыт разложение пероксида водорода
Рекомендуется проводить опыты в следующей последовательности:
- Проверяют герметичность прибора (рис. 3), для чего закрывают пробки и открывают зажимы 8: вода не должна вытекать в стакан.
- В пробирку 1 наливают 5 мл пероксида водорода (30%-ного) и перекрывают резиновую трубку зажимом 8.
- В колбу 2 вносят катализатор и вставляют в нее трубку 3, соединенную с пробиркой 1.
- Выравнивают давление внутри прибора с атмосферным давлением. С этой целью открывают зажим 8 сифона 6 и поднимают стакан 7 с водой так, чтобы вода в нем и в колбе находилась на одинаковом уровне, и затем снова закрывают зажим.
- Воду выливают из стакана и наливают в него точный ее объем — 100 мл, предварительно отмерив его мензуркой.
- Опускают кончик сифона 6 в стакан 7 с водой.
- Открывают оба зажима 8 на приборе и быстро вливают пероксид водорода в колбу 2 с катализатором.
- Через 3 мин вновь приводят давление внутри прибора к атмосферному давлению.
- Закрывают зажим сифона 6 и измеряют объем воды, вытесненной в стакан кислородом.
- Из измеренного объема воды вычитают 100 мл, т. е. объем воды, ранее добавленной в стакан.
По количеству выделившегося кислорода располагают испытанные катализаторы в порядке возрастания их каталитической активности.
Физические свойства пероксида водорода Н2О2
Сильный окислитель. Мол. массе 34,01; коэф. рефр. 1,4067 при 25 °С; плотн. 1448 кг/м3; т. кил 69,7 °С при 3,72 кПа и 80,2 °С при 6,25 кПа. Смешивается в любых соотношениях с водой.
При воздействии 65% -ного р-ра Н2О2 на бумагу, опилки и другие горючие вещества происходит их воспламенение.
Концентрированный раствор может взрываться. Для раствора пероксида водорода низкой концентрации возможно саморазложение при воздействии тепла.
В присутствии органической пыли или веществ, действующих каталитически (металлы, соли металлов).
Хранить растворы пероксида водорода в темном прохладном месте. В присутствии Н2О2 средства тушения обильные струи воды.
Можно ли получить перекись водорода из водорода и кислорода
Можно ли получить Н2О2 непосредственным взаимодействием водорода и кислорода? В реакции взаимодействия водорода с кислородом образуется пероксид водорода в качестве промежуточного продукта при горении водорода:
Так как температура горения водорода очень высока перекись водорода сразу же разлагается на воду и кислород:
Для определения образования перекиси водорода можно воспользоваться кусочком льда. Для этого нужно направить водородное пламя на кусок льда.
В образующейся воде можно обнаружить следы пероксида водорода. Также пероксид водорода можно получить при действии атомарного водорода на кислород.
Непосредственным взаимодействием водорода и кислорода пероксид водорода невыгодно получать ни в лаборатории, ни в промышленности.
Статья на тему Разложение пероксида водорода
Похожие страницы:
Понравилась статья поделись ей
Leave a Comment
Для отправки комментария вам необходимо авторизоваться.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

H2O2 — что это за вещество?

Общеизвестна формула основы жизни – воды. Её молекула состоит из двух атомов водорода и одного кислорода, что записывается как H2O. Если же кислорода будет в два раза больше, то получится совсем другое вещество – H2O2. Что это и чем полученное вещество будет отличаться от своей «родственницы» воды?
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

H2O2 – что это за вещество?
Остановимся на нем подробнее. H2O2 – формула перекиси водорода, Да, той самой, которой обрабатывают царапины, белой. Пероксид водорода H2O2 — название вещества научное.
Для дезинфекции используют трехпроцентный раствор перекиси. В чистом или концентрированном виде она вызывает химические ожоги кожи. Тридцатипроцентный раствор перекиси иначе называют пергидроль; раньше его применяли в парикмахерских для обесцвечивания волос. Обожженная им кожа также становится белой.
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Химические свойства Н2О2
Перекись водорода представляет собой жидкость без цвета и с «металлическим» привкусом. Является хорошим растворителем и сама легко растворяется в воде, эфире, спиртах.
Трёх- и шестипроцентные растворы перекиси обычно готовят, разбавляя тридцатипроцентный раствор. При хранении концентрированного Н2О2 происходит разложение вещества с выделением кислорода, поэтому в плотно закупоренных емкостях его хранить не следует во избежание взрыва. С уменьшением концентрации пероксида, повышается его устойчивость. Также для замедления разложения Н2О2 можно добавлять в него различные вещества, например, фосфорную или салициловую кислоту. Для хранения растворов сильной концентрации (более 90 процентов) в перекись добавляют пирофосфат натрия, который стабилизирует состояние вещества, а также используют сосуды из алюминия.
Н2О2 в химических реакциях может быть как окислителем, так и восстановителем. Однако чаще пероксид проявляет окислительные свойства. Перекись принято считать кислотой, но очень слабой; соли перекиси водорода называют пероксидами.
Видео:Галилео. Эксперимент. Разложение перекиси водородаСкачать

Реакция разложения как метод получения кислорода
Реакция разложения Н2О2 происходит при воздействии на вещество высокой температуры (более 150 градусов Цельсия). В результате образуются вода и кислород.
Формула реакции – 2 Н2О2 + t -> 2 Н2О + О2
Можно посчитать электронный баланс H2O2 в уравнении:
Степень окисления Н в Н2О2 и Н2О = +1.
Степень окисления О: в Н2О2 = -1, в Н2О = -2, в О2 = 0
2 О -1 — 2е -> О2 0
О -1 + е -> О -2
2 Н2О2 = 2 Н2О + О2
Разложение перекиси водорода может произойти и при комнатной температуре, если использовать катализатор (химическое вещество, ускоряющее реакцию).
В лабораториях одним из методов получения кислорода, наряду с разложением бертолетовой соли или марганцовки, является реакция разложения перекиси. В таком случае в качестве катализатора используют оксид марганца (IV). Другие вещества, ускоряющие разложение H2O2, – медь, платина, гидроксид натрия.
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

История открытия перекиси
Первые шаги к открытию перекиси были сделаны в 1790 году немцем Александром Гумбольдтом, когда он обнаружил превращения оксида бария в пероксид при нагревании. Тот процесс сопровождался поглощением кислорода из воздуха. Через двенадцать лет учеными Тенаром и Гей-Люссаком был проведен опыт по сжиганию щелочных металлов с избытком кислорода, в результате чего был получен пероксид натрия. Но пероксид водорода был получен позже, лишь в 1818 году, когда Луи Тенар изучал воздействие кислот на металлы; для их устойчивого взаимодействия было необходимо низкое количество кислорода. Проводя подтверждающий опыт с перекисью бария и серной кислотой, ученый добавил к ним воду, хлористый водород и лёд. Через непродолжительное время, Тенар обнаружил на стенках емкости с пероксидом бария небольшие застывшие капли. Стало ясно, что это H2O2. Тогда дали полученному H2O2 название «окисленная вода». Это и была перекись водорода — бесцветная, ничем не пахнущая, трудноиспаримая жидкость, хорошо растворяющая другие вещества. Результат взаимодействия H2O2 и H2O2 — реакция диссоциации, перекись растворима в воде.
Интересный факт – быстро обнаружились свойства нового вещества, позволяющие использовать его в реставрационных работах. Сам Тенар при помощи пероксида отреставрировал картину Рафаэля, потемневшую от времени.
Видео:Гомогенное каталитическое разложение пероксида водородаСкачать

Перекись водорода в XX веке
После тщательного изучения полученного вещества его стали производить в промышленных масштабах. В начале двадцатого века ввели электрохимическую технологию производства перекиси, основанную на процессе электролиза. Но срок годности полученного таким методом вещества был невелик, около пары недель. Чистая перекись нестабильна, и по большей части её выпускали в тридцатипроцентной концентрации для отбеливания ткани и в трёх- или шестипроцентной – для бытовых нужд.
Учёные фашистской Германии использовали пероксид для создания ракетного двигателя на жидком топливе, который использовался для оборонных нужд во Второй Мировой войне. В результате взаимодействия Н2О2 и метанола/гидразина, получалось мощное топливо, на котором самолет достигал скорости более 950 км/ч.
Видео:8 класс. Составление уравнений химических реакций.Скачать

Где применяется Н2О2 сейчас?
- в медицине — для обработки ран;
- в целлюлозно-бумажной промышленности используются отбеливающие свойства вещества;
- в текстильной промышленности перекисью отбеливают натуральные и синтетические ткани, меха, шерсть;
- как ракетное топливо или его окислитель;
- в химии — для получения кислорода, как пенообразователь для производства пористых материалов, как катализатор или гидрирующий агент;
- для производства дезинфицирующих или чистящих средств, отбеливателей;
- для обесцвечивания волос (это устаревший метод, так как волосы сильно повреждаются пероксидом);
- некоторые используют перекись для отбеливания зубов, но при этом разрушается их эмаль;
- в аквариумистике и рыбных хозяйствах используют трёхпроцентный раствор Н2О2 для оживления задохнувшихся рыб, для уничтожения водорослей и паразитов в аквариуме, а также для борьбы с некоторыми заболеваниями рыбы;
- во всех отраслях пероксид может применяться как средство дезинфекции поверхностей, оборудования, упаковки;
- для чистки бассейнов;
- для добычи металлов и нефти в горно- и нефтедобывающей промышленности;
- для обработки металлов и сплавов в металлообработке.
Видео:Реакции разложенияСкачать

Применение Н2О2 в быту
Перекись водорода можно успешно применять для решения разных бытовых задач. Но использовать в этих целях можно лишь трёхпроцентную перекись водорода. Вот некоторые способы:
- Для очистки поверхностей нужно залить перекись в сосуд пульверизатором и разбрызгивать на загрязненные места.
- Для дезинфекции предметов их нужно протереть неразбавленным раствором Н2О2. Это поможет очистить их от вредных микроорганизмов. Губки для мытья можно замочить в воде с перекисью (пропорция 1:1).
- Для отбеливания тканей при стирке белых вещей добавляют стакан пероксида. Можно также выполоскать белые ткани в воде, смешанной со стаканом Н2О2. Этот способ возвращает белизну, предохраняет ткани от пожелтения и помогает удалить трудновыводимые пятна.
- Для борьбы с плесенью и грибком следует смешать в емкости с пульверизатором перекись и воду в пропорции 1:2. Полученную смесь распылять на зараженные поверхности и через 10 минут очищать их при помощи щётки или губки.
- Обновить потемневшую затирку в кафельной плитке можно, распылив пероксид на нужные участки. Через 30 минут нужно тщательно потереть их жесткой щёткой.
- Для мытья посуды полстакана Н2О2 добавить в полный таз с водой (или раковину с закрытым сливом). Промытые в таком растворе чашки и тарелки будут сиять чистотой.
- Чтобы очистить зубную щётку, нужно опустить её в неразведенный трёхпроцентный раствор перекиси. Затем промыть под сильной струей воды. Этот способ хорошо дезинфицирует предмет гигиены.
- Чтобы продезинфицировать купленные овощи и фрукты, следует распылить на них раствор 1 части перекиси и 1 части воды, после чего тщательно промыть их водой (можно холодной).
- На дачном участке при помощи Н2О2 можно бороться с болезнями растений. Нужно опрыскивать их раствором перекиси или замочить семена незадолго до посадки в 4,5 литрах воды, смешанной с 30 мл сорокапроцентной перекиси водорода.
- Для оживления аквариумных рыбок, если они отравились аммиаком, задохнулись при отключении аэрации или по другой причине, можно попробовать поместить их в воду с перекисью водорода. Нужно смешать трёхпроцентную перекись с водой из расчёта 30 мл на 100 литров и поместить в полученную смесь бездыханных рыб на 15-20 минут. Если они не оживут за это время, значит, средство не помогло.
Видео:Разложение пероксида водорода I ЕГЭ по химииСкачать

Перекись водорода в природе
Не стоит считать пероксид водорода искусственным соединением, получаемым только в лабораториях. В Н2О2 содержится в дожде и снеге, в горном воздухе. В горах можно встретить источники и реки с белой от мельчайших кислородных пузырьков водой, которая справедливо считается полезной. Мало кто знает, что цвет и пузырьки обусловлены наличием в воде Н2О2, образующейся из-за хорошей её аэрации. Между тем, не стоит бояться пить такую воду некипяченой, если, разумеется, поблизости нет заводов и фабрик. Перекись водорода, естественным путем образующаяся в воде, служит обеззараживающим средством против микроорганизмов и паразитов.
Даже в результате активного встряхивания бутылки с водой в ней образуется некоторое количество пероксида, так как вода при этом действии насыщается кислородом.
В свежих фруктах и овощах Н2О2 также содержится, пока они не подвергнутся термической обработке. При нагреве, варке, обжарке и других процессах с сопутствующей высокой температурой уничтожается большое количество кислорода. Именно поэтому прошедшие кулинарную обработку продукты считаются не такими полезными, хотя какое-то количество витаминов в них остается. Свежевыжатые соки или кислородные коктейли, подаваемые в санаториях, полезны по той же причине – из-за насыщения кислородом, который дает организму новые силы и очищает его.
Видео:Каталитическое разложение пероксида водородаСкачать

Опасность перекиси при употреблении внутрь
После вышесказанного может показаться, что перекись можно специально принимать внутрь, и от этого будет польза организму. Но это совсем не так. В воде или соках соединение содержится в минимальных количествах и тесно связано с другими веществами. Прием же «ненатуральной» перекиси водорода внутрь (а вся перекись, купленная в магазине или произведенная в результате химических опытов самостоятельно, никак не может считаться натуральной, к тому же обладает слишком высокой концентрацией по сравнению с природной) может привести к опасным для жизни и здоровья последствиям. Чтобы понять — почему, нужно вновь обратиться к химии.
Как уже упомянуто, при некоторых условиях пероксид водорода разрушается и выделяет кислород, являющийся активным окислителем. Например, реакция разложения может произойти при столкновении Н2О2 с пероксидазой – внутриклеточным ферментом. В основе использования перекиси для дезинфекции положены именно её окислительные свойства. Так, когда рану обрабатывают Н2О2 – выделяющийся кислород уничтожает живые патогенные микроорганизмы, попавшие в нее. Такое же действие она оказывает и на другие живые клетки. Если обработать неповрежденную кожу пероксидом, а потом протереть место обработки спиртом, почувствуется жжение, что подтверждает наличие микроскопических повреждений после перекиси. Но при внешнем применении перекиси низкой концентрации какого-то заметного вреда организму не будет.
Другое дело, если её пытаться принимать внутрь. То вещество, которое способно повреждать даже сравнительно толстую кожу снаружи, попадает на слизистые оболочки пищеварительного тракта. То есть происходят химические мини-ожоги. Разумеется, выделяющийся окислитель – кислород – может заодно убить и вредные микробы. Но этот же процесс произойдет и с клетками пищевого тракта. Если ожоги в результате действия окислителя будут повторяться, то возможна атрофия слизистых оболочек, а это – первый шаг на пути к раку. Гибель клеток кишечника приводит к невозможности организма усваивать питательные вещества, этим объясняется, например, снижение веса и исчезновение запоров у некоторых людей, практикующих «лечение» перекисью.
Отдельно нужно сказать о таком методе употребления перекиси, как внутривенные инъекции. Даже если по какой-то причине их назначил врач (оправдано это может быть лишь при заражении крови, когда других подходящих лекарств в наличии нет), то под медицинским наблюдением и со строгим расчетом дозировок риски все-таки есть. Но в такой экстремальной ситуации это будет шансом на выздоровление. Самому же назначать себе уколы перекиси водорода ни в коем случае нельзя. Н2О2 представляет большую опасность для клеток крови – эритроцитов и тромбоцитов, так как при попадании в кровеносное русло разрушает их. К тому же, может произойти смертельно опасная закупорка сосудов высвободившимся кислородом – газовая эмболия.
Видео:Разложение пероксида водорода под действием дихромата калияСкачать

Меры безопасности в обращении с Н2О2
- Хранить в недоступном для детей и недееспособных лиц месте. Отсутствие запаха и выраженного вкуса делает перекись особенно опасной для них, так как могут быть приняты большие дозы. При попадании внутрь раствора, последствия употребления могут быть непредсказуемыми. Необходимо незамедлительно обратиться к врачу.
- Растворы перекиси концентрацией более трёх процентов вызывают ожоги при попадании на кожу. Место ожога нужно промыть большим количеством воды.
- Не допускать попадания раствора пероксида в глаза, так как образуется их отек, покраснение, раздражение, иногда болевые ощущения. Первая помощь до обращения к врачу – обильное промывание глаз водой.
- Хранить вещество так, чтобы было понятно, что это — H2O2, то есть в емкости с наклейкой во избежание случайного применения не по назначению.
- Условия хранения, продлевающие его срок, – темное, сухое, прохладное место.
- Нельзя смешивать пероксид водорода с любыми жидкостями, кроме чистой воды, в том числе и с хлорированной водой из-под крана.
- Все вышесказанное применимо не только к Н2О2, но и ко всем содержащим его препаратам.
📹 Видео
Каталитическое разложение пероксида водородаСкачать

Каталитическое разложение пероксида водорода (37)Скачать

ПЕРОКСИД ВОДОРОДА | Химические свойства перекиси водорода | ПЕРЕКИСЬ | Химические реакции | ХимияСкачать

Химические уравнения. Урок 15. Химия 7 классСкачать

ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

Разложение перекиси водорода в присутствии катализатораСкачать

Реакции разложения. Как понять?Скачать