| Хлорид железа | |
|---|---|
 | |
| Систематическое наименование | Хлорид железа (III) |
| Хим. формула | FeCl3 |
| Состояние | твердый |
| Молярная масса | 162.5 г/моль |
| Плотность | 2,8 г/см³ |
| Т. плав. | 306 °C |
| Т. кип. | 315 °C |
| Растворимость в воде | 92 г/100 мл |
| ГОСТ | ГОСТ 4147-74 |
| Рег. номер CAS | 7705-08-0 |
| PubChem | 24380 |
| Рег. номер EINECS | 231-729-4 |
| SMILES | |
| RTECS | LJ9100000 |
| ChEBI | 30808 |
| ChemSpider | 22792 |
| ЛД50 | 440 мг/кг (крысы, орально) |
| Токсичность | |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Хлорид железа (III), хлорное железо, также — трихлорид железа. FeCl3 — средняя соль трёхвалентного железа и соляной кислоты.
- Содержание
- Физические свойства
- Методы получения
- Химические свойства
- Применение
- Безопасность
- Acetyl
- Хлорид железа (III): строение, свойства, производство, применение
- Содержание:
- Состав
- Номенклатура
- Свойства
- Физическое состояние
- Молекулярный вес
- Температура плавления
- Точка кипения
- Плотность
- Растворимость
- pH
- Химические свойства
- Получение
- Присутствие в природе
- Приложения
- При очистке сточных вод
- В ветеринарных лечебных процедурах
- При добыче металлов
- Как химический и биологический лабораторный реагент
- В различных приложениях
- Риски
- Ссылки
Видео:Взаимодействие хлорида железа III с роданидом калияСкачать

Содержание
- 1 Физические свойства
- 2 Методы получения
- 3 Химические свойства
- 4 Применение
- 5 Безопасность
Видео:Получение хлорида железа 3Скачать

Физические свойства
Мерцающие, черно-коричневые, либо темно-красные, либо фиолетовые в проходящем свете, зеленые в отраженном свете листочки с металлическим блеском. Сильно гигроскопичен, на воздухе превращается в гидрат FeCl3· 6H2O — гигроскопичные жёлтые, по другим источникам желто-коричневые кристаллы, хорошо растворимые в воде (при 20 °C в 100 г воды растворяется 91,9 г безводной соли). Tпл 309 °C.
Видео:ХЛОРИД ЖЕЛЕЗА. FeCl₃Скачать

Методы получения
- Самым простым методом получения трихлорида железа является действие на железные опилки или раскалённую железную проволоку газообразным хлором. При этом, в отличие от действия соляной кислоты, образуется соль трёхвалентного железа — выделяется бурый дым из мельчайших её частиц:
2Fe + 3Cl2 → 2FeCl3
- Также трихлорид получается при окислении хлором хлорида железа (II):
2FeCl2 + Cl2 → 2FeCl3
- Также существует достаточно интересный метод окисления оксидом серы (IV):
4FeCl2 + SO2↑ + 4HCl → 4FeCl3 + S + 2H2O
- Другим способом получения трихлорида железа (FeCl3) является взаимодействие
оксида железа(III) с соляной кислотой, сопровождающееся выделением воды и энергии в виде тепла:
Fe2O3 + 6HCl → 2FeCl3 + 3H2O + Q↑
Видео:Взаимодействие хлорида железа (III) с гидроксидом натрия FeCl3 + 3NaOH = Fe(OH)3 + 3NaClСкачать

Химические свойства
- При нагревании в атмосферном давлении до температуры плавления начинается медленное разложение трихлорида железа с образованием дихлорида и молекулярного хлора:
2FeCl3 → 2FeCl2 + Cl2
- За счёт того, что трихлорид железа является сильной кислотой Льюиса, он вступает во взаимодействие с некоторыми другими хлоридами, при этом образуются комплексные соли тетрахлороферратной кислоты:
FeCl3 + Cl − → [FeCl4] −
- При нагревании до 350 °C с оксидом железа(III) образуется оксохлорид железа:
FeCl3 + Fe2O3 → 3FeOCl
- Соли трёхвалентного железа являются слабыми окислителями, в частности, трихлорид железа хорошо окисляет металлическую медь, переводя её в растворимые хлориды:
FeCl3 + Cu → FeCl2 + CuCl FeCl3 + CuCl → FeCl2 + CuCl2
- реагирует с иодоводородом:
2FeCl3 + 2HI → 2FeCl2 + I2 + 2HCl
Видео:Качественная реакция на ион трехвалентного железаСкачать

Применение
- Хлорид железа(III) применяется при травлении печатных плат (радиотехника, системотехника).
- Используется для травления печатных форм (офорт, цинкография), как альтернатива азотной кислоте, реакция с которой сопровождается выделением высокотоксичных паров («лисий хвост»).
- Используется в кузнечном деле для проявления рисунка железа.
- Применяется как протрава при крашении тканей.
- В промышленных масштабах применяется как коагулянт для очистки воды.
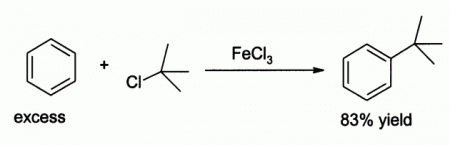
- За счёт чётко выраженных кислотных свойств широко применяется в качестве катализатора в органическом синтезе. Например, для реакции электрофильного замещения в ароматических углеводородах.
Видео:Опыты по химии. Получение гидроксида железа (III) и изучение его свойствСкачать

Безопасность
Хлорид железа (III) является токсичным, высококоррозионным соединением. Безводная соль служит осушителем.
Видео:Равновесие в растворе роданида железаСкачать

Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Видео:Качественная реакция на фенол (С ХЛОРИДОМ ЖЕЛЕЗА 3)Скачать  Хлорид железа (III): строение, свойства, производство, применениеХлорид железа (III): строение, свойства, производство, применение — Наука Видео:ПОЛУЧЕНИЕ хлоридов железа (II и III)Скачать  Содержание:В хлорид железа (III) Это неорганическое соединение, образованное элементами железа (Fe) и хлора (Cl). Его химическая формула — FeCl.3. Это кристаллическое твердое вещество, цвет которого может быть от оранжевого до черно-коричневого. FeCl3 он легко растворяется в воде с образованием кислых водных растворов, в которых при увеличении pH, делая их более щелочными, может образовываться твердый оксид железа. Хлорид железа (III) используется для осаждения загрязняющих воду частиц из городских или промышленных отходов. Говорят, что он позволяет удалить некоторых паразитов и служит для остановки потери крови из ран у животных и для их заживления. Он используется для извлечения меди (II) из сульфидных медных руд. Он также используется в различных химических реакциях и анализах в биологических и химических лабораториях. Например, он используется для обнаружения таких соединений, как фенолы, в маслах, извлеченных из растений. Он используется в электронных схемах, при выделке кожи и в фотографии. За то, что он FeCl3 кислотное соединение разъедает кожу и слизистые оболочки. Следует избегать вдыхания пыли этого соединения. Его нельзя выбрасывать в окружающую среду. Видео:Взаимодействие хлорида железа (III) с гидроксидом натрия I ЕГЭ по химииСкачать  СоставХлорид железа (III) или хлорид железа FeCl3 представляет собой ионное соединение и состоит из иона трехвалентного железа Fe 3+ и три иона хлорида Cl – . Железо находится в степени окисления +3, а каждый хлор имеет валентность -1. Видео:Взаимодействие хлорида железа (III) с сульфидом натрия в растворе FeCl3 + Na2SСкачать  Номенклатура
Видео:Реакция хлорида железа III с иодидом калия. Химический опытСкачать  СвойстваВидео:ВСЕ РЕАКЦИИ С АЗОТОМ И ЕГО СОЕДИНЕНИЯМИ | ЕГЭ ХИМИЯ 2024| НООСкачать  Физическое состояниеКристаллическое твердое вещество от оранжевого до черновато-коричневого цвета. Видео:Опыты по химии. Взаимодействие фенола с раствором хлорида железа (III)Скачать  Молекулярный весБезводный FeCl3 = 162,2 г / моль Видео:Получение гидроксида железа (III) и взаимодействие его с кислотамиСкачать  Температура плавленияБезводный FeCl3 = 304 ºC FeCl гексагидрат3•6H2O = 37 ° C Видео:Взаимодействие раствора хлорида железа (III) с раствором сульфита натрия FeCl3 + Na2SO3 + H2OСкачать  Точка кипенияБезводный FeCl3 = Приблизительно 316 ºC FeCl гексагидрат3•6H2О = 280-285 ° С Видео:Взаимодействие хлорида железа (III) с сульфидом натрия | ЕГЭ по химииСкачать  ПлотностьБезводный FeCl3 = 2,90 г / см 3 при 25 ° C Видео:Гидролиз хлорида железа (lll). Опыты по химии.Скачать  РастворимостьХорошо растворим в воде: 74,4 г / 100 г воды при 0 ° C; 535,7 г / 100 г воды при 100 ° C. Хорошо растворим в ацетоне, этаноле, эфире и метаноле. Слабо растворим в неполярных растворителях, таких как бензол и гексан. Видео:Реакция СУЛЬФАТА ЖЕЛЕЗА, ГИПОХЛОРИТА НАТРИЯ и СЕРНОЙ КИСЛОТЫ. Получение СУЛЬФАТА ЖЕЛЕЗА (3).Скачать  pHЕго водные растворы очень кислые. Раствор 0,1 моль FeCl3 на литр воды имеет pH 2,0. Видео:хлорид железа 3 + сульфид натрияСкачать  Химические свойстваКогда FeCl растворяется в воде3 гидролизуется; то есть он разделяется на ионы Fe 3+ и 3 Cl – . Вера 3+ образует гекса-ион железа [Fe (H2ИЛИ)6] 3+ но это сочетается с ионами ОН – воды, образующей смешанные частицы и высвобождающей протоны H + . По этой причине их растворы кислые. Если pH повышается, эти частицы образуют гель, и, наконец, образуется осадок или твердое вещество гидратированного оксида железа Fe.2ИЛИ3•нГ2ИЛИ. Кристаллы хлорида железа (III) гигроскопичны, то есть они поглощают воду из окружающей среды. В мокром состоянии вызывает коррозию алюминия и многих металлов. Водные растворы FeCl3 они очень кислые и вызывают коррозию большинства металлов. У них слабый запах соляной кислоты HCl. Когда FeCl нагревается до разложения3 выделяет высокотоксичные газы HCl. ПолучениеХлорид железа (III) получают прямым хлорированием железа путем реакции сухого хлора (Cl2) с железным ломом (Fe) при 500-700 ° С. Реакцию проводят в кислотостойком реакторе. Первый шаг — расплавить при 600 ° C смесь хлорида железа (III) (FeCl3) и хлорид калия (KCl). Затем железный лом (Fe) растворяется в указанной расплавленной смеси, где железо реагирует с FeCl.3 и становится хлоридом железа (FeCl2). Тогда FeCl2 реагирует с хлором Cl2 формирование FeCl3 который сублимируется (напрямую переходит из твердого в газообразное состояние) и собирается в специальных конденсационных камерах. Сульфат железа FeSO также может реагировать4 с хлором Cl2. Гексагидрат FeCl3•6H2Или его можно получить испарением водного раствора ионов Fe 3+ и Cl – в паровой бане. Присутствие в природеХлорид железа или хлорид железа (III) встречается в природе в форме минерала молизита, который находится в лаве из активных жерл вулканов. Среди вулканов, где он находится, находится Везувий. ПриложенияПри очистке сточных водХлорид железа используется для очистки городских или промышленных сточных вод путем химического осаждения. Он действует как коагулянт, способствуя объединению нескольких частиц друг с другом, таким образом, образуются конгломераты или более крупные частицы, которые имеют тенденцию к флокуляции или осаждению (опускаются под собственным весом на дно обрабатываемой воды). Таким образом улучшается отделение твердых частиц от воды и исключаются нежелательные материалы. Этот тип лечения может облегчить удаление паразитов, таких как простейшие, которые представляют собой микроорганизмы, образованные одной клеткой, такие как амебы, которые вызывают заболевание. По этой причине FeCl3 он также используется для очистки воды. В ветеринарных лечебных процедурахХлорид железа (III) используется для заживления ран животных. Он служит местным вяжущим (он может втягивать ткани и действовать как противовоспалительное и заживляющее) и кровоостанавливающим средством (останавливает кровотечение или кровопотерю). Он используется в порошках, чтобы остановить потерю крови или когда у крупного рогатого скота отрезаны рога. Его также используют в виде раствора, чтобы остановить кровотечение при порезании когтей или удалении бородавок. Он также используется для лечения фарингита (воспаление глотки) или стоматита (воспаление слизистой оболочки полости рта) и для повышения уровня гемоглобина в крови у некоторых птиц. При добыче металловХлорид железа (III) или хлорид железа FeCl3 Он используется для извлечения меди (II) из медной руды, содержащей сульфиды меди. Это окислительный метод, который позволяет избежать выделения токсичного газообразного диоксида серы (SO2), поскольку вместо нее образуется сера (S). Производятся растворы с высокими концентрациями FeCl.2, FeCl3, CuCl2 и другие хлориды металлов. Как химический и биологический лабораторный реагентСреди многих его применений в химии он служит для обозначения присутствия фенольной группы –ОН (то есть группы –ОН, присоединенной к бензольному кольцу). Анализируемое соединение растворяют в этаноле и добавляют несколько капель раствора FeCl.3. Когда соединение имеет группу -OH, присоединенную к бензольному кольцу (то есть это фенол), образуется голубовато-зеленый цвет. Этот тест позволяет анализировать наличие фенолов в растительных экстрактах. Он также используется в тестах для определения антиоксидантной активности некоторых масел, извлеченных из овощей. Еще одно его применение — это то, что он позволяет получать другие химические соединения. Он также может действовать как окислитель, хлорирующий агент (обеспечивая хлор) и конденсирующий (соединяя две или более молекул вместе). Он также служит катализатором или ускорителем реакций органической химии. В различных приложенияхХлорид железа используется в печатных электронных схемах. Из-за окраски его различных гидратированных форм он служит пигментом и используется при дублении кожи. Это дезинфицирующее средство. Он используется для лечения кожных заболеваний, а также в фотографии. РискиFeCl порошок3 это раздражает глаза, нос и рот. При вдыхании может вызвать кашель или затрудненное дыхание. Это едкое соединение, поэтому продолжительный контакт с кожей, глазами или слизистыми оболочками может вызвать покраснение и ожоги. Он не горюч, но при нагревании до высоких температур выделяет хлористый водород HCl, который токсичен и вызывает сильную коррозию. FeCl3 вреден для водных и наземных организмов. При случайном попадании в окружающую среду кислотность необходимо нейтрализовать щелочными соединениями. Ссылки
Ревность между братьями и сестрами: симптомы и как действовать Электрические синапсы: какие они и как работают в нервной системе |