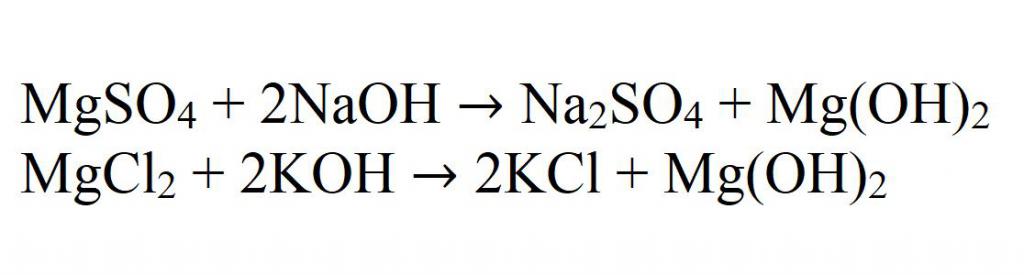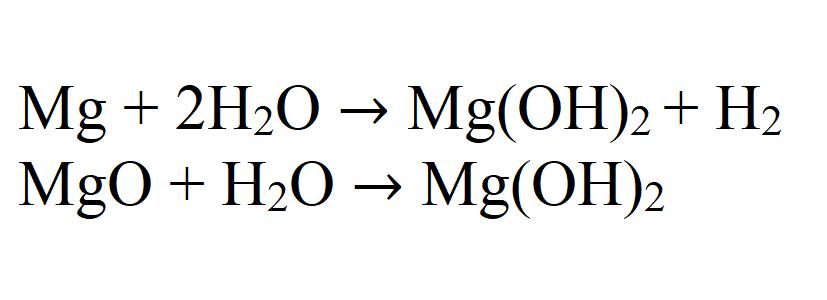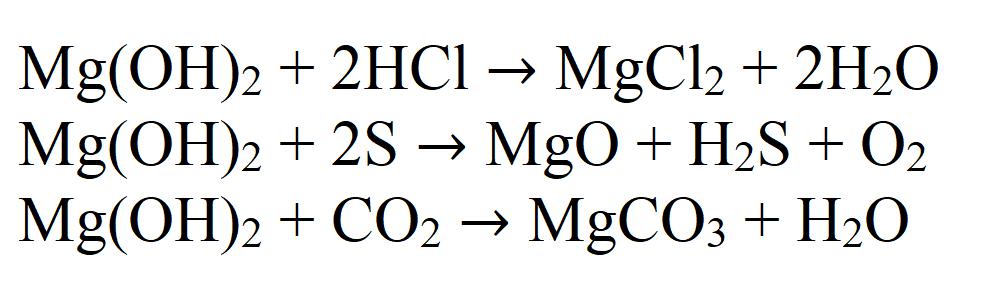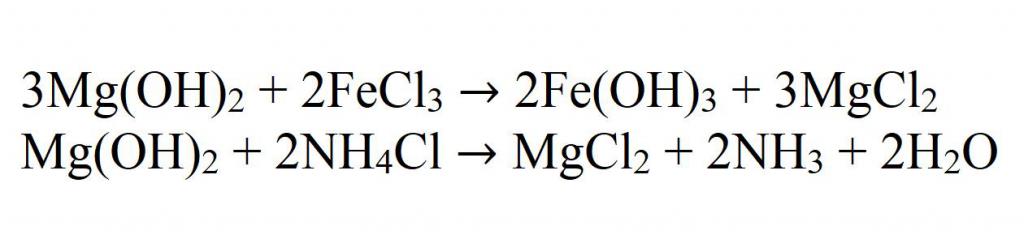Гидроксид магния Mg(OH)2 — неорганическое соединение. Белый, при нагревании разлагается. Не растворяется в воде. Проявляет основные свойства.
Относительная молекулярная масса Mr = 58,32; относительная плотность для тв. и ж. состояния d = 2,39.
- Способы получения
- Качественная реакция
- Химические свойства
- Гидроксид магния: описание вещества, свойства и применение
- Распространение в природе
- Получение
- Физические свойства
- Химические свойства
- Применение в медицине
- Применение в других отраслях
- Гидроксид магния
- Содержание
- Описание
- Получение
- Химические свойства
- Применение
- 🎥 Видео
Видео:Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Способы получения
1. Гидроксид магния получают в результате взаимодействия хлорида магния и разбавленного раствора гидроксида натрия, на выходе образуется хлорид натрия и гидроксид магния :
MgCl2 + 2NaOH = Mg(OH)2↓ + 2NaCl
2 . При взаимодействии магния с горячей водой образуется гидроксид магния и водород:
3. Нитрат магния при взаимодействии с разбавленным раствором гидроксида натрия образует нитрат натрия и гидроксид магния:
4. Сульфат магния взаимодействует с разбавленным раствором гидроксида натрия, образуя гидроксид магния и сульфат натрия:
Видео:ТИПОВЫЕ ЗАДАЧИ ПО ХИМИИ: Химическое Количество Вещества, Моль, Молярная Масса и Молярный ОбъемСкачать

Качественная реакция
Качественная реакция на гидроксид магния — окрашивание фенолфталеина в малиновый цвет .
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Химические свойства
1. Гидроксид магния взаимодействует со сложными веществами :
1.1. Гидроксид магния реагирует с кислотами:
1.1.1. В результате реакции между гидроксидом магния и разбавленной соляной кислотой образуется хлорид магния и вода:
1.2. Гидроксид магния взаимодействует с оксидами:
В результате взаимодействия твердого гидроксида магния и углекислого газа при комнатной температуре образуется гидроксокарбонат магния и вода:
1.3. Гидроксид магния реагирует с солями :
Гидроксид магния взаимодействует с концентрированным и горячим раствором хлорида аммония , образуя хлорид магния, аммиак и воду:
2. Гидроксид магния разлагается при температуре 350 — 480º С, образуя на выходе оксид магния и воду:
Видео:Амфотерные гидроксиды. Химия ОГЭ 2023 | TutorOnlineСкачать

Гидроксид магния: описание вещества, свойства и применение
Гидроксид магния — это неорганическое вещество, оно является малорастворимым соединением, из-за чего при его образовании в водных растворах появляется осадок. Формула гидроксида магния — Mg(OH)2, то есть это двухкислотное основание. Более растворим в воде, чем типичные нерастворимые основания, но менее растворим, чем гидроксид кальция. По этой причине его относят к малорастворимым соединениям.
Видео:ОКСИДЫ ХИМИЯ — Что такое Оксиды? Химические свойства Оксидов | Реакция ОксидовСкачать

Распространение в природе
Гидроксид магния в природе встречается в виде минерала брусита. Крупные месторождения этой породы — большая редкость. В России его добывают на Кульдурском месторождении, где его запасы оценивают в 14 миллионов тонн. Добыча на нем идет со скоростью примерно в 250 тысяч тонн продукта в год, но с этого года объемы добычи увеличились вдвое. Причиной этому стал хороший спрос на этот минерал за границей. Самым крупным импортером является Япония.
Выглядит брусит как белые, серые или зеленовато-белые кристаллы со стеклянным блеском на изломе. Имеет довольно низкую твердость, поэтому легко режется ножом. Может содержать примеси. В зависимости от их количества и типа выделяют несколько подвидов этого минерала. Так, ферронемалит содержит в себе, помимо гидроксида магния, 5 % железа в виде оксида, а ферробрусит — уже целых 36 %. Оксид железа имеет бурый цвет (цвет ржавчины), поэтому эти минералы приобретают тот же оттенок вместо привычного светло-зеленого. Существует еще и мангобрусит. В качестве примеси здесь выступает марганец. Такой минерал имеет уже медово-желтый цвет. Но при контакте с кислородом воздуха минерал быстро теряет свой красивый цвет и быстро чернеет.
Применяют данный минерал в основном как сырье. Из него получают оксид и другие соединения магния, флюсы, различные огнеупорные материалы. Но брусит можно применять и без какой-либо обработки. Так, этот минерал используют для очистки газов от хлора и для сорбционного фильтрования воды.
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Получение
Основная реакция получения нерастворимых гидроксидов — это реакция взаимодействия щелочей с солями магния. Например, при взаимодействии сульфата магния с гидроксидом натрия. Это хорошая иллюстрация. А еще пример — при взаимодействии хлорида магния и гидроксида калия.
В ионном виде все подобные реакции записываются как:
При взаимодействии магния или его оксида с водой может также получаться гидроксид. Данная реакция идет очень медленно и только при нагревании.
Существует такой достаточно распространенный минерал — доломит. С химической точки зрения он представляет смесь карбоната кальция и магния. При обработке этого минерала водным раствором хлорида магния при нагревании в осадок выпадает нерастворимый гидроксид:
Видео:Взаимодействие гидроксида магния с серной кислотой | ЕГЭ по химииСкачать

Физические свойства
В сухом виде гидроксид магния представляет собой белое кристаллическое вещество. Не имеет запаха, но ему присущ вкус щелочи. Он малорастворим в воде (всего 0,6 мг на 100 мл воды). Но даже несмотря на это, его водные растворы имеют слабощелочную среду и окрашивают индикаторы в соответствующие цвета. Зато данное соединение растворяется в растворах солей аммония. Оно не плавится, так как при температуре 480 o C разлагается на оксид магния и воду, как и любое другое нерастворимое основание. Плотность при нормальных условиях: 2,4 г/см 3 .
Видео:8 класс. Массовая доля растворенного вещества. Решение задач.Скачать

Химические свойства
Гидроксид магния — типичное нерастворимое основание. Это и определяет его химические свойства. Так, например, реагирует гидроксид магния с кислотами, кислотными оксидами и неметаллами:
Из-за последней реакции он имеет склонность поглощать углекислый газ прямо из воздуха с образованием карбоната, поэтому хранить данное вещество длительное время открытым не рекомендуется.
Взаимодействует также и с солями, если в результате реакции получается осадок или газ:
Как уже было указано выше, при нагревании идет разложение гидроксида магния по уравнению:
Что касается образования комплексных соединений, где катион магния выступал бы в качестве лиганда, то на этот счет имеются противоречивые сведения. В одних источниках указывается, что магний не склонен к их образованию, и существуют лишь только неустойчивые соединения с галогенидами магния. В других источниках указывается, что гидроксид магния может реагировать с горячими щелочами с образованием гидромагнезатов:
Видео:Химия 9 класс — Как определять Степень Окисления?Скачать

Применение в медицине
В медицине суспензии на основе гидроксида магния используются как антацидное средство. Этому способствуют основные свойства. Попадая в желудок, гидроксид магния снижает его кислотность, нейтрализуя соляную кислоту. Применяется при гастритах, язвенной болезни желудка и двенадцатиперстной кишки. Препараты на его основе не снижают кислотно-щелочное равновесие и не нарушают секрецию соляной кислоты. Но даже несмотря на это, препарат имеет ряд ограничений и противопоказан людям с гиперчувствительностью к гидроксиду магния.
Продуктом взаимодействия гидроксида магния и соляной кислоты желудочного сока является хлорид магния. Он является сильным слабительным (действие наступает через 2-6 часов). Поэтому гидроксид магния является активным компонентом некоторых препаратов этой области. Избыток магния в организме легко выводится почками, но если человек страдает какими-либо болезнями этих органов, то он может получить избыток магния в организме при приеме препаратов (гипермагнемия).
Еще одно свойство данного соединения — расслабление мускулатуры. Иногда препараты, содержащие гидроксид магния, прописывают женщинам с угрозой выкидыша.
Видео:Установление эмпирической и молек. формул по массовым долям элем., входящих в состав в-ва. 10 класс.Скачать

Применение в других отраслях
Гидроксид магния применяется и в пищевой промышленности как добавка Е528. В продуктах он регулирует кислотность и стабилизирует цвет. Еще применяют гидроксид магния для связывания диоксида серы, появление которого нежелательно в пищевых продуктах. Применяют его при производстве консервированных овощей, соусов, маринада и сыра. Эта добавка считается безвредной, но она запрещена в Австралии, Великобритании и Новой Зеландии.
Также гидроксид магния применяется как огнезащитная добавка в полимеры (ПВХ, полиолефины), как добавка в моющие средства и зубные пасты, для рафинирования сахара и очистки сточных вод.
Получаемый из гидроксида магния оксид — довольно полезное соединение. Оно способно выдерживать температуру около 3000 градусов, поэтому его используют как огнеупор. Так, его добавляют в кирпичи, из которых потом делают доменные печи. Используют оксид магния и как сорбент для очистки нефтепродуктов. Абразивные способности данного соединения также высоки. С помощью него очищают и полируют поверхности деталей в электронной промышленности.
Видео:получение оксида и гидроксида медиСкачать

Гидроксид магния
| Гидроксид магния | |
|---|---|
| Систематическое наименование | Гидроксид магния |
| Хим. формула | Mg(OH)2 |
| Рац. формула | Mg(OH)2 |
| Состояние | твёрдое |
| Молярная масса | 58.35 г/моль |
| Плотность | 2,3446 (20 °C) |
| Температура | |
| • плавления | 350 °C |
| • вспышки | невоспламеняющийся °C |
| Энтальпия | |
| • образования | –925 кДж/моль |
| Растворимость | |
| • в воде | 0,0012 г/100 мл |
| Показатель преломления | 1.559 |
| Кристаллическая структура | тригональная |
| Рег. номер CAS | 1309-42-8 |
| PubChem | 73981 |
| Рег. номер EINECS | 215-170-3 |
| SMILES | |
| Кодекс Алиментариус | E528 |
| RTECS | OM3570000 |
| ChEBI | 6637 |
| ChemSpider | 14107 и 21169899 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Гидроксид магния (Гидроокись магния) — неорганическое вещество, осно́вный гидроксид металла магния, имеет формулу Mg(OH)2 . Слабое малорастворимое основание.
Видео:Как ЛЕГКО понять Химию с нуля — Массовая доля вещества // ХимияСкачать

Содержание
- 1 Описание
- 2 Получение
- 3 Химические свойства
- 4 Применение
Видео:АМФОТЕРНЫЕ ГИДРОКСИДЫ на ЕГЭ - проводим химические опыты | 10 класс УмскулСкачать

Описание
При стандартных условиях гидроксид магния представляет собой аморфное вещество. При температуре выше 350 °C разлагается на оксид магния и воду. Поглощает углекислый газ и воду из воздуха с образованием основного карбоната магния. Гидроксид магния практически нерастворим в воде, но растворим в солях аммония. Является слабым основанием, даже ничтожная его часть, растворившаяся в воде, сообщает раствору слабощелочную реакцию и окрашивает индикаторы, например, фенолфталеин, в розовый цвет. Встречается в природе в виде минерала брусита.
Видео:Гибридизация атомных орбиталей и геометрия молекул. 10 класс.Скачать

Получение
- Взаимодействие растворимых солей магния с щелочами:
В общем виде:
MgCl2 + 2 NaOH ⟶ Mg(OH)2 ↓ + 2 NaCl
- Взаимодействие раствора хлорида магния с обожжённым доломитом:
- Взаимодействие металлического магния с парами воды:
Видео:68 учеников этого НЕ ЗНАЮТ! Таблица Менделеева — Как пользоваться?Скачать

Химические свойства
- Как и все слабые основания, гидроксид магния термически неустойчив. Разлагается при нагревании до 350 °C:
- Взаимодействует с кислотами с образованием соли и воды (реакция нейтрализации):
- Взаимодействие с кислотными оксидами с образованием соли и воды:
- Взаимодействие с горячими концентрированными растворами щелочей с образованием гидроксомагнезатов:
Видео:Основания. 8 класс.Скачать

Применение
Гидроксид магния применяется для связывания диоксида серы, как флокулянт для очистки сточных вод, в качестве огнезащитного средства в термопластических полимерах (полиолефины, ПВХ), как добавка в моющие средства, для получения оксида магния, рафинирования сахара, в качестве компонента зубных паст.
В медицине его применяют в качестве лекарства для нейтрализации кислоты в желудке, а также как очень сильное слабительное.
В Европейском союзе гидроксид магния зарегистрирован в качестве пищевой добавки E528.
🎥 Видео
Органическая Химия — ЭТО НУЖНО ВИДЕТЬ! Гибридизация орбиталейСкачать

По-быстрому о лекарствах. Алгелдрат + магния гидроксид.Скачать

Химическая связь и строение молекул, С.Ю. Шавшукова, профессор кафедры ОАПХСкачать

Реакция на результаты ЕГЭ 2022 по русскому языкуСкачать