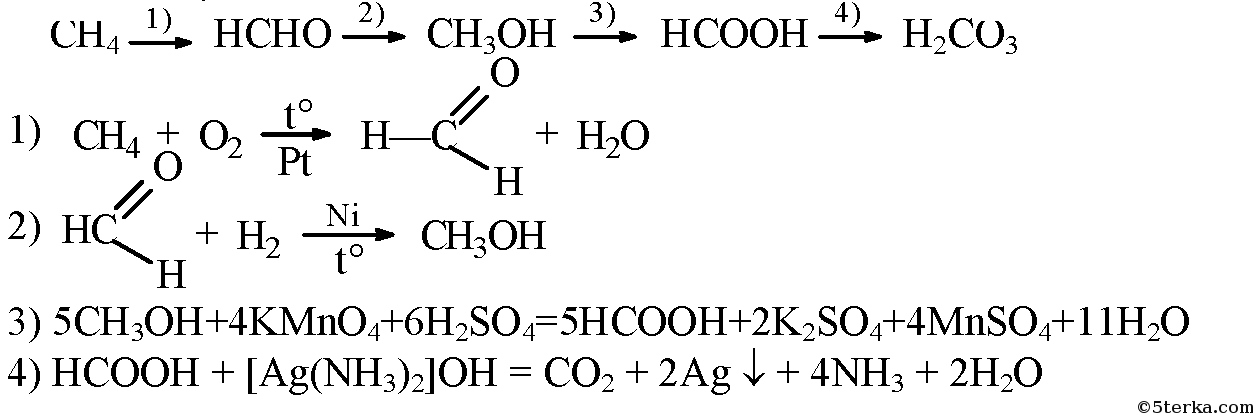- 1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: метан → формальдегид → метанол → муравьиная кислота → угольная кислота. Укажите условия протекания реакций.
- Химические свойства и способы получения муравьиного альдегида
- Реакции присоединения
- Реакции окисления
- Реакции полимеризации
- Получение формальдегида:
- Промышленные методы получения формальдегида
- Лабораторные способы получения формальдегида
- Формальдегид
- Химическое название
- Химические свойства Формальдегида
- Формальдегид, что это за вещество?
- Формальдегид, как получить из метана?
- Химические свойства
- Качественная реакция на Формальдегид
- Класс опасности Формальдегида. Чем он опасен?
- Как вывести из организма Формальдегид?
- Фармакологическое действие
- Фармакодинамика и фармакокинетика
- Показания к применению
- Противопоказания
- Побочные действия
- Инструкция по применению (Способ и дозировка)
- Передозировка
- Взаимодействие
- Условия продажи
- Условия хранения
- Срок годности
- Особые указания
- 🌟 Видео
Видео:Реакция с формальдегидомСкачать

1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: метан → формальдегид → метанол → муравьиная кислота → угольная кислота. Укажите условия протекания реакций.

задача №1
к главе «Тема VII(VI). Альдегиды, кетоны и карбоновые кислоты. Работа 4 Генетическая связь между углеводородами, спиртами, альдегидами и карбоновыми кислотами. Вариант 4».
Выделите её мышкой и нажмите CTRL + ENTER
Большое спасибо всем, кто помогает делать сайт лучше! =)
Нажмите на значок глаза возле рекламного блока, и блоки станут менее заметны. Работает до перезагрузки страницы.
Видео:Вся теория по карбоновым кислотам для ЕГЭ | Химия ЕГЭ для 10 класса | УмскулСкачать

Химические свойства и способы получения муравьиного альдегида
Задача 4.
Опишите химические свойства муравьиного альдегида. Приведите промышленные и лабораторные способы получения этого соединения.
Решение:
Атом углерода в карбонильной группе находится в состоянии sp 2 -гибридизации и образует 3 сигма-связи (две связи С-Н и одну связь С-О). Сигма-связь образована р-электронами атомов углерода и кислорода. Двойная связь С = О является сочетанием пи- и сигма-связей. Электронная плотность смещена в сторону атома кислорода.
В молекулах альдегидов имеется несколько реакционных центров: электрофильный центр (карбонильный атом углерода), участвующий в реакциях нуклеофильного присоединения; основный центр – атом кислорода с неподеленными электронными парами; Н-С(О)-Н кислотный центр, отвечающий за реакции конденсации; связь С-Н, разрывающаяся в реакциях окисления.
Реакции присоединения
1. Присоединение водорода (восстановление):
Н-CH=O + H2 (t,Ni) → Н-CH2-OH (метиловый спирт);
2. Присоединение аммиака:
3. Присоединение бисульфита натрия:
4. Присоединение циановодородной кислоты (синильной):
Н-CH=O + H-CN → H-CH(CN)-OH;
5. Присоединение гидразина с образованием гидразона:
6. Присоединение аминов с образованием N-замещенного имина:
7. Присоединение тиола с образованием дитиоацеталя (в кислой среде):
8. Присоединение воды с образованием гем-диола:
Н-CH=O + Н-ОН → Н-CH(OH)-OH.
При действии щелочи на формалин получаются метиловый спирт и муравьиная кислота:
2Н-CH=O + Н-ОН → СН3-ОН + Н-СООН.
В присутствии щелочей в водном растворе может идти и другая реакция: формальдегид конденсируется, причем в числе прочих продуктов получается один из простейших сахаров, или гексоз:
6Н-CH=O → C6H12O6 (Реакция Бутлерова: 2Н-CH → O + RbOH = -CH=O);
9. Присоединение спирта с образованием полуацеталя:
10. При взаимодействии формальдегида с ацетальдегидом в газовой фазе в присутствии катализаторов (окись алюминия, ацетат свинца на силикагеле и др.) образуется акролеин:
В водном растворе при большом избытке формальдегида под влиянием гидроокиси кальция конденсация с ацетальдегидом приводит к пентаэритриту:
Высшие алифатические альдегиды дают в этих условиях окси-или диоксиальдегиды (в зависимости от числа H-водородных атомов):
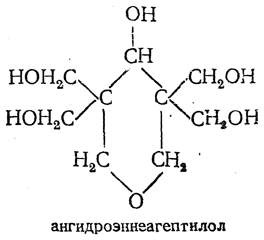
Формальдегид при взаимодействии с ацетоном образует ангидроэннеагептилол:
Реакции окисления
1. Альдегиды – довольно сильные восстановители, и поэтому легко окисляются различными окислителями, например: KMnO4, K2Cr2O7, [Ag(NH3)2]OH, Cu(OH)2. Все реакции идут при нагревании:
Реакции полимеризации
1. Реакция с фенолом с образованием фенолформальдегидных смол:
Получение формальдегида:
Промышленные методы получения формальдегида
1. Окисление метанола.
Реакция проводится в присутствии серебряного катализатороа и при нагревании (около 650—720 °C) или при 400 °C в присутствиии железо-никилиевых катализаторов:
2. Реакция дегидрирования метанола.
Процесс проводится на цинк-медных катализаторах при 600 °C:
3. Окисление метана.
Реакцию проводят при температуре 450 °C и давлении 1—2 МПа на катализаторе AlPO4.
Лабораторные способы получения формальдегида
1. Восстановление метанола:
Реакцию проводят, опуская раскаленную медную проволоку в пробирку с метанолом, образуется резкий запах альдегида. Если процесс окисления повторить несколько раз, то можно получить значительную концентрацию формальдегида.
2. Реакция метанола с перманганатом калия:
Смесь слабого раствора марганцовки и метанола нагревают до кипения. Появляется запах формальдегида, а фиолетовая окраска перманганата исчезает.
3. Реакция метанола с бихроматом калия:
В насыщенный раствор бихромата калия К2Сг2О7 добавляют такой же объем концентрированной серной кислоты. Затем по каплям вводят метанол. Очень осторожно подогревают смесь (отверстие пробирки направляют в сторону!). Реакция идет с выделением тепла. Желтая окраска хромовой смеси исчезает, и появляется зеленая окраска сульфата хрома.
Видео:Как получить ФОРМАЛЬДЕГИД из УРОТРОПИНА?Скачать

Формальдегид
Видео:Муравьиная и щавелевая кислоты.Химические свойства. Все 11 реакций ЕГЭ.Скачать

Химическое название
Метаналь или муравьиный альдегид
Видео:Эта СУПЕРКИСЛОТА Растворит Все что угодно!Скачать

Химические свойства Формальдегида
Формальдегид, что это за вещество?
Формальдегид – это альдегид муравьиной кислоты, алифатический альдегид. Метаналь и Формальдегид являются синонимами, это одно и то же вещество.
Как пахнет данное химическое соединение? Вещество имеет острый, резкий специфический запах. Структурная формула Формальдегида (рацемическая) – HCHO. Подробнее структура и пространственное строение молекулы представлено на фото Формальдегида в Википедии.
Что такое Формальдегид? По своим физическим свойствам данное вещество – бесцветный газ, который хорошо растворяется в воде, полярных растворителях и спиртах. Молярная масса = 30,3 грамма на моль. Средство плавится при -118 градусах Цельсия и кипит при -19.
В промышленности наибольшее распространена реакция производства Формальдегида путем его получения из метанола. Окисление происходит в присутствии серебряного катализатора, при температуре 650 градусов Цельсия и нормальном атмосферном давлении. Таким способом получают порядка 80% данного химического соединения.
Также существует метод, основанный на использовании железно-молибденового катализатора, при этом реакция протекает при температуре 300 градусов Цельсия. При таком химическом процессе степень превращения исходных реагентов достигает 99%.
Формальдегид, как получить из метана?
Промышленное производство вещества также осуществляется с помощью окисления метана. Реакция происходит при температуре 450 градусов и давлении 2 МПа, в присутствии фосфата алюминия.
Химические свойства
Вследствие низкой электронной плотности Формальдегид реагирует со слабыми нуклеофилами, вступает практически во все реакции, характерные для алифатических альдегидов. Формальдегид не реагирует с простыми эфирами.
Вещество вступает в реакции окисления с перманганатом калия, Си(ОН)2 и гидроксиддиамином серебра. Химическое соединение также реагирует с фенолом, в результат чего образуются фенолформальдегидные смолы и вода.
Формальдегид взаимодействует с азотной кислотой. Данную реакцию применяют для денитрации минерализатов, в результате чего выделяется азот, оксид азота 2, вода и СО2.
Качественная реакция на Формальдегид
Для того чтобы обнаружить данное вещество применяют реакцию с хромотроповой кислотой (появляется фиолетовая окраска), резорцином, фуксинсернистой кислотой (раствор становится, синим или сине-фиолетовым) или р-ом кодеина в серной кислоте.
Класс опасности Формальдегида. Чем он опасен?
Формалин относят ко второму классу опасности (взрывоопасное), средство самовоспламеняется при 435 градусах Цельсия. При попадании р-ра внутрь, он оказывает неблагоприятное влияние на человека, его репродуктивные органы, глаза, дыхательные пути, оказывает сильное действие на центральную нервную систему. Отрицательное влияние на здоровье человека чаще всего проявляется симптомами острого отравления. Прием 60-100 мл средства может оказаться смертельным. При вдыхании паров формалина развиваются: конъюнктивит, острый бронхит, отек легких, ощущение страха, судороги, головокружение, тошнота, шаткость походки. Симптомы отравления веществом, если оно проникло в ЖКТ: тошнота, дискомфорт в области желудка и пищевода, кровавая рвота, диарея, анурия и нефрит, отек гортани и даже рефлекторная остановка дыхания.
В косметике и медицинских препаратах допускается содержание Формальдегида (от 0,1 до 0,5 %). Его используют в качестве консерванта и антисептического компонента. Вещество нельзя применять для консервации продуктов в аэрозольной упаковке, различных спреев. Вред Формальдегида в лаке для ногтей несколько преувеличен. Хотя он и накапливается в ногтевой пластине, и вдыхание его паров может со временем негативно отразиться на здоровье, при соблюдении мер безопасности серьезного вреда данный компонент не приносит. Формалин может содержаться в составах для кератинового выпрямления волос. В более дорогой косметике процент содержания токсичных веществ сводится к нулю.
Как вывести из организма Формальдегид?
При отравлении данным химическим соединением может потребоваться промывание желудка 3% раствором уксуснокислого аммония, ацетата хлорида, прием активированного угля или солевого слабительного, очистительные клизмы, можно выпить молока, щелочную жидкость, сырые яйца. Места поражения и слизистые можно промыть мыльным раствором. Также необходимо обеспечить нормальное дыхание, работу сердечно-сосудистой системы, почек и печени.
Данное химическое соединение также содержится в древесных плитах ДСП (формальдегидные смолы). Существует допустимый класс эмиссии – количество вредного вещ-ва, которое со временем начинает выделяться из плиты. Класс эмиссии Формальдегида Е1 – это когда в 100 граммах ДСП содержится не более 10 мг свободного компонента.
Видео:Муравьиная кислота | Химия 10 класс | УмскулСкачать

Фармакологическое действие
Антисептическое, дезодорирующее.
Видео:Опыты по химии. Окисление муравьиного альдегида гидроксидом меди (II)Скачать

Фармакодинамика и фармакокинетика
Что такое Формальдегид и как он воздействует на организм? Данное химическое соединение угнетает секрецию потовых желез, дезинфицирует, угнетает жизнедеятельность болезнетворных бактерий. Средство оактвино по отношению к грамположительным и грамотрицательным бактериям, плесневым и дрожжеподобным грибам.
При местном использовании вещество не проникает в кровь и не оказывает системного воздействия на организм.
Видео:Опыты по химии. Реакция серебряного зеркалаСкачать

Показания к применению
Применение Формальдегида в медицине:
- для устранения повышенной потливости любого происхождения;
- в качестве профилактического средства при грибковых поражениях кожи.
Также лекарственное средство используется для обработки обуви и одежды.
Видео:Опыты по химии. Взаимодействие муравьиной кислоты с цинкомСкачать

Противопоказания
Средство противопоказано при наличии реакций гиперчувствительности к активному веществу и при воспалительных заболеваниях кожного покрова.
Видео:Качественная реакция на альдегиды с гидроксидом медиСкачать

Побочные действия
Применение лекарства может вызвать сухость и шелушение кожи, зуд и покраснения в месте нанесения. Иногда развиваются местные аллергические реакции.
Видео:Распаковка муравьиной фермы 🐜 #shorts #муравьинаяфермаСкачать

Инструкция по применению (Способ и дозировка)
Раствор Формальдегида используют исключительно наружно.
Вещество наносят на сухие участки с повышенной потливостью после душа. Обрабатывать поверхность необходимо осторожно, используя минимальное количество вещества. На подошвы и межпальцевые области средство наносят на 30-40 минут, на чувствительную кожу ладоней и подмышечных впадин – на 20 минут.
Лекарство нельзя использовать в течение суток после бритья. Одна процедура снижает потливость кожи на 7-12 дней. Если этого недостаточно, то процедуру повторяют несколько дней подряд.
Видео:Особые свойства муравьиной кислоты | ХимияСкачать

Передозировка
При частом и обильном использовании раствора или геля кожа может стать сухой и начать шелушиться.
Видео:Все химические свойства альдегидов | Химия ЕГЭ для 10 класса | УмскулСкачать

Взаимодействие
Лекарственное взаимодействие не установлено.
Видео:Тесты по химии. Муравьиная кислота. А34 ЦТ 2018Скачать

Условия продажи
Рецепт не требуется.
Видео:Опыты по химии. Взаимодействие муравьиной кислоты с карбонатом натрияСкачать

Условия хранения
В зависимости от лекарственной формы вещество хранят при температурах не превышающих 25 и не ниже 15 градусов Цельсия. Средство необходимо беречь от воздействия прямых солнечных лучей и детей.
Видео:10.3. Альдегиды и кетоны: Химические свойства. ЕГЭ по химииСкачать

Срок годности
Видео:11.3. Карбоновые кислоты и их соли: Химические свойства. ЕГЭ по химииСкачать

Особые указания
Раствор нельзя наносить на лицо, глаза и слизистые оболочки.
🌟 Видео
Альдегиды строение, свойства | Химия 10 класс #28 | ИнфоурокСкачать

8 класс. Массовая доля растворенного вещества. Решение задач.Скачать

МУРАВЬИ - Муравьиная кислотаСкачать