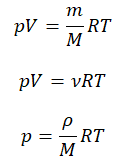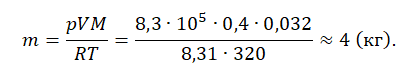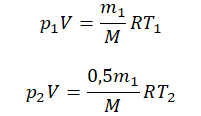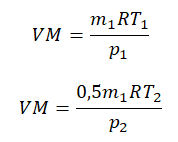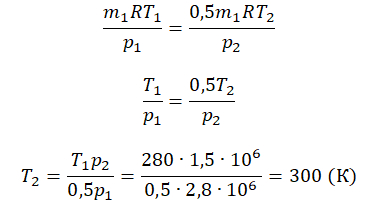- Что такое идеальный газ
- Свойства идеального газа
- Макроскопические параметры идеального газа
- Уравнение Менделеева-Клапейрона
- Вывод уравнения Менделеева–Клапейрона
- Физический смысл уравнения менделеева клапейрона
- Уравнение состояния идеального газа
- теория по физике 🧲 молекулярная физика, МКТ, газовые законы
- 🎬 Видео
Видео:Задачи на уравнение Менделеева-Клапейрона. Ч.1. Краткая теория + решение задачиСкачать

Что такое идеальный газ
Реальный газ является сложной системой, поэтому физики рассматривают его простейшую физическую модель — идеальный газ.
Физическая модель — упрощенная копия исследуемой реальной системы, которая отражает ее наиболее существенные свойства.
Физические модели получили широкое применение при моделировании.
Во внимание принимаются лишь те молекулы, учет которых необходим для объяснения закономерностей поведения реального газа в определенных интервалах давления и температуры.
В молекулярно–кинетической теории идеальным газом называют газ, состоящий из молекул, взаимодействие между которыми настолько мало, что им можно пренебречь.
То есть, мы предполагаем, что средняя кинетическая энергия молекул идеального газа во много раз больше потенциальной энергии их взаимодействия.
При достаточно большом разрежении, т.е. когда среднее расстояние между молекулами во много раз больше их размеров, реальный газ ведет себя почти так же как идеальный.
В данном случае мы можем пренебречь силами притяжения между молекулами.
Силы отталкивания проявляются в течение ничтожно малых промежутков времени, когда молекулы сталкиваются друг с другом.
Идеальный газ бывает:
- одноатомный (пример:He, Ar);
- двухатомный (пример: H 2 , O 2 );
- многоатомный (пример: C O 2 , воздух).
Свойства идеального газа
- расстояние между молекулами намного больше самих молекул, поэтому взаимодействие между ними ничтожно мало, им можно пренебречь;
- размеры молекул несущественны;
- молекулы представляют собой упругие шары;
- их движение подчиняется законам Ньютона;
- силы отталкивания возникают только при упругом соударении;
- давление газа на стенки сосуда оказывается за счет ударов молекул газа;
- молекулы движутся хаотично, т.е. все направления равноправны.
Видео:Физика 10 класс: Уравнение Клапейрона-МенделееваСкачать

Макроскопические параметры идеального газа
Макроскопические параметры состояния газа — физические величины, характеризующие состояние макроскопических тел в целом, без учета их молекулярного строения.
Всего величин 3:
- T — температура, единица измерений — [К];
- V — объем, единица измерений — [ м 3 ] ;
- P — давление, единица измерений — [Па].
Определение 3
Процессы, которые протекают, когда один из данных параметров неизменен, называют изопроцессами.
Газовым законом называют количественную зависимость между двумя параметрами при определенном значении третьего.
Абсолютный нуль — предельная температура, при которой давление идеального газа обращается в нуль при фиксированном объеме или объем идеального газа стремится к нулю при неизменном давлении.
Видео:Физика. МКТ: Уравнение Менделеева-Клапейрона для идеального газа. Центр онлайн-обучения «Фоксфорд»Скачать

Уравнение Менделеева-Клапейрона
В 1834 году Эмиль Клапейрон — французский физик и инженер — проанализировав уже ранее открытые газовые законы, вывел уравнение, названное в его честь.
В 1874 Д. И. Менделеев объединил его с законом Авогадро, образуя объем Vm и отнеся его для 1 моля, вывел уравнение состояния идеального газа.
p V = m M R T — для произвольной массы газа.
- p — давление (Па);
- V — объем ( m 3 );
- m — масса (кг);
- M — молярная масса (кг/моль);
- R — универсальная газовая постоянная: R = 8 , 31 Д ж / ( м о л ь * К ) ;
- T — температура (К);
- k — постоянная Больцмана: k = 1 , 38 * 10 — 23 Д ж * K — 1 ;
- N A — постоянная Авогадро.
Киломоли всех веществ содержат одинаковое количество молекул, равное числу Авогадро: N A = 6 , 02 * 10 2 3 .
Смысл уравнения Менделеева-Клайперона — это зависимость между параметрами идеального газа.
Является основной формулой для решения задач на термодинамику.
Уравнение состояния идеального газа позволяет вычислить его плотность при различных условиях:
d = p M R T ,
где d — плотность.
Видео:Урок 2.Уравнение Менделеева-Клапейрона. Решение задач. База. ЕГЭСкачать

Вывод уравнения Менделеева–Клапейрона
Представим вывод формулы с пояснением:
Связываем две данные формулы.
В формулу p V T = K N
подставляем N = m N A M .
p V T = m M N A k
Конечный вид формулы:
Для более краткой записи T можно перенести в правую часть формулы, а m M заменить на v — количество вещества.
Предлагается выбрать более удобную для себя форму записи.
Видео:Успеть за 300 секунд, #3: Уравнение Клапейрона-МенделееваСкачать

Физический смысл уравнения менделеева клапейрона
Уравнение Менделеева-Клапейрона — уравнение состояния для идеального газа, отнесенное к 1 молю газа. В 1874 г. Д. И. Менделеев на основе уравнения Клапейрона объединив его с законом Авогадро, используя молярный объем Vm и отнеся его к 1 молю, вывел уравнение состояния для 1 моля идеального газа:
pV = RT , где R — универсальная газовая постоянная,
R = 8,31 Дж/(моль . К)
Уравнение Клапейрона-Менделеева показывает, что для данной массы газа возможно одновременно изменение трех параметров, характеризующих состояние идеального газа. Для произвольной массы газа М, молярная масса которого m: pV = (М/m) . RT. или pV = NАkT,
где NА — число Авогадро, k — постоянная Больцмана.
С помощью уравнения состояния идеального газа можно исследовать процессы, в которых масса газа и один из параметров — давление, объем или температура — остается постоянным, а изменяются только остальные два и получить теоретически газовые законы для этих условий изменения состояния газа.
Такие процессы называют изопроцессами. Законы, описывающие изопроцессы, были открыты задолго до теоретического вывода уравнения состояния идеального газа.
Изотермический процесс — процесс изменения состояния системы при постоянной температуре. Для данной массы газа произведение давления газа на его объем постоянно, если температура газа не меняется. Это закон Бойля — Мариотта.
Для того, чтобы температура газа оставалась в процессе неизменной, необходимо, чтобы газ мог обмениваться теплотой с внешней большой системой — термостатом. Роль термостата может играть внешняя среда (воздух атмосферы). Согласно закону Бойля-Мариотта, давление газа обратно пропорционально его объему: P1V1=P2V2=const. Графическая зависимость давления газа от объема изображается в виде кривой (гиперболы), которая носит название изотермы. Разным температурам соответствуют разные изотермы.
Изобарный процесс — процесс изменения состояния системы при постоянном давлении. Для газа данной массы отношение объема газа к его температуре остается постоянным, если давление газа не меняется. Это закон Гей-Люссака. Согласно закону Гей-Люссака, объем газа прямо пропорционален его температуре: V/T=const. Графически эта зависимость в координатах V-T изображается в виде прямой, выходящей из точки Т=0. Эту прямую называют изобарой. Разным давлениям соответствуют разные изобары. Закон Гей-Люссака не соблюдается в области низких температур, близких к температуре сжижения (конденсации) газов.
Изохорный процесс — процесс изменения состояния системы при постоянном объеме. Для данной массы газа отношение давления газа к его температуре остается постоянным, если объем газа не меняется. Этот газовый закон Шарля. Согласно закону Шарля, давление газа прямо пропорционально его температуре: P/T=const. Графически эта зависимость в координатах P-Т изображается в виде прямой, выходящей из точки Т=0. Эту прямую называют изохорой. Разным объемам соответствуют разные изохоры. Закон Шарля не соблюдается в области низких температур, близких и температуре сжижения (конденсации) газов.
Итак, из закона pV = (М/m) . RT выводятся следующие законы:
p = const => V/T = const — закон Гей — Люссака .
V= const => p/T = const — закон Шарля
Если идеальный газ является смесью нескольких газов, то согласно закону Дальтона, давление смеси идеальных газов равно сумме парциальных давлений входящих в нее газов. Парциальное давление — это такое давление, которое производил бы газ, если бы он один занимал весь объем, равный объему смеси.
Некоторых, возможно, интересует вопрос, каким образом удалось определить постоянную Авогадро NA = 6,02·10 23 ? Значение числа Авогадро было экспериментально установлено только в конце XIX – начале XX века. Опишем один из таких экспериментов.
В откачанный до глубокого вакуума сосуд объемом V = 30 мл поместили навеску элемента радия массой 0,5 г и выдержали там в течение одного года. Было известно, что за секунду 1 г радия испускает 3,7·10 10 альфа-частиц. Эти частицы представляют собой ядра гелия, которые тут же принимают электроны из стенок сосуда и превращаются в атомы гелия. За год давление в сосуде выросло до 7,95·10 -4 атм (при температуре 27 о С). Изменением массы радия за год можно пренебречь. Итак, чему равна NA?
Сначала найдем, сколько альфа-частиц (то есть атомов гелия) образовалось за один год. Обозначим это число как N атомов:
N = 3,7·10 10 · 0,5 г · 60 сек · 60 мин · 24 час · 365 дней = 5,83·10 17 атомов.
Запишем уравнение Клапейрона-Менделеева PV = nRT и заметим, что число молей гелия n = N/NA. Отсюда:
NA = NRT = 5,83 . 10 17 . 0,0821 . 300 = 6,02 . 10 23
PV 7,95 . 10 -4 . 3 . 10 -2
В начале XX века этот способ определения постоянной Авогадро был самым точным. Но почему так долго (в течение года) длился эксперимент? Дело в том, что радий добывается очень трудно. При его малом количестве (0,5 г) радиоактивный распад этого элемента дает очень мало гелия. А чем меньше газа в замкнутом сосуде, тем меньшее он создаст давление и тем большей будет ошибка измерения. Понятно, что ощутимое количество гелия может образоваться из радия только за достаточно долгое время.
Видео:Уравнение Менделеева - Клапейрона за 10 минут | Физика с Никитой АрхиповымСкачать

Уравнение состояния идеального газа
теория по физике 🧲 молекулярная физика, МКТ, газовые законы
Уравнение состояния идеального газа было открыто экспериментально. Оно носит название уравнения Клапейрона — Менделеева. Это уравнение устанавливает математическую зависимость между параметрами идеального газа, находящегося в одном состоянии. Математически его можно записать следующими способами:
Уравнение состояния идеального газа
Внимание! При решении задач важно все единицы измерения переводить в СИ.
Пример №1. Кислород находится в сосуде вместимостью 0,4 м 3 под давлением 8,3∙10 5 Па и при температуре 320 К. Чему равна масса кислорода? Молярная масса кислорода равна 0,032 кг/моль.
Из основного уравнения состояния идеального газа выразим массу:
Уравнение состояния идеального газа следует использовать, если газ переходит из одного состояния в другое и при этом изменяется его масса (количество вещества, число молекул) или молярная масса. В этом случае необходимо составить уравнение Клапейрона — Менделеева отдельно для каждого состояния. Решая систему уравнений, легко найти недостающий параметр.
Подсказки к задачам
| Давление возросло на 15% | p2 = 1,15p1 |
| Объем увеличился на 2% | V2 = 1,02V1 |
| Масса увеличилась в 3 раза | m2 = 3m1 |
| Газ нагрелся до 25 о С | T2 = 25 + 273 = 298 (К) |
| Температура уменьшилась на 15 К (15 о С) | T2 = T1 – 15 |
| Температура уменьшилась в 2 раза | 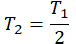 |
| Масса уменьшилась на 20% | m2 = 0,8m1 |
| Выпущено 0,7 начальной массы | |
| Какую массу следует удалить из баллона? | Нужно найти разность начальной и конечной массы: |
| Газ потерял половину молекул | 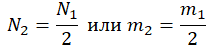 |
| Молекулы двухатомного газа (например, водорода), диссоциируют на атомы | 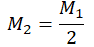 |
| Озон (трехатомный кислород) при нагревании превращается в кислород (двухатомный газ) | M (O3) = 3Ar (O)∙10 –3 кг/моль M (O2) = 2Ar (O)∙10 –3 кг/моль |
| Открытый сосуд | Объем V и атмосферное давление pатм остаются постоянными |
| Закрытый сосуд | Масса m, молярная масса M, количество вещества ν, объем V, число N и концентрация n частиц, плотность ρ— постоянные величины |
| Нормальные условия | Температура T0 = 273 К Давление p0 = 10 5 Па |
| Единицы измерения давления | 1 атм = 10 5 Па |
Пример №2. В баллоне содержится газ под давлением 2,8 МПа при температуре 280 К. Удалив половину молекул, баллон перенесли в помещение с другой температурой. Определите конечную температуру газа, если давление уменьшилось до 1,5 МПа.
2,8 МПа = 2,8∙10 6 Па
1,5 МПа = 1,5∙10 6 Па
Так как половина молекул была выпущена, m2 = 0,5m1. Объем остается постоянным, как и молярная масса. Учитывая это, запишем уравнение состояния идеального газа для начального и конечного случая:
Преобразим уравнения и получим:
Приравняем правые части и выразим искомую величину:

Алгоритм решения
Решение
График построен в координатах (V;Ek). Процесс 1–2 представляет собой прямую линию, исходящую из начала координат. Это значит, что при увеличении объема растет средняя кинетическая энергия молекул. Но из основного уравнения МКТ идеального газа следует, что мерой кинетической энергии молекул является температура:
Следовательно, когда кинетическая энергия молекул растет, температура тоже растет.
Запишем уравнение Менделеева — Клапейрона:
Так как количество вещества одинаковое для обоих состояния 1 и 2, запишем:
ν R = p 1 V 1 T 1 . . = p 2 V 2 T 2 . .
Мы уже выяснили, что объем и температура увеличиваются пропорционально. Следовательно, давление в состояниях 1 и 2 равны. Поэтому процесс 1–2 является изобарным, давление во время него не меняется.
Процесс 2–3 имеет график в виде прямой линии, перпендикулярной кинетической энергии. Так как температуры прямо пропорциональна кинетической энергии, она остается постоянной вместе с этой энергией. Следовательно, процесс 2–3 является изотермическим, температура во время него не меняется. Мы видим, что объем при этом процессе уменьшается. Но так как объем и давление — обратно пропорциональные величины, то давление на участке 2–3 увеличивается.
pазбирался: Алиса Никитина | обсудить разбор | оценить
На высоте 200 км давление воздуха составляет примерно 10 –9 от нормального атмосферного давления, а температура воздуха Т – примерно 1200 К. Оцените плотность воздуха на этой высоте.
🎬 Видео
Уравнение состояния идеального газа. 10 класс.Скачать

Урок 156. Уравнение состояния идеального газа. Квазистатические процессыСкачать

Физика 10 класс (Урок№20 - Уравнение состояния идеального газа. Газовые законы.)Скачать

Уравнение Менделеева-Клапейрона и 4 изопроцесса для состояния идеального газа (графики и смысл).Скачать

Уравнение состояния идеального газа | Физика 10 класс #33 | ИнфоурокСкачать

62. Уравнение Клапейрона-МенделееваСкачать

Решение графических задач на тему Газовые законыСкачать

🔴 ЕГЭ-2023 по физике. Уравнение Менделеева-Клапейрона. Закон ДальтонаСкачать

Идеальный газ. Основное уравнение молекулярно-кинетической теории газов. 10 класс.Скачать

Урок 194. Уравнение Ван-дер-ВаальсаСкачать

Урок 149. Абсолютная температурная шкалаСкачать

Урок 158. Задачи на газовые законы - 1Скачать

Газовые законы. Изопроцессы | Физика 10 класс #34 | ИнфоурокСкачать

Физика. МКТ: Основное уравнение МКТ. Центр онлайн-обучения «Фоксфорд»Скачать