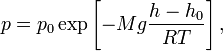В статье рассмотрена модель идеального газа, приведено основное уравнение молекулярно-кинетической теории и его вывод.
Чтобы объяснить свойства материи в газообразном состоянии, в физике применяется модель идеального газа. Идеальный газ — разреженный, состоящий из одного типа атомов газ, частицы которого не взаимодействуют между собой. Помимо основных положений МКТ эта модель предполагает, что:
- молекулы имеют пренебрежимо малый объем в сравнении с объемом емкости
- при сближении частиц друг с другом и с границами емкости имеют место силы отталкивания
- Основное уравнение молекулярно-кинетической теории
- Вывод основного уравнения МКТ
- Основные уравнения МКТ. Физический смысл
- Основное уравнение МКТ идеального газа
- теория по физике 🧲 молекулярная физика, МКТ, газовые законы
- Измерение температуры
- Основное уравнение МКТ идеального газа
- Следствия из основного уравнения МКТ идеального газа
- 📸 Видео
Видео:Физика 10 класс (Урок№18 - Основное уравнение МКТ.)Скачать

Основное уравнение молекулярно-кинетической теории
Физический смысл основного уравнения МКТ заключается в том, что давление идеального газа — это совокупность всех ударов молекул о стенки сосуда. Это уравнение можно выразить через концентрацию частиц, их среднюю скорость и массу одной частицы:
p – давление молекул газа на границы емкости,
m0 – масса одной молекулы,
n — концентрация молекул, число частиц N в единице объема V;
v 2 — средне квадратичная скорость молекул.
Видео:Физика. МКТ: Основное уравнение МКТ. Центр онлайн-обучения «Фоксфорд»Скачать

Вывод основного уравнения МКТ
Частицы идеального газа при соударениях с границами емкости ведут себя как упругие тела. Такое взаимодействие описывается согласно законам механики. При соприкосновении частицы с границей емкости проекция vx скоростного вектора на ось ОХ, проходящую под прямым углом к границе сосуда, меняет свой знак на противоположный, но сохраняется неизменной по модулю:
Поэтому после соударения частицы с границей емкости проекция импульса молекулы на ось ОХ меняется с mv1x = –mvx на mv2x = mvx.
Изменение импульса молекулы ΔP равняется удвоенному произведению массы молекулы на ее скорость:
Поскольку в каждом из шести основных направлений декартовой системы координат (вверх, вниз, вперед, назад, вправо, влево) движется одна шестая часть частиц N/6. Тогда число частиц, которые сталкиваются с каждой стенкой за время Δt равно:
S – площадь этой стенки
n — концентрация частиц
Давление p равно отношению силы F к площади S, на которую действует эта сила:
Суммарная сила, с которой частицы давят на стенку равна отношению произведения числа этих частиц N и изменения импульса ΔP ко времени, в течение которого происходит давление:
Исходя из вышенаписанного получаем:
Если заменить среднее значение кинетической энергии поступательного движения молекул — E:
и подставить эту формулу в основное уравнение МКТ, получим давление идеального газа:
Давление идеального газа равняется двум третям средней кинетической энергии поступательного движения молекул на единицу объема. При решении задач реальный газ можно считать идеальным газом, если он одноатомный и можно пренебречь взаимодействием между частицами.
Понравилась статья, расскажите о ней друзьям:
Видео:Идеальный газ. Основное уравнение молекулярно-кинетической теории газов. 10 класс.Скачать

Основные уравнения МКТ. Физический смысл
температуры. 
Больцмана (отношение универсальной газовой постоянной R к числу Авогадро NA), i — число степеней свободы молекул (i = 3 в большинстве задач про идеальные газы, где молекулы предполагаются сферами малого радиуса, физическим аналогом которых могут служить инертные газы), а T — абсолютная температура. Физический смысл температуры Т= t 0 С +273,15 К, Ек=⅔kТ, где k=R/NA, R – универсальная газовая постоянная, Температура является мерой кинетической енергии движения молекул вещества, чем больше скорость, тем больше температура и наоборот.
1. Основное уравнение МКТ связывает макроскопические параметры (давление, объём, температура) газовой системы с микроскопическими (масса молекул, средняя скорость их движения). Основные положения молекулярно-кинетической теории: — вещество состоит из частиц — молекул и атомов, разделенных промежутками, — эти частицы хаотически движутся, — частицы взаимодействуют друг с другом. Макроскопическое состояние характеризует всю систему в целом и описывается макроскопическими параметрами. Выделяют внутренние и внешние параметры. Внутренние:давление, температура, степень диссоциации, полный магнитный момент. Внешние: объем, характеристики внешних силовых полей (например: Е, В, g). Микроскопическое состояние задается набором параметров, характеризующих все частицы в системе. Для классической системы: набор координат, импульсов; для квантовой системы: набор квантовых чисел (n, l, m, s,…) В классической статистической механике теорема о равнораспределении кинетической энергии по степеням свободы позволяет связать температуру системы с её средней энергией. В первоначальном виде теорема равнораспределения утверждала, что при тепловом равновесии энергия разделена одинаково между её различными формами, например, средняя кинетическая энергия поступательного движения молекулы должна равняться средней кинетической энергии её вращательного движения. Основное уравнение МКТ:

к числу Авогадро, а i — число степеней свободы молекул. Основное уравнение МКТ связывает макроскопические параметры (давление, объём, температура) газовой системы с микроскопическими (масса молекул, средняя скорость их движения). Пусть имеется кубический сосуд с ребром длиной l и одна частица массой m в нём. Обозначим скорость движения vx, тогда перед столкновением со стенкой сосуда импульс частицы равен mvx, а после — − mvx, поэтому стенке передается импульс p = 2mvx. Время, через которое частица сталкивается
с одной и той же стенкой, равно 



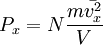




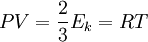

Уравнение состояния идеального газа (иногда уравнение Клапейрона или уравнение Клапейрона — Менделеева) — формула, устанавливающая зависимость между давлением, молярным объёмом и абсолютной температурой идеального газа. Уравнение имеет вид: 

21- Реальные газы. газ, который не описывается уравнением состояния идеального газа Клапейрона — Менделеева. Зависимости между его параметрами показывают, что молекулы в реальном газе взаимодействуют между собой и занимают определенный объём. Состояние реального газа часто на практике описывается обобщённым уравнением
Менделеева — Клапейрона:
где p — давление; V — объем T — температура; Zr = Zr (p,T) — коэффициент сжимаемости газа; m — масса; М — молярная масса; R — газовая постоянная.Жидкости мало сжимаемы. Поэтому дальше, даже при незначительном уменьшении объёма, давление быстро будет возрастать. Поскольку весь процесс происходит при постоянной температуре T, кривую, что изображает зависимость давления р от объёма V, называют изотермой. При объёме V1 начинается конденсация газа, а при объёме V2 она заканчивается. Если V > V1 то вещество будет в газообразном состоянии, а при V
22-Барометрическая формула. Для идеального газа, имеющего постоянную температуру T и находящегося в однородном поле тяжести (во всех точках его объёма ускорение свободного падения g одинаково), барометрическая
формула имеет следующий вид:
где p — давление газа в слое, расположенном на высоте h, p0 — давление на нулевом уровне (h = h0), M — молярная масса газа, R — газовая постоянная, T — абсолютная температура. Из барометрической формулы следует, что концентрация молекул n (или плотность газа) убывает с высотой по тому же
закону: 
k — постоянная Больцмана. Барометрическая формула может быть получена из закона распределения молекул идеального газа по скоростям и координатам в потенциальном силовом поле (см. Статистика Максвелла — Больцмана). При этом должны выполняться два условия: постоянство температуры газа и однородность силового поля. Аналогичные условия могут выполняться и для мельчайших твёрдых частичек, взвешенных в жидкости или газе. Основываясь на этом, французский физик Ж. Перрен в 1908 году применил барометрическую формулу к распределению по высоте частичек эмульсии, что позволило ему непосредственно определить значение постоянной Больцмана. Барометрическая формула показывает, что плотность газа уменьшается с высотой по экспоненциальному закону. Величина , определяющая быстроту спада плотности, представляет собой отношение потенциальной энергии частиц к их средней кинетической энергии, пропорциональной kT. Чем выше температура T, тем медленнее убывает плотность с высотой. С другой стороны, возрастание силы тяжести mg (при неизменной температуре) приводит к значительно большему уплотнению нижних слоев и увеличению перепада (градиента) плотности. Действующая на частицы сила тяжести mg может изменяться за счёт двух величин: ускорения g и массы частиц m. Следовательно, в смеси газов, находящейся в поле тяжести, молекулы различной массы по-разному распределяются по высоте. Реальное распределение давления и плотности воздуха в земной атмосфере не следует барометрической формуле, так как в пределах атмосферы температура и ускорение свободного падения меняются с высотой и географической широтой. Кроме того, атмосферное давление увеличивается с концентрацией в атмосфере паров воды. Барометрическая формула лежит в основе барометрического нивелирования — метода определения разности высот Δh между двумя точками по измеряемому в этих точках давлению (p1 и p2). Поскольку атмосферное давление зависит от погоды, интервал времени между измерениями должен быть возможно меньшим, а пункты измерения располагаться не слишком далеко друг от друга. Барометрическая формула записывается в этом случае в виде: Δh = 18400(1 + at)lg(p1 / p2) (в м), где t — средняя температура слоя воздуха между точками измерения, a — температурный коэффициент объёмного расширения воздуха. Погрешность при расчётах по этой формуле не превышает 0,1—0,5 % от измеряемой высоты. Более точна формула Лапласа, учитывающая влияние влажности воздуха и изменение ускорения свободного падения.
23Внутренняя энергиятермодинамической системы. Теплота и теплоемкость. Законы термодинамики применяются к так называемой термодинамической системе, под которой понимается макроскопическое тело (тело, состоящее из большого числа частиц) или группа макроскопических тел, которой свойственны процессы, сопровождающиеся переходом теплоты в другие виды энергии и наоборот. Примером термодинамической системы может служить, например газ под поршнем, организм человека, животных и т.д. Термодинамическая система обладает кинетической энергией системы как целого Ек, потенциальной энергией обусловленной наличием поля внешних сил Еп (например, гравитационного поля Земли) и внутренней энергией U. Таким образом, полная энергия термодинамической системы: Е = Ек+ Еп+U Внутренняя энергия складывается из кинетической энергии хаотического движения молекул, потенциальной энергии межмолекулярного взаимодействия, энергии колебательного движения атомов, энергии электронных оболочек атомов. Внутренняя энергия системы является функцией ее параметров состояния P, V, T. Внутренняя энергия – однозначная функция термодинамического состояния системы – в каждом состоянии система обладает вполне определенной внутренней энергией. При переходе системы из одного состояния в другое изменение внутренней энергии ΔU определяется только разностью значений внутренней энергии этих состояний и не зависит от пути перехода. Изменение состояния системы тел обусловлено передачей энергии от одного тела системы к другому. Передача энергии может происходить либо в форме механической работы А, либо в форме теплоты Q. Работа есть мера механической энергии, переданной от одного тела к другому. Совершение работы всегда сопровождается перемещением тела или его частей. Сообщение теплоты не связано с перемещением тел, а обусловлено тем, что отдельные молекулы более нагретого тела передают свою кинетическую энергию молекулам менее нагретого тела в процессе теплообмена. К теплообмену относятся: теплопроводность, конвекция, тепловое излучение. Теплопроводность – передача теплоты от более нагретого тела к менее нагретому телу при соприкосновении этих тел. Конвекция – перенос теплоты потоком движущейся жидкости или газа из одних областей занимаемого ими объема в другие. Теплота и работа как две формы передачи энергии тесно связаны друг с другом. Теплота может переходить в работу и, наоборот, работа в теплоту. В СИ работа и теплота измеряются в одинаковых единицах – джоулях. Внесистемная единица измерения количества теплоты калория (кал). 1 кал = 4,18 Дж. Количество теплоты, переданное телу или отданное телом, определяется по формуле Q = CΔT = CΔt где С – физическая величина, получившая название теплоемкость. Теплоемкость – количество теплоты, которое необходимо сообщить телу (забрать у тела) для изменения его температуры на один градус. Единица измерения теплоемкости – Дж/град. Теплоемкость тела: С = cm где m – масса тела, с – удельная теплоемкость. Удельная теплоемкость – количество теплоты необходимое для изменения температуры единицы массы данного вещества на один градус. Единица измерения удельной теплоемкости – Дж/кг·град. Помимо этого выделяют еще теплоемкость при постоянном давлении – Сp и теплоемкость при постоянном объеме Сv.
24 Первый закон термодинамики. Одним из основных законов термодинамики является первое начало (закон) термодинамики, который гласит: количество теплоты, сообщенное системе, расходуется на изменение ее внутренней энергии и на совершение работы системой против внешних сил. Q = ΔU + A Данный закон выражает закон сохранения энергии, согласно которому энергия любой изолированной системы остается постоянной. В дифференциальной форме он имеет следующий вид: dQ = dU + dA где dU – малое приращение внутренней энергии системы, dQ — элементарное количество теплоты, dA – элементарная работа. Первый закон термодинамики запрещает существование вечного двигателя первого рода, воображаемого механизма, который совершал бы работу, превышающую получаемую им энергию. Действительно, двигатель это система, периодически возвращающаяся в исходное состояние. Для такой системы изменение ее внутренней энергии ΔU = 0. Тогда, согласно первому закону термодинамики А = Q.
25Обратимые и необратимые процессы. Равновесным состоянием системы называют такое состояние, при котором параметры системы имеют определенные значения, остающиеся без изменения сколь угодно долго. Пусть некая система переходит из состояния 1 с параметрами P1, V1, T1 в состояние 2 с параметрами P2, V2, T2 Процесс перехода системы из состояния 1 в состояние 2 называется обратимым, если возможен процесс перехода системы из 2 в 1, при котором система, пройдя последовательно, но в обратном порядке, через все состояния первого процесса вернется в исходное состояние 1. При этом ни в системе, ни в окружающей среде не останется никаких изменений. В противном случае процесс называется необратимым. В природе нет обратимых процессов. Все реальные процессы необратимы, так как они сопровождаются теплопроводностью, трением и т.д. Обратимые процессы – понятие идеализированное. Однако их изучение представляет определенный интерес, поскольку в целом ряде конкретных задач реальные процессы с большой степенью точности можно рассматривать как обратимые.
26 Цикл Карно. Второй закон термодинамики. Более конкретную формулировку второго закона термодинамики можно получить из рассмотрения, так называемого цикла Карно. Предварительно необходимо рассмотреть понятия адиабатического процесса и кругового процесса (цикла). Адиабатическими называются процессы, происходящие при отсутствии теплообмена между системой и окружающей средой. В этом случае в выражении для первого закона термодинамики dQ = 0. Для осуществления адиабатических процессов необходима абсолютная теплоизоляция системы от окружающей среды. В природе нет абсолютных теплоизоляторов. Поэтому реальные процессы могут только быть близкими к адиабатическим. Круговым процессом, или циклом, называется процесс, в результате которого система, пройдя через ряд состояний, возвращается в исходное состояние. На графике круговой процесс изобразится замкнутой кривой линией. При этом работа А, совершаемая в ходе цикла, численно равна площади ограниченной данной замкнутой линией. В 1824 году французский инженер Сади Карно теоретически рассмотрел работу идеальной тепловой машины, состоящей из одного моля идеального газа (рабочее тело), заключенного в цилиндр под поршнем, нагревателя и холодильника. Во время цикла Карно процесс протекает без трения, лучеиспускания и т.д., т.е. без необратимых потерь. Цикл Карно ограничен двумя изотермами и двумя адиабатами В точке 1 рабочее тело приводится в контакт с нагревателем при температуре нагревателя T1 и изотермически расширяется (процесс 1→2). В точке 2 нагреватель убирают, и газ адиабатно расширяется (процесс 2→3). В точке 3 газ приводят в контакт с холодильником, который имеет температуру T2 (T2 Зададимся вопросом: может ли тепловая машина превращать всю получаемую теплоту в работу, не отдавая части теплоты холодильнику? В этом случае, рассматриваемый процесс принимает вид: 1→2→3→2→1. Площадь, ограничиваемая такой кривой, а, следовательно, и совершаемая работа будут равны 0. Таким образом, отдача части теплоты холодильнику является необходимым условием совершения работы. Но тогда A 3 . Относительная влажность φ – это выраженное в процентах отношение абсолютной влажности ρ к тому количеству водяного пара ρ0, которое необходимо для насыщения 1 м 3 воздуха при данной температуре (или отношение давления водяного пара p к давлению насыщенного пара p0 при той же температуре)


важную роль в процессах влагооборота и теплообмена на земном шаре. При конденсации водяного пара образуются: роса, туман и облака. Человеческий организм за сутки испаряет до двух килограммов воды. Испарение пота с поверхности кожи предотвращает перегрев организма. Для замедления процесса испарения растения засушливых районов имеют обычно маленькие и немногочисленные листья.
31Электризация. Электрический заряд. электризация бывает двух видов. Один вид назвали положительной, второй – отрицательной. Причем одноименно наэлектризованные тела отталкиваются, а разноименно притягиваются. В 1881 году немецкий физик Гельмгольц выдвинул гипотезу о том, что электрические явления обусловлены существованием электрически заряженных элементарных частиц. Данная гипотеза подтвердилась открытием в 1897 году электрона, а затем протона и многих других электрически заряженных частиц. Говорят, что эти частицы несут электрический заряд, который обозначают буквой q и измеряют в кулонах (Кл). Заряд электрона отрицательный и равен qe= — 1,6·10 -19 Кл. Заряд протона положительный и равен по величине заряду электрона. Такой заряд называют элементарным электрическим зарядом и часто обозначают е. Это наименьший заряд, который может иметь частица или тело. Заряд любого тела кратен элементарному заряду q = ±ne где n = 1, 2, 3, … Все тела состоят из атомов. Атом в свою очередь состоит из положительно заряженного ядра (в состав которого входят положительно заряженные протоны и нейтральные нейтроны) и отрицательно заряженные электроны. В нормальном состоянии атом электрически нейтрален (суммарный заряд электронов и протонов равен 0). В результате внешнего воздействия атом может потерять один или несколько электронов и стать положительно заряженным (положительным ионом) или наоборот присоединить к себе один или несколько электронов и стать отрицательно заряженным (отрицательным ионом). Фактически положительный заряд какого-либо тела представляет собой недостаток электронов, а отрицательный – избыток электронов. Так при электризации трением часть электронов переходит от одного тела к другому. При этом электризуются оба тела: одно положительно, второе отрицательно.
32Закон сохранения электрического заряда. Закон Кулона. Электрические заряды могут перемещаться в пределах одного тела или от одного тел к другому, но не могут уничтожаться и создаваться. Иными словами в изолированной системе алгебраическая сумма электрических зарядов остается постоянной. Это положение называется законом сохранения электрического заряда. Тела, в которых электрические заряды могут свободно перемещаться, называются проводниками. К ним относятся металлы, электролиты и ионизированные газы. Тела, в которых возможность перемещения зарядов весьма ограничена (мало свободных электронов и практически нет ионов) называются диэлектриками. Промежуточное положение занимают полупроводники. Первые количественные исследования по взаимодействию электрически заряженных тел были проведены французским физиком Кулоном. Опытным путем было установлено, что два точечных заряда взаимодействуют с силой, пропорциональной величинам зарядов и обратно пропорциональной квадрату расстояния между ними и направленной вдоль прямой соединяющие эти
заряды. 
характеристика электрических свойств среды в которой находятся заряды. Для вакуума и воздуха ε = 1, для других веществ ε > 1. Коэффициент пропорциональности k в системе
СИ равен 
называемая электрическая постоянная. Она не имеет физического смысла и введена для упрощения формул электричества в системе СИ.
33. Электрическое поле и его напряженность. Электрическое поле. Для объяснения природы электрических взаимодействий заряженных тел необходимо допустить наличие в окружающем заряды пространстве физического агента, осуществляющего это взаимодействие. В соответствии с теорией близкодействия, утверждающей, что силовые взаимодействия между телами осуществляются через посредство особой материальной среды, окружающей взаимодействующие тела и передающей любые изменения таких взаимодействий в пространстве с конечной скоростью, таким агентом является электрическое поле.
Электрическое поле создается как неподвижными, так и движущимися зарядами. О наличии электрического поля можно судить, прежде всего, по его способности оказывать силовое действие на электрические заряды, движущиеся и неподвижные, а также по способности индуцировать электрические заряды на поверхности проводящих нейтральных тел.
Поле, создаваемое неподвижными электрическими зарядами, называют стационарным электрическим, или электростатическим полем. Оно представляет собой частный случай электромагнитного поля, посредством которого осуществляются силовые взаимодействия между электрически заряженными телами, движущимся в общем случае произвольным образом относительно системы отсчета.
Напряженность электрического поля. Количественной характеристикой силового действия электрического поля на заряженные тела служит векторная величина E, называемая напряжённостью электрического поля.
Она определяется отношением силы F, действующей со стороны поля на точечный пробный заряд qпр, помещенный в рассматриваемую точку поля, к величине этого заряда.
Понятие «пробный заряд» предполагает, что этот заряд не участвует в создании электрического поля и так мал, что не искажает его, т. е. не вызывает перераспределения в пространстве зарядов, создающих рассматриваемое поле. В системе СИ единицей напряженности служит 1 В / м, что эквивалентно 1 Н / Кл.
Видео:Идеальный газ. Основное уравнение молекулярно-кинетической теории газов. Практическая часть.10 классСкачать

Основное уравнение МКТ идеального газа
теория по физике 🧲 молекулярная физика, МКТ, газовые законы
Идеальный газ — газ, удовлетворяющий трем условиям:
- Молекулы — материальные точки.
- Потенциальная энергия взаимодействия молекул пренебрежительно мала.
- Столкновения между молекулами являются абсолютно упругими.
Реальный газ с малой плотностью можно считать идеальным газом.
Видео:Урок 147. Задачи на основное уравнение МКТ идеального газаСкачать

Измерение температуры
Температуру можно измерять по шкале Цельсия и шкале Кельвина. По шкале Цельсия за нуль принимается температура, при которой происходит плавление льда. По шкале Кельвина за нуль принимается абсолютный нуль — температура, при котором давление идеального газа равно нулю, и его объем тоже равен нулю.
Обозначение температуры
- По шкале Цельсия — t. Единица измерения — 1 градус Цельсия (1 o C).
- По шкале Кельвина — T. Единица измерения — 1 Кельвин (1 К).
Цена деления обеих шкал составляет 1 градус. Поэтому изменение температуры в градусах Цельсия равно изменению температуры в Кельвинах:
При решении задач в МКТ используют значения температуры по шкале Кельвина. Если в условиях задачи температура задается в градусах Цельсия, нужно их перевести в Кельвины. Это можно сделать по формуле:
Если особо важна точность, следует использовать более точную формулу:
Пример №1. Температура воды равна o C. Определить температуру воды в Кельвинах.
T = t + 273 = 2 + 273 = 275 (К)
Видео:Все формулы молекулярной физики, МКТ 10 класс, + преобразования и шпаргалкиСкачать

Основное уравнение МКТ идеального газа
Давление идеального газа обусловлено беспорядочным движением молекул, которые сталкиваются друг с другом и со стенками сосуда. Основное уравнение МКТ идеального газа связывает давление и другие макропараметры (объем, температуру и массу) с микропараметрами (массой молекул, скоростью молекул и кинетической энергией).
Основное уравнение МКТ
Давление идеального газа пропорционально произведению концентрации молекул на среднюю кинетическую энергию поступательного движения молекулы.
p = 2 3 . . n − E k
p — давление идеального газа, n — концентрация молекул газа, − E k — средняя кинетическая энергия поступательного движения молекул.
Выражая физические величины друг через друга, можно получить следующие способы записи основного уравнения МКТ идеального газа:
p = 1 3 . . m 0 n − v 2
m 0 — масса одной молекулы газа;
n — концентрация молекул газа;
− v 2 — среднее значение квадрата скорости молекул газа.
Среднее значение квадрата скорости не следует путать со среднеквадратичной скоростью v, которая равна корню из среднего значения квадрата скорости:
p = 1 3 . . ρ − v 2
k — постоянная Больцмана (k = 1,38∙10 –3 Дж/кг)
T — температура газа по шкале Кельвина
Пример №2. Во сколько раз уменьшится давление идеального одноатомного газа, если среднюю кинетическую энергию теплового движения молекул и концентрацию уменьшить в 2 раза?
Согласно основному уравнению МКТ идеального газа, давление прямо пропорционально произведению средней кинетической энергии теплового движения молекул и концентрации его молекул. Следовательно, если каждая из этих величин уменьшится в 2 раза, то давление уменьшится в 4 раза:
Видео:Урок 145. Идеальный газ. Основное ур-ние МКТ ид. газа - 1Скачать

Следствия из основного уравнения МКТ идеального газа
Через основное уравнение МКТ идеального газа можно выразить скорость движения молекул (частиц газа):
v = √ 3 k T m 0 . . = √ 3 R T M . .
R — универсальная газовая постоянная, равная произведения постоянной Авогадро на постоянную Больцмана:
R = N A k = 8 , 31 Д ж / К · м о л ь
Температура — мера кинетической энергии молекул идеального газа:
Полная энергия поступательного движения молекул газа определяется формулой:
Пример №3. При уменьшении абсолютной температуры на 600 К средняя кинетическая энергия теплового движения молекул неона уменьшилась в 4 раза. Какова начальная температура газа?
Запишем формулу, связывающую температуру со средней кинетической энергией теплового движения молекул, для обоих случаев, с учетом что:
Составим систему уравнений:

Алгоритм решения
Решение
График построен в координатах (V;Ek). Процесс 1–2 представляет собой прямую линию, исходящую из начала координат. Это значит, что при увеличении объема растет средняя кинетическая энергия молекул. Но из основного уравнения МКТ идеального газа следует, что мерой кинетической энергии молекул является температура:
Следовательно, когда кинетическая энергия молекул растет, температура тоже растет.
Запишем уравнение Менделеева — Клапейрона:
Так как количество вещества одинаковое для обоих состояния 1 и 2, запишем:
ν R = p 1 V 1 T 1 . . = p 2 V 2 T 2 . .
Мы уже выяснили, что объем и температура увеличиваются пропорционально. Следовательно, давление в состояниях 1 и 2 равны. Поэтому процесс 1–2 является изобарным, давление во время него не меняется.
Процесс 2–3 имеет график в виде прямой линии, перпендикулярной кинетической энергии. Так как температуры прямо пропорциональна кинетической энергии, она остается постоянной вместе с этой энергией. Следовательно, процесс 2–3 является изотермическим, температура во время него не меняется. Мы видим, что объем при этом процессе уменьшается. Но так как объем и давление — обратно пропорциональные величины, то давление на участке 2–3 увеличивается.
pазбирался: Алиса Никитина | обсудить разбор | оценить
Первоначальное давление газа в сосуде равнялось р1. Увеличив объём сосуда, концентрацию молекул газа уменьшили в 3 раза, и одновременно в 2 раза увеличили среднюю энергию хаотичного движения молекул газа. В результате этого давление р2 газа в сосуде стало равным
📸 Видео
Решение задач на основное уравнение МКТ идеального газа | Физика 10 класс #29 | ИнфоурокСкачать

Рассмотрение темы: "Основное уравнение МКТ"Скачать

Молекулярно-кинетическая теория | ЕГЭ по физике 2023 | Снежа Планк из ВебиумСкачать

Урок 146. Основное уравнение МКТ идеального газа - 2Скачать

Идеальный газ в молекулярно-кинетической теории | Физика 10 класс #28 | ИнфоурокСкачать

Секретный вывод основного уравнения МКТСкачать

Основные положения молекулярно-кинетической теории газов и ее опытное обоснование. 10 класс.Скачать

Физика 10 класс : Основное уравнение молекулярно-кинетической теории идеального газаСкачать

Урок 139. Основные положения МКТ.Скачать

Основное уравнение МКТ | ФизикаСкачать

Физика. МКТ: Уравнение Менделеева-Клапейрона для идеального газа. Центр онлайн-обучения «Фоксфорд»Скачать

Физика. МКТ: Идеальный газ. Центр онлайн-обучения «Фоксфорд»Скачать