- NO2 — оксид азота (IV), диоксид азота
- Способы получения
- Химические свойства
- NO2 — кислотный оксид, смешанный ангидрид 2-х кислот
- NO2 — очень сильный окислитель
- N2O3 и N2O5 — неустойчивые вещества
- Оксид азота II: получение и химические свойства
- Оксиды азота
- Оксид азота (II)
- Способы получения
- Химические свойства
- Оксид азота (I, II, III, IV, V): свойства, получение, применение
- 🌟 Видео
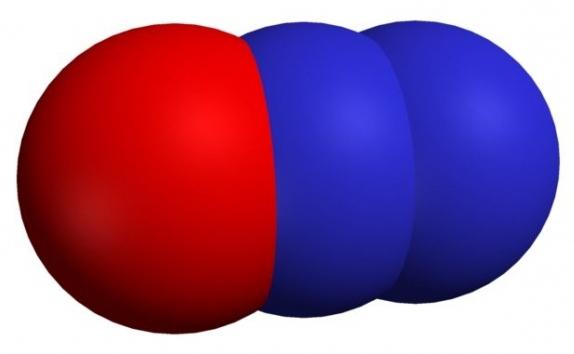
NO2 — оксид азота (IV), диоксид азота
При обычной температуре NO2 — красно-бурый ядовитый газ с резким запахом. Представляет собой смесь NO2 и его димера N2O4 в соотношении -1:4. Диоксид азота хорошо растворяется в воде.
Способы получения
I. Промышленный — окисление NO: 2NO + O2 = 2NO2
Химические свойства
Видео:Оксиды азота. Оксид азота(II)Скачать

NO2 — кислотный оксид, смешанный ангидрид 2-х кислот
NO2 взаимодействует с водой, основными оксидами и щелочами. Но реакции протекают не так, как с обычными оксидами — они всегда окислительно — восстановительные. Объясняется это тем, что не существует кислоты со С.О. (N) = +4, поэтому NO2 при растворении в воде диспропорционирует с образованием 2-х кислот — азотной и азотистой:
Если растворение происходит в присутствии O2, то образуется одна кислота — азотная:
Аналогичным образом происходит взаимодействие NO2 со щелочами:
Видео:Опыты по химии. Получение оксида азота (II); окисление его кислородомСкачать

NO2 — очень сильный окислитель
По окислительной способности NO2 превосходит азотную кислоту. В его атмосфере горят С, S, Р, металлы и некоторые органические вещества. При этом NO2 восстанавливается до свободного азота:
2NO2 + 8HI = N2 + 4I2 + 4Н2О (возникает фиолетовое пламя)
В присутствии Pt или Ni диоксид азота восстанавливается водородом до аммиака:
Как окислитель NO2 используется в ракетных топливах. При его взаимодействии с гидразином и его производными выделяется большое количество энергии:
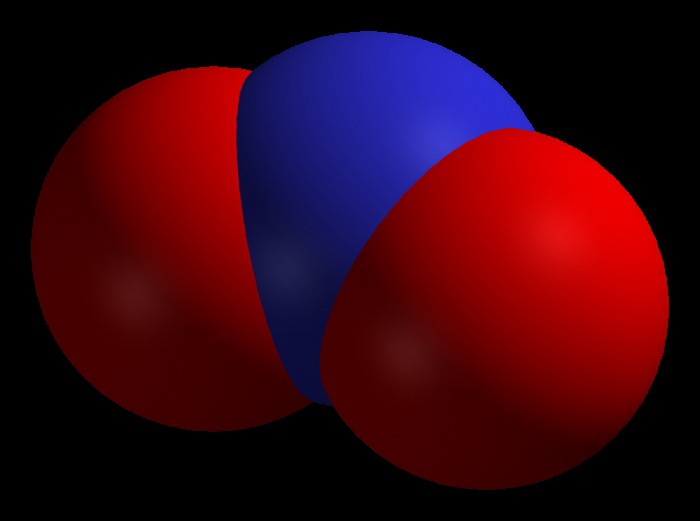
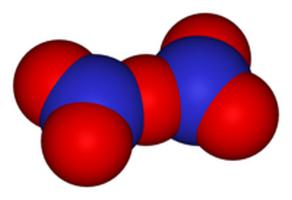
N2O3 и N2O5 — неустойчивые вещества
Оба оксида имеют ярко выраженный кислотный характер, являются соответственно ангидридами азотистой и азотной кислот.
N2O3 как индивидуальное вещество существует только в твердом состоянии ниже Т пл. (-10 0 С).
С повышением температуры разлагается: N2O3 → NO + NO2
N2O5 при комнатной температуре и особенно на свету разлагается так энергично, что иногда самопроизвольно взрывается:
Видео:Получение и свойства оксида азота (II) / Obtaining and properties of nirogen monooxideСкачать

Оксид азота II: получение и химические свойства
Оксиды азота
| Оксиды азота | Цвет | Фаза | Характер оксида |
| N2O Оксид азота (I), закись азота, «веселящий газ» | бесцветный | газ | несолеобразующий |
| NO Оксид азота (II), закись азота, «веселящий газ» | бесцветный | газ | несолеобразующий |
| N2O3 Оксид азота (III), азотистый ангидрид | синий | жидкость | кислотный |
| NO2 Оксид азота (IV), диоксид азота, «лисий хвост» | бурый | газ | кислотный (соответствуют две кислоты) |
| N2O5 Оксид азота (V), азотный ангидрид | бесцветный | твердый | кислотный |
Видео:Получение оксида азота (II) @VideoTutorialsForSchoolСкачать

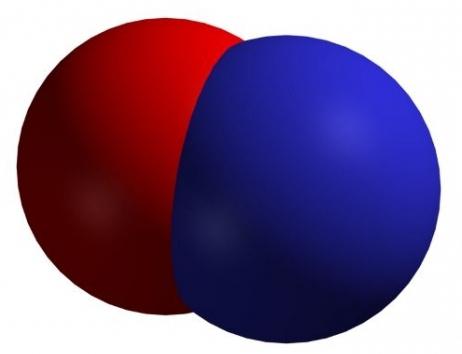
Оксид азота (II)
Оксид азота (II) NO – это несолеобразующий оксид. В нормальных условиях это бесцветный ядовитый газ, плохо растворимый в воде. На воздухе коричневеет из-за окисления до диоксида азота. Сжижается с трудом; в жидком и твёрдом виде имеет голубой цвет.
Видео:Оксиды азота. Оксид азота(I)Скачать

Способы получения
1. В лаборатории оксид азота (II) получают действием разбавленной азотной кислоты (30%) на неактивные металлы.
Например , при действии 30 %-ной азотной кислоты на медь образуется NO:
Также NO можно получить при окислении хлорида железа (II) или иодоводорода азотной кислотой:
FeCl2 + NaNO3 + 2HCl → FeCl3 + NaCl + NO + H2O
2HNO3 + 2HI → 2NO + I2 + 2H2O
2. В природе оксид азота (II) образуется из азота и кислорода под действием электрического разряда, например, во время грозы:
3. В промышленности оксид азота (II) получают каталитическим окислением аммиака :
Видео:13. Химические свойства оксидов азотаСкачать

Химические свойства
1. Оксид азота (II) легко окисляется под действием окислителей .
Например , горит в атмосфере кислорода:
Оксид азота (II) легко окисляется под действием хлора или озона:
2NO + Cl2 → 2NOCl
2. В присутствии более сильных восстановителей проявляет свойства окислителя . В атмосфере оксида азота (II) могут гореть водород, углерод и т.п.
Например , оксид азота (II) окисляет водород и сернистый газ:
3. Как несолеобразующий оксид, при обычных условиях с основаниями, основными оксидами, амфотерными оксидами, кислотными оксидами, кислотами и амфотерными гидроксидами оксид азота (II) не реагирует:
Видео:ОКСИДЫ ХИМИЯ — Что такое Оксиды? Химические свойства Оксидов | Реакция ОксидовСкачать

Оксид азота (I, II, III, IV, V): свойства, получение, применение
Введение
Если внимательно взглянуть на азот в периодической системе химических элементов Д. И. Менделеева, то можно заметить, что он имеет переменную валентность. Это значит, что азот образует сразу несколько бинарных соединений с кислородом. Некоторые из них были открыты недавно, а некоторые — изучены вдоль и поперек. Существуют малостабильные и устойчивые оксиды азота. Химические свойства каждого из этих веществ совершенно разные, поэтому при их изучении нужно рассматривать как минимум пять оксидов азота. Вот о них и пойдет речь в сегодняшней статье.
Оксид азота (I)
В обычных условиях представлен бесцветным газом, имеющим сладковатый запах. Его могут растворять вода, этанол, эфир и серная кислота. Если газобразный оксид одновалентного азота нагреть до комнатной температуры под давлением 40 атмосфер, то он сгущается до бесцветной жидкости. Это несолеобразующий оксид, разлагающийся во время нагревания и показывающий себя в реакциях как восстановитель.
Этот оксид образуется, когда нагревают сухой нитрат аммония. Другой способ его получения — термическое разложение смеси «сульфаминовая + азотная кислота».
Используется в качестве средства для ингаляционного наркоза, пищевая промышленность знает этот оксид как добавку E942. С его помощью также улучшают технические характеристики двигателей внутреннего сгорания.
Оксид азота (II)
При нормальных условиях имеет вид бесцветного газа, который плохо растворяется в воде. Его трудно сжижить, однако в твердом и жидком состояниях это вещество имеет голубой цвет. Данный оксид может окисляться кислородом воздуха
Его довольно просто получить, для этого нужно нагреть до 1200-1300 о С смесь азота и кислорода. В лабораторных условиях он образуется сразу при нескольким опытах:
- Реакция меди и 30%-ного раствора азотной кислоты.
- Взаимодействие хлорида железа, нитрита натрия и соляной кислоты.
- Реакция азотистой и иодоводородной кислот.
Это одно из веществ, из которых получают азотную кислоту.
Оксид азота (III)
В нормальных условиях является жидкостью, которая имеет синий цвет, а в стандартных — бесцветным газом. Чистый оксид существует только в твердом агрегатном состоянии.
Образуется при взаимодействии 50%-ной азотной кислоты и твердого оксида трехвалентного мышьяка (его также можно заменить крахмалом).
С помощью этого вещества в лабораториях получают азотистую кислоту и ее соли.
Оксид азота (IV)
Последнее название соответствует одному из его свойств. Ведь этот оксид имеет вид или красно-бурого газа или желтоватой жидкости. Ему присуща высокая химическая активность.
Данный оксид получают при взаимодействии азотной кислоты и меди, а также во время термического разложения нитрата свинца.
С помощью него производят серную и азотную кислоты, окисляют жидкое ракетное топливо и смесевые взрывчатые вещества.
Оксид азота (V)
Имеет вид бецветных и очень летучих кристаллов. Они могут плавиться при температуре 32,3 о С.
Этот оксид образуется при нескольких реакциях:
- Дегидрация азотной кислоты оксидом пятивалентного фосфора.
- Пропускание сухого хлора над нитратом серебра.
- Взаимодействие озона с оксидом четырехвалентного азота.
Из-за своей крайней неустойчивости в чистом виде нигде не используется.
Заключение
В химии существует девять оксидов азота, приведенные выше являются только классическими соединениями этого элемента. Остальные четыре — это, как уже было сказано, нестабильные вещества. Однако их все объединяет одно свойство — высокая токсичность. Выбросы оксидов азота в атмосферу приводят к ухудшению состояния здоровья живущих поблизости от промышленных химических предприятий людей. Симптомы отравления каким-либо из этих веществ — токсический отек легких, нарушение работы центральной нервной системы и поражение крови, причина которого — связывание гемоглобина. Поэтому с оксидами азота необходимо осторожно обращаться и в большинстве случаев использовать средства защиты.
🌟 Видео
Химия 9 класс (Урок№14 - Азот: свойства и применение. Аммиак. Физические и химические свойства.)Скачать

Оксиды азота (I) и (II)Скачать

Химия 8 класс (Урок№11 - Кислород: получение, физические и химические свойства,применение. Оксиды.)Скачать

Получение и свойства оксида азота (II).Скачать

Получение оксида азота (IV) и его конденсация / Obtaining and condensation of nitrogen oxideСкачать

08 Азот 2 оксиды азотаСкачать

Бурый газ | Оксид азота IV - как его получают и с чем он реагирует?Скачать

Оксиды азота для соткиСкачать

Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Получение и свойства оксида азота (IV) / Synthesis and properties of nitrogen dioxideСкачать

Оксиды азота. Оксид азота(IV)Скачать

Кислотный снег. Химические свойства оксида азота. Химия – Просто.Скачать

Оксиды азота. Оксид азота(V)Скачать