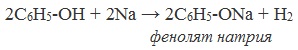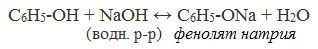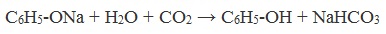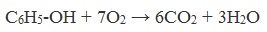Гидроксисоединения – это органические вещества, молекулы которых содержат, помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.
Гидроксисоединения делят на спирты и фенолы.
| Спирты – это гидроксисоединения, в которых группа ОН соединена с алифатическим углеводородным радикалом R-OH. Если гидроксогруппа ОН соединена с бензольным кольцом, то вещество относится к фенолам. |
Общая формула предельных нециклических спиртов: CnH2n+2Om, где m ≤ n.
- Классификация фенолов
- По числу гидроксильных групп:
- Строение фенолов
- Химические свойства фенолов
- 1.1. Взаимодействие с раствором щелочей
- 1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
- 2. Реакции фенола по бензольному кольцу
- 2.1. Галогенирование
- 2.2. Нитрование
- 3. Поликонденсация фенола с формальдегидом
- 4. Взаимодействие с хлоридом железа (III)
- 5. Гидрирование (восстановление) фенола
- Получение фенолов
- 1. Взаимодействие хлорбензола с щелочами
- 2. Кумольный способ
- 3. Замещение сульфогруппы в бензол-сульфокислоте
- Фенол
- Химическое название
- Химические свойства
- Фармакологическое действие
- Фармакодинамика и фармакокинетика
- Показания к применению
- Противопоказания
- Побочные действия
- Инструкция по применению (Способ и дозировка)
- Передозировка
- Взаимодействие
- Особые указания
- Детям
- При беременности и лактации
- Препараты, в которых содержится (Аналоги)
- Отзывы
- Цена, где купить
- Фенол взаимодействует с гидроксидом натрия уравнение реакции
- I. Реакции с участием гидроксильной группы
- II . Реакции, с участием бензольного кольца
- III. Реакция окисления
- IV. Качественная реакция! — обнаружение фенола
Видео:Реакция ФЕНОЛА с ГИДРОКСИДОМ НАТРИЯ и СЕРНОЙ КИСЛОТОЙ. Получение ФЕНОЛЯТА НАТРИЯ. Опыты по химииСкачать

Классификация фенолов
Видео:Взаимодействие фенола с гидроксидом натрияСкачать

По числу гидроксильных групп:
- фенолы с одной группой ОН — содержат одну группу -ОН. Общая формула CnH2n-7OH или CnH2n-6O.
- фенолы с двумя группами ОН — содержат две группы ОН. Общая формула CnH2n-8(OH)2 или CnH2n-6O2.
| Соединения, в которых группа ОН отделена от бензольного кольца углеродными атомами – это не фенолы, а ароматические спирты: |
Видео:Взаимодействие фенола с гидроксидом натрияСкачать

Строение фенолов
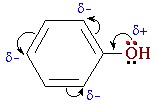
В фенолах одна из неподеленных электронных пар кислорода участвует в сопряжении с π–системой бензольного кольца, это является главной причиной отличия свойств фенола от спиртов.
Видео:Гидроксид натрия.Цветные реакции с едким натром.Получение щелочи и опыты.Сульфид,сульфит из натрия!Скачать

Химические свойства фенолов
| Сходство и отличие фенола и спиртов. |
Сходство: как фенол, так и спирты реагируют с щелочными металлами с выделением водорода.
Отличия:
- фенол не реагирует с галогеноводородами: ОН- группа очень прочно связана с бензольным кольцом, её нельзя заместить;
- фенол не вступает в реакцию этерификации, эфиры фенола получают косвенным путем;
- фенол не вступает в реакции дегидратации.
- фенол обладает более сильными кислотными свойствами и вступает в реакцию со щелочами.
1. Кислотные свойства фенолов
| Фенолы являются более сильными кислотами, чем спирты и вода, т. к. за счет участия неподеленной электронной пары кислорода в сопряжении с π-электронной системой бензольного кольца полярность связи О–Н увеличивается. |
Раствор фенола в воде называют «карболовой кислотой», он является слабым электролитом.
1.1. Взаимодействие с раствором щелочей
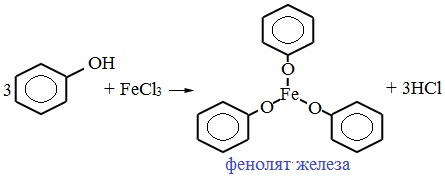
В отличие от спиртов, фенолы реагируют с гидроксидами щелочных и щелочноземельных металлов, образуя соли – феноляты.
| Например, фенол реагирует с гидроксидом натрия с образованием фенолята натрия |
Так как фенол – более слабая кислота, чем соляная и даже угольная, его можно получить из фенолята, вытесняя соляной или угольной кислотой:
1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
Фенолы взаимодействуют с активными металлами (щелочными и щелочноземельными). При этом образуются феноляты. При взаимодействии с металлами фенолы ведут себя, как кислоты.
| Например, фенол взаимодействует с натрием с образованием фенолята натрия и водорода . |
Видео:Взаимодействие уксусной кислоты с гидроксидом натрияСкачать

2. Реакции фенола по бензольному кольцу
| Наличие ОН-группы в бензольном кольце (ориентант первого рода) приводит к тому, что фенол гораздо легче бензола вступает в реакции замещения в ароматическом кольце. |
2.1. Галогенирование
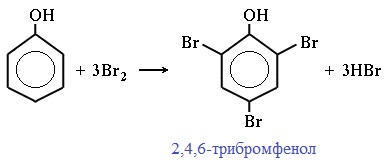
| Фенол легко при комнатной температуре (без всякого катализатора) взаимодействует с бромной водой с образованием белого осадка 2,4,6-трибромфенола (качественная реакция на фенол). |
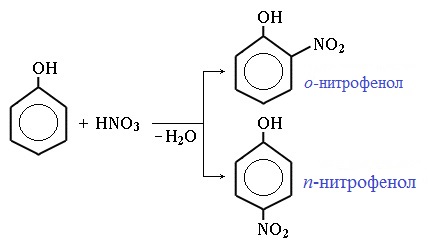
2.2. Нитрование
Под действием 20% азотной кислоты HNO3 фенол легко превращается в смесь орто- и пара-нитрофенолов.
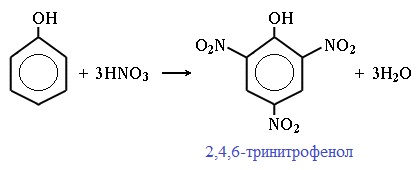
| Например, при нитровании фенола избытком концентрированной HNO3 образуется 2,4,6-тринитрофенол (пикриновая кислота): |
Видео:Взаимодействие фенола с гидроксидом натрияСкачать

3. Поликонденсация фенола с формальдегидом
С формальдегидом фенол образует фенолоформальдегидные смолы.
Видео:Реакция фенолфталеина на гидроксид натрияСкачать

4. Взаимодействие с хлоридом железа (III)
При взаимодействии фенола с хлоридом железа (III) образуются комплексные соединения железа, которые окрашивают раствор в сине-фиолетовый цвет. Это качественная реакция на фенол.
Видео:взаимодействие фенола с гидроксидом натрия.wmvСкачать

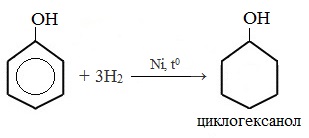
5. Гидрирование (восстановление) фенола
Присоединение водорода к ароматическому кольцу.
Продукт реакции – циклогексанол, вторичный циклический спирт.
Видео:Реакция сульфата меди II ( медный купорос) с гидроксидом натрия ( щелочами)Скачать

Получение фенолов
Видео:Опыты по химии. Взаимодействие фенола с раствором щелочи. Вытеснение фенола из фенолята натрияСкачать

1. Взаимодействие хлорбензола с щелочами
При взаимодействии обработке хлорбензола избытком щелочи при высокой температуре и давлении образуется водный раствор фенолята натрия.
При пропускании углекислого газа (или другой более сильной кислоты) через раствор фенолята образуется фенол.
Видео:9.3. Фенол: Химические свойстваСкачать

2. Кумольный способ
Фенол в промышленности получают из каталитическим окислением кумола.
Первый этап процесса – получение кумола алкилированием бензола пропеном в присутствии фосфорной кислоты:
Второй этап – окисление кумола кислородом. Процесс протекает через образование гидропероксида изопропилбензола:
Суммарное уравнение реакции:
Видео:207 Взаимодействие фенола с гидроксидом натрияСкачать

3. Замещение сульфогруппы в бензол-сульфокислоте
Бензол-сульфокислота реагирует с гидроксидом натрия с образованием фенолята натрия:
Получается фенолят натрия, из которого затем выделяют фенол:
Видео:Решаем два варианта Добротина за 2 часаСкачать

Фенол
Видео:Взаимодействие алюминия с гидроксидом натрия | ЕГЭ по химииСкачать

Химическое название
Видео:Опыты по химии. Реакция глицерина с гидроксидом меди (II)Скачать

Химические свойства
Что такое Фенол? Гидроксибензол, что это такое? Согласно Википедии – это один из простейших представителей своего класса ароматических соединений. Фенолы – это органические ароматические соединения, в молекулах которых к гидроксильной группе присоединены атомы углерода из ароматического кольца. Общая формула Фенолов: С6Н6n(ОН)n. Согласно стандартной номенклатуре, органические вещества этого ряда различают по числу ароматических ядер и ОН-групп. Различают одноатомные аренолы и гомологи, двухатомные арендиолы, терхатомные арентриолы и многоатомные формулы. Также Фенолам свойственно иметь ряд пространственных изомеров. Например, 1,2-дигидроксибензол (пирокатехин), 1,4-дигидроксибензол (гидрохинон) являются изомерами.
Спирты и Фенолы отличаются друг от друга наличием ароматического кольца. Этанол является гомологом метанола. В отличие от Фенола, метанол взаимодействует с альдегидами и вступает в реакции этерификации. Утверждение, что гомологами являются метанол и Фенол неверно.
Его подробно рассмотреть структурную формулу Фенола, то можно отметить, что молекула представляет собой диполь. При этом бензольное кольцо – отрицательный конец, а группа ОН – положительный. Наличие гидроксильной группы обуславливает повышение электронной плотности в кольце. Неподеленная пара электронов кислорода вступает в сопряжение с пи-системой кольца, а для атома кислорода характерна sp2 гибридизация. Атомы и атомные группы в молекуле обладают сильным взаимным влиянием друг на друга, и это отражается на физических и химических свойствах веществ.
Физические свойства. Химическое соединение имеет вид бесцветных игольчатых кристаллов, которые розовеют на воздухе, так как подвержены окислению. У вещества специфический химический запах, оно умеренно растворимо в воде, спиртах, щелочи, ацетоне и бензоле. Молярная масса = 94,1 грамм на моль. Плотность = 1,07 г на литр. Кристаллы плавятся при 40-41 градусах Цельсия.
С чем взаимодействует Фенол? Химические свойства Фенола. В связи с тем, что молекула соединения содержится, как ароматическое кольцо, так и гидроксильную группу, то оно проявляет некоторые свойства спиртов и ароматических углеводородов.
С чем реагирует группа ОН? Вещество не проявляет сильных кислотных свойств. Но является более активным окислителем, чем спирты, в отличие от этанола взаимодействует с щелочами образуя соли-феноляты. Реакция с гидроксидом натрия: С6Н5ОН + NaOH → C6H5ONa + H2O. Вещество вступает в реакцию с натрием (металлическим): 2C6H5OH + 2Na → 2C6H5ONa + H2.
Фенол не реагирует с карбоновыми кислотами. Эфиры получают при взаимодействии солей фенолятов с галогенангидридами или ангидридами кислот. Для химического соединения не характерны реакции образования простых эфиров. Эфиры образуют феноляты при действии на них галогеналканов или галогенпроизводных аренов. Гидроксибензол реагирует с цинковой пылью, при этом происходит замещение гидроксильной группы на Н, уравнение реакции выглядит следующим образом: C6H5OH + Zn → C6H6 + ZnO.
Химическое взаимодействие по ароматическому кольцу. Для вещества характерны реакции электрофильного замещения, алкилирования, галогенирования, ацилирования, нитрования и сульфирования. Особое значение имеет реакций синтеза салициловой кислоты: C6H5OH + CO2 → C6H4OH(COONa), протекает в присутствии катализатора гидроксида натрия. Затем при воздействии соляной кислоты образуется салициловая к-та.
Реакция взаимодействия с бромной водой является качественной реакцией на Фенол. C6H5OH + 3Br2 → C6H2Br2OH + 3HBr. При бромировании образуется твердое белое вещество — 2,4,6-трибромфенол. Еще одна качественная реакция – с хлоридом железа 3. Уравнение реакции выглядит следующим образом: 6C6H5OH + FeCl3 → (Fe(C6H5OH)6)Cl3.
Реакция нитрования Фенола: C6H5OH + 3HNO3 → C6H2(NO2)3OH + 3 H2O. Для вещества также характерна реакция присоединения (гидрирования) в присутствии металлических катализаторов, платины, оксида алюминия, хрома и так далее. В результате образуются циклогексанол и циклогексанон.
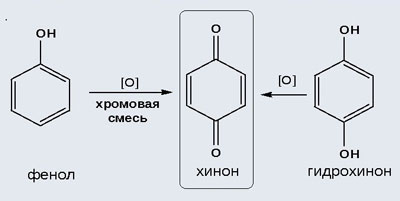
Химическое соединение подвергается окислению. Устойчивость вещества значительно ниже, чем у бензола. В зависимости от условий реакции и природы окислителя образуются разные продукты реакции. Под действием перекиси водорода в присутствии железа образуется двухатомный Фенол; при действии диоксида марганца, хромовой смеси в подкисленной среде – пара-хинон.
Фенол реагирует с кислородом, реакция горения: С6Н5ОН +7О2 → 6СО2 + 3Н2О. Также особое значение для промышленности имеет реакция поликонденсации с формальдегидом (например, метаналем). Вещество вступает в реакцию поликонденсации до тех пор, пока не израсходуется полностью один из реагентов и не образуются огромные макромолекулы. В результате образуются твердые полимеры, фенолформальдегидные или формальдегидные смолы. Фенол не взаимодействует с метаном.
Получение. На данный момент существуют и активно применяются несколько методов синтеза гидроксибензола. Кумольный способ получения Фенола является наиболее распространенным из них. Таким способом синтезируют порядка 95% всего объема производства вещества. При этом некаталитическому окислению воздухом подвергается кумол и образуется гидропероксид кумола. Полученное соединение разлагается под действием серной кислоты на ацетон и Фенол. Дополнительным побочным продуктом реакции является альфа-метилстирол.
Также соединение можно получить при окислении толуола, промежуточным продуктом реакции будет являться бензойная кислота. Таким образом, синтезируют около 5% вещества. Все остальное сырье для различных нужд выделяют из каменноугольной смолы.
Как получить из бензола? Фенол можно получить с помощью реакции прямого окисления бензола NO2 (закись азота) с дальнейшим кислотным разложением гидропероксида втор-бутилбензола. Как из хлорбензола получить Фенол? Существует два варианта получения из хлорбензола данного химического соединения. Первый – реакция взаимодействия со щелочью, например, с гидроксидом натрия. В результате образуется Фенол и поваренная соль. Второй – реакция с водяным паром. Уравнение реакции выглядит следующим образом: C6H5-Cl + H2O → C6H5-OH + HCl.
Получение бензола из Фенола. Для этого сначала требуется обработать бензол хлором (в присутствии катализатора), а затем прибавить к полученному соединению щелочь (например, NaOH). В итоге образуется Фенол и хлорид натрия.
Превращение метан — ацетилен — бензол — хлорбензол можно осуществить следующим образом. Сначала проводится реакция разложения метана при высокой температуре 1500 градусов Цельсия до ацетилена (С2Н2) и водорода. Затем ацетилен при особых условиях и высокой температуре переводят в бензол. К бензолу прибавляют хлор в присутствии катализатора FeCl3, получают хлорбензол и соляную кислоту: C6H6 + Cl2 → C6H5Cl + HCl.
Одним из структурных производных Фенола является аминокислота тирозин, которая имеет важное биологическое значение. Данную аминокислоту можно рассмотреть в виде пара-замещенного Фенола или альфа-замещенного пара-крезола. Крезолы – достаточно распространены в природе на ряду с полифенолами. Также свободную форму вещества можно обнаружить в некоторых микроорганизмах в равновесном состоянии с тирозином.
- при производстве бисфенола А, эпоксидной смолы и поликарбоната;
- для синтеза фенолформальдегидных смол, капрона, нейлона;
- в нефтеперерабатывающей промышленности, при селективной очистке масел от ароматических соединений серы и смол;
- при производстве антиоксидантов, поверхностно-активных веществ, крезолов, лек. препаратов, аспирина, пестицидов и антисептических препаратов;
- в медицине в качестве антисептического и обезболивающего средства для местного использования;
- в качестве консерванта при изготовлении вакцин и копченых продуктов питания, в косметологии при проведении глубокого пилинга;
- для дезинфекции животных в скотоводстве.
Класс опасности. Фенол – крайне токсичное, ядовитое, едкое вещество. При вдыхании летучего соединения нарушается работа центральной нервной системы, пары раздражают слизистую глаз, кожу, дыхательные пути и вызывают сильные химические ожоги. При попадании на кожу вещество быстро всасывается в кровоток и достигает тканей мозга, вызывая паралич дыхательного центра. Смертельная доза при приеме внутрь для взрослого составляет от 1 до 10 грамм.
Видео:Реакция нейтрализации гидроксида натрия соляной (хлороводородной) кислотойСкачать

Фармакологическое действие
Видео:Какое вещество образует динатрийное производное при взаимодействии с гидроксидом натрияСкачать

Фармакодинамика и фармакокинетика
Средство проявляет бактерицидную активность по отношению в аэробным бактериям, их вегетативным формам и грибам. Практически не оказывает влияния на споры грибов. Вещество вступает во взаимодействие с белковыми молекулами микробов и приводит к их денатурации. Таким образом, нарушается коллоидное состояние клетки, значительно повышается ее проницаемость, нарушаются окислительно-восстановительные реакции.
В водном растворе является отличным дезинфицирующим средством. При использовании 1,25% раствора практически микроорганизмы погибают в течение 5-10 минут. Фенол, в определенной концентрации оказывает прижигающее и раздражающее действие на слизистую оболочку. Бактерицидный эффект от применения средства усиливается с ростом температуры и кислотности.
При попадании на поверхность кожи, даже если она не повреждена, лекарство быстро всасывается, проникает в системный кровоток. При системной абсорбции вещества наблюдается его токсическое действие, преимущественно на центральную нервную систему и дыхательный центр в головном мозге. Порядка 20% от принятой дозы подвергается окислению, вещество и продукты его метаболизма выводятся с помощью почек.
Видео:Реакция ионного обмена. Взаимодействие сульфата меди (II) с гидроксидом натрия.Скачать

Показания к применению
- для дезинфекции инструментов и белья и дезинсекции;
- в качестве консерванта в некоторых лек. средствах, вакцинах, свечах и сыворотках;
- при поверхностных пиодермиях, фолликулите, фликтене, остиофолликулите, сикозе, стрептококковом импетиго;
- для лечения воспалительных заболеваний среднего уха, ротовой полости и глотки, ангины, фарингита, стоматита, пародонтита, генитальных остроконечных кондилом.
Видео:Взаимодействие фенола с гидроксидом натрияСкачать

Противопоказания
Вещество не используют:
- при распространенных поражениях слизистой оболочки или кожи;
- для лечения детей;
- во время кормления грудью и беременности;
- при аллергии на Фенол.
Видео:синтез 4-[1метил-1-(4-гидрооксифенил)этил фенолаСкачать

Побочные действия
Иногда лекарственное средство может спровоцировать развитие аллергических реакций, зуд, раздражение в месте нанесения и чувство жжения.
Инструкция по применению (Способ и дозировка)
Консервацию лекарственных препаратов, сывороток и вакцин проводят с помощью 0,5% растворов Фенола.
Для наружного применения лекарство используют в виде мази. Препарат наносят тонким слоем на пораженные участки кожи несколько раз в сутки.
При лечении отита вещество используют в форме 5% раствора в глицерине. Препарат подогревают и закапывают по 10 капель в пораженное ухо на 10 минут. Затем необходимо удалить остатки лекарства с помощью ваты. Процедуру повторяют 2 раза в день в течение 4 суток.
Препараты Фенола для лечения ЛОР-заболеваний используют в соответствии с рекомендациями в инструкции. Продолжительность терапии – не более 5 дней.
Для ликвидации остроконечных кондилом их обрабатывают 60% раствором Фенола или 40% раствором трикрезола. Процедуру проводят один раз в 7 дней.
При дезинфекции белья применяют 1-2% растворы на основе мыла. С помощью мыльно-фенольного раствора обрабатывают помещение. При дезинсекции используются фенольно-скипидарные и керосиновые смеси.
Передозировка
При попадании вещества на кожу возникают жжение, покраснение кожи, анестезия пораженного участка. Поверхность обрабатывают растительным маслом или полиэтиленгликолем. Проводят симптоматическую терапию.
Симптомы отравления Фенолом при попадании внутрь. Наблюдаются сильные боли в животе, глотке, в ротовой полости, пострадавшего рвет бурой массой, бледность кожи, общая слабость и головокружение, миоз, коллапс, падение температуры тела, судороги, кома, острая печеночная недостаточность. В качестве терапии желудок промывают растительным маслом с добавлением белков, затем дают пострадавшему 10% раствор глицерола и активированный уголь. Показан прием оксида магния и глюконата кальция, форсированный диурез, тиосульфат натрия капельно внутривенно, витамины группы В. Проводят лечение токсического шока.
Взаимодействие
Лекарственное взаимодействие не происходит.
Особые указания
Фенол обладает способностью адсорбироваться пищевыми продуктами.
Средством нельзя обрабатывать обширные участки кожи.
Перед использованием вещества для дезинфекции предметов быта, их необходимо механически очистить, так как средство абсорбируется органическими соединениями. После обработки вещи могут еще длительное время сохранять специфический запах.
Химическое соединение нельзя использовать для обработки помещений для хранения и готовки пищевой продукции. Оно не влияет на окраску и структуру ткани. Повреждает поверхности, покрытые лаком.
Детям
Средство нельзя использовать в педиатрической практике.
При беременности и лактации
Фенол не назначают во время кормления грудью и при беременности.
Препараты, в которых содержится (Аналоги)
Фенол входит в состав следующих препаратов: Ферезол, Фукорцин, Фенола раствор в глицерине, Орасепт, Фармасептик. В качестве консерванта содержится в препаратах: Экстракт Белладонны, Набор для кожной диагностики медикаментозной аллергии, Постеризан и так далее.
Отзывы
Фенол – хорошее антисептическое средство, которое подходит, как для обработки инструментов и помещений, так и при лечении воспалительных ЛОР-заболеваний. При соблюдении рекомендаций врача и инструкции по применению, необходимых мер безопасности при работе с такого рода веществами, средство хорошо переносится и не вызывает негативного влияния на организм. Отзывы о применении препаратов Фенола, как правило, положительные. Особенно хорошие отзывы при лечении заболеваний горла.
Цена, где купить
Стоимость вещества для технического использования зависит от количества и производителя. Купить спрей для готовой полости Орасепт можно примерно за 400 рублей – флакон.
Образование: Окончила Ровенский государственный базовый медицинский колледж по специальности «Фармация». Окончила Винницкий государственный медицинский университет им. М.И.Пирогова и интернатуру на его базе.
Опыт работы: С 2003 по 2013 г. – работала на должностях провизора и заведующего аптечным киоском. Награждена грамотами и знаками отличия за многолетний и добросовестный труд. Статьи на медицинскую тематику публиковались в местных изданиях (газеты) и на различных Интернет-порталах.
Фенол взаимодействует с гидроксидом натрия уравнение реакции
Химические свойства фенолов определяются наличием в молекуле гидроксильной группы и бензольного кольца.
I. Реакции с участием гидроксильной группы
Фенолы являются более сильными кислотами, чем спирты и вода, т.к. за счет участия неподеленной электронной пары кислорода в сопряжении с π-электронной системой бензольного кольца полярность связи О–Н увеличивается.
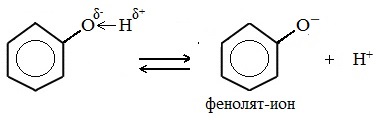
Фенолы в водных растворах диссоциируются по кислотному типу: на фенолят-ионы и ионы водорода:
Фенол диссоциирует обратимо, это слабая кислота. Однако его силы кислотных свойств достаточно, чтобы изменять окраску индикатора, имеющего в нейтральной среде фиолетовый цвет. В растворе фенола лакмус краснеет.
1) Взаимодействие с активными металлами с образованием фенолятов (сходство со спиртами)
Видеоопыт «Взаимодействие фенола с металлическим натрием»
2) Взаимодействие со щелочами с образованием фенолятов (отличие от спиртов)
Видеоопыт «Взаимодействие фенола с раствором щелочи»
Образующиеся в результате реакций феноляты легко разлагаются при действии кислот. Даже такая слабая кислота, как угольная, вытесняет фенол из фенолятов. Следовательно, !Феноляты – соли слабой карболовой кислоты, разлагаются угольной кислотой:
По кислотным свойствам фенол превосходит этанол в 10 6 раз. При этом во столько же раз уступает уксусной кислоте. В отличие от карбоновых кислот, фенол не может вытеснить угольную кислоту из её солей
C6H5-OH + NaHCO3 = реакция не идёт – прекрасно растворяясь в водных растворах щелочей, он фактически не растворяется в водном растворе гидрокарбоната натрия.
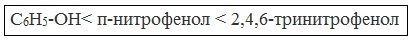
Кислотные свойства фенола усиливаются под влиянием связанных с бензольным кольцом электроноакцепторных групп (NO2 — , Br — )
2,4,6-тринитрофенол или пикриновая кислота сильнее угольной.
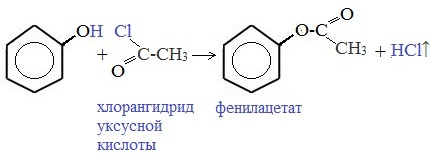
3) Образование сложных и простых эфиров
Как и спирты, фенолы могут образовывать простые и сложные эфиры. Фенолы не образуют сложные эфиры в реакциях с кислотами. Сложные эфиры образуются при взаимодействии фенола с ангидридами или хлорангидридами карбоновых кислот:
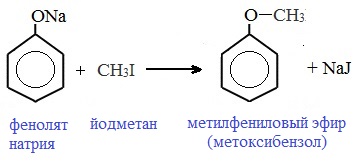
Простые эфиры образуются при взаимодействии фенолятов с алкилгалогенидами:
II . Реакции, с участием бензольного кольца
Взаимное влияние атомов в молекуле фенола проявляется не только в особенностях поведения гидроксигруппы, но и в большей реакционной способности бензольного ядра. Гидроксильная группа повышает электронную плотность в бензольном кольце, особенно, в орто- и пара- положениях (+ М -эффект ОН-группы):
Поэтому фенол значительно активнее бензола вступает в реакции электрофильного замещения в ароматическом кольце.
Реакции замещения
1) Нитрование
Под действием 20% азотной кислоты HNO3 фенол легко превращается в смесь орто- и пара- нитрофенолов:
При использовании концентрированной HNO3 образуется 2,4,6-тринитрофенол (пикриновая кислота):
У нее кислотные свойства выражены сильнее, чем у фенола, т.к. нитрогруппы оттягивают электронную плотность от бензольного кольца и делают связь О-Н еще более полярной.
Пикриновая кислоты является взрывчатым веществом, в чистом виде представляет собой желтые кристаллы.
2) Галогенирование
Фенол легко при комнатной температуре взаимодействует с бромной водой с образованием белого осадка 2,4,6-трибромфенола ( качественная реакция на фенол! ):
Образуется белый осадок трибромфенола.
Видеоопыт «Взаимодействие фенола с бромной водой»
3) Сульфирование
Соотношение о- и п-изомеров определяется температурой реакции: при комнатной температуре в основном образуется о-фенолсульфокислота, при t=1000С – пара-изомер: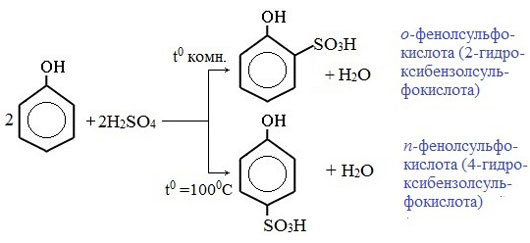
1) Гидрирование фенола
Эта реакция идет с разрушением ароматического кольца. Продукт реакции циклический одноатомный спирт — циклогексиловый спирт (циклогексанол).
2) Конденсация с альдегидами
При нагревании фенола с формальдегидом в присутствии кислотных или основных катализаторов происходит реакция поликонденсации и образуется фенолформальдегидная смола.
Данная реакция имеет большое практическое значение и используется при получении фенолформальдегидных смол.
III. Реакция окисления
Фенолы легко окисляются даже под действием кислорода воздуха. При стоянии на воздухе фенол постепенно окрашивается в розовато-красный цвет.
1) Горение (полное окисление)
Фенолы, как и большинство органических веществ, сгорают до углекислого газа и воды.
2) Окисление хромовой смесью
При энергичном окислении фенола хромовой смесью основным продуктом окисления является хинон. Двухатомные фенолы окисляются еще легче. При окислении гидрохинона также образуется хинон:
IV. Качественная реакция! — обнаружение фенола
Для обнаружения фенолов используется качественная реакция с хлоридом железа (III). Одноатомные фенолы дают устойчивое сине-фиолетовое окрашивание, что связано с образованием комплексных соединений железа.
Видеоопыт «Качественная реакция на фенол»
Образование фиолетового окрашивания при добавлении раствора FeCl3 служит качественной реакцией на фенол:
Для фенолов реакции по связям С-О не характерны, поскольку атом кислорода прочно связан с атомом углерода бензольного кольца за счет участия своей неподеленной электронной пары в системе сопряжения.