Гидроксисоединения – это органические вещества, молекулы которых содержат, помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.
Гидроксисоединения делят на спирты и фенолы.
| Спирты – это гидроксисоединения, в которых группа ОН соединена с алифатическим углеводородным радикалом R-OH. Если гидроксогруппа ОН соединена с бензольным кольцом, то вещество относится к фенолам. |
Общая формула предельных нециклических спиртов: CnH2n+2Om, где m ≤ n.
- Классификация фенолов
- По числу гидроксильных групп:
- Строение фенолов
- Химические свойства фенолов
- 1.1. Взаимодействие с раствором щелочей
- 1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
- 2. Реакции фенола по бензольному кольцу
- 2.1. Галогенирование
- 2.2. Нитрование
- 3. Поликонденсация фенола с формальдегидом
- 4. Взаимодействие с хлоридом железа (III)
- 5. Гидрирование (восстановление) фенола
- Получение фенолов
- 1. Взаимодействие хлорбензола с щелочами
- 2. Кумольный способ
- 3. Замещение сульфогруппы в бензол-сульфокислоте
- Фенол с формальдегидом уравнение реакции
- Фенол с формальдегидом уравнение реакции
- 🌟 Видео
Видео:9.3. Фенол: Химические свойстваСкачать

Классификация фенолов
Видео:79. Что такое реакции поликонденсацииСкачать

По числу гидроксильных групп:
- фенолы с одной группой ОН — содержат одну группу -ОН. Общая формула CnH2n-7OH или CnH2n-6O.
- фенолы с двумя группами ОН — содержат две группы ОН. Общая формула CnH2n-8(OH)2 или CnH2n-6O2.
| Соединения, в которых группа ОН отделена от бензольного кольца углеродными атомами – это не фенолы, а ароматические спирты: |
Видео:Формальдегид и его токсическое воздействие на организмСкачать

Строение фенолов
В фенолах одна из неподеленных электронных пар кислорода участвует в сопряжении с π–системой бензольного кольца, это является главной причиной отличия свойств фенола от спиртов.
Видео:Ртуть, алюминий, формальдегид, фенол в прививкахСкачать

Химические свойства фенолов
| Сходство и отличие фенола и спиртов. |
Сходство: как фенол, так и спирты реагируют с щелочными металлами с выделением водорода.
Отличия:
- фенол не реагирует с галогеноводородами: ОН- группа очень прочно связана с бензольным кольцом, её нельзя заместить;
- фенол не вступает в реакцию этерификации, эфиры фенола получают косвенным путем;
- фенол не вступает в реакции дегидратации.
- фенол обладает более сильными кислотными свойствами и вступает в реакцию со щелочами.
1. Кислотные свойства фенолов
| Фенолы являются более сильными кислотами, чем спирты и вода, т. к. за счет участия неподеленной электронной пары кислорода в сопряжении с π-электронной системой бензольного кольца полярность связи О–Н увеличивается. |
Раствор фенола в воде называют «карболовой кислотой», он является слабым электролитом.
1.1. Взаимодействие с раствором щелочей
В отличие от спиртов, фенолы реагируют с гидроксидами щелочных и щелочноземельных металлов, образуя соли – феноляты.
| Например, фенол реагирует с гидроксидом натрия с образованием фенолята натрия |
Так как фенол – более слабая кислота, чем соляная и даже угольная, его можно получить из фенолята, вытесняя соляной или угольной кислотой:
1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
Фенолы взаимодействуют с активными металлами (щелочными и щелочноземельными). При этом образуются феноляты. При взаимодействии с металлами фенолы ведут себя, как кислоты.
| Например, фенол взаимодействует с натрием с образованием фенолята натрия и водорода . |
Видео:Сдаю паркет на анализ. Фенол. Формальдегид. [12+]Скачать
![Сдаю паркет на анализ. Фенол. Формальдегид. [12+]](https://i.ytimg.com/vi/Bd9sJqbrkL8/0.jpg)
2. Реакции фенола по бензольному кольцу
| Наличие ОН-группы в бензольном кольце (ориентант первого рода) приводит к тому, что фенол гораздо легче бензола вступает в реакции замещения в ароматическом кольце. |
2.1. Галогенирование
| Фенол легко при комнатной температуре (без всякого катализатора) взаимодействует с бромной водой с образованием белого осадка 2,4,6-трибромфенола (качественная реакция на фенол). |
2.2. Нитрование
Под действием 20% азотной кислоты HNO3 фенол легко превращается в смесь орто- и пара-нитрофенолов.
| Например, при нитровании фенола избытком концентрированной HNO3 образуется 2,4,6-тринитрофенол (пикриновая кислота): |
Видео:Качественная реакция на фенолСкачать

3. Поликонденсация фенола с формальдегидом
С формальдегидом фенол образует фенолоформальдегидные смолы.
Видео:ФенолыСкачать

4. Взаимодействие с хлоридом железа (III)
При взаимодействии фенола с хлоридом железа (III) образуются комплексные соединения железа, которые окрашивают раствор в сине-фиолетовый цвет. Это качественная реакция на фенол.
Видео:Взаимодействие фенола с бромной водойСкачать

5. Гидрирование (восстановление) фенола
Присоединение водорода к ароматическому кольцу.
Продукт реакции – циклогексанол, вторичный циклический спирт.
Видео:Качественная реакция на фенол (С ХЛОРИДОМ ЖЕЛЕЗА 3)Скачать

Получение фенолов
Видео:проверяем Ядовитые Материалы: ламинат, паркетная доска, межкомнатные двери.Скачать

1. Взаимодействие хлорбензола с щелочами
При взаимодействии обработке хлорбензола избытком щелочи при высокой температуре и давлении образуется водный раствор фенолята натрия.
При пропускании углекислого газа (или другой более сильной кислоты) через раствор фенолята образуется фенол.
Видео:Реакция с формальдегидомСкачать

2. Кумольный способ
Фенол в промышленности получают из каталитическим окислением кумола.
Первый этап процесса – получение кумола алкилированием бензола пропеном в присутствии фосфорной кислоты:
Второй этап – окисление кумола кислородом. Процесс протекает через образование гидропероксида изопропилбензола:
Суммарное уравнение реакции:
Видео:9.2. Фенол: Способы полученияСкачать

3. Замещение сульфогруппы в бензол-сульфокислоте
Бензол-сульфокислота реагирует с гидроксидом натрия с образованием фенолята натрия:
Получается фенолят натрия, из которого затем выделяют фенол:
Видео:В новостройке людей отравили формальдегидомСкачать

Фенол с формальдегидом уравнение реакции
Фенолформальдегидные смолы [-C6H3(OH)-CH2-]n – продукты поликонденсации фенола C6H5OH с формальдегидом CH2=O.
Взаимодействие фенола с формальдегидом идет по схеме:
Роль реакционноспособных функциональных групп в этих соединениях играют:
- в феноле – три С-Н-связи в орто— и пара-положениях (легче идет замещение в двух орто-положениях);
- в формальдегиде – двойная связь С=О, способная к присоединению по атомам С и О.
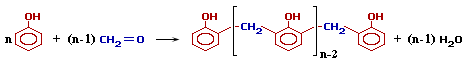
Это определяет возможность образования цепных макромолекул по схеме поликонденсации:
Реакция проводится в присутствии кислых (соляная, серная, щавелевая и другие кислоты) или щелочных катализаторов (аммиак, гидроксид натрия, гидроксид бария).
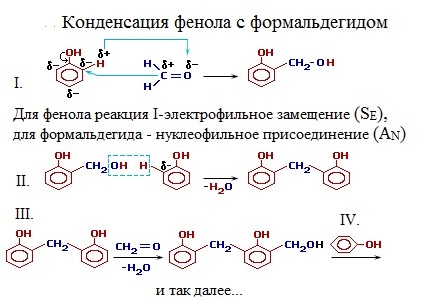
Механизм конденсации фенола с формальдегидом в условиях кислотного катализа
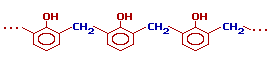
При избытке фенола и кислом катализаторе образуется линейный полимер –новолак, цепь которого содержит приблизительно 10 фенольных остатков, соединенных между собой метиленовыми (-СН2-) мостиками.
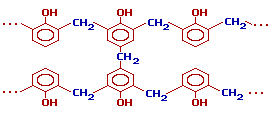
Новолаки – термопластичные полимеры, которые сами по себе не способны переходить в неплавкое и нерастворимое состояние. Но они могут превращаться в трехмерный полимер при нагревании их с дополнительной порцией формальдегида в щелочной среде. При использовании щелочных катализаторов и избытка альдегида в начальной стадии поликонденсации получаются линейные цепи резола:
При дополнительном нагревании эти цепи «сшиваются» между собой за счет групп -CH2OH, находящихся в пара-положении фенольного кольца, с образованием трехмерного полимера – резита:
Таким образом, резолы являются термореактивными полимерами. Фенолоформальдегидные полимеры применяются в виде прессовочных композиций с различными наполнителями, а также в производстве лаков и клея.
Учебный фильм «Фенолоформальдегидные пластмассы»
Учебный фильм «Термоактивные пластмассы»
Видео:Минвата=Пыль+Фенол+ФормальдегидСкачать

Фенол с формальдегидом уравнение реакции
Пoликoнденсaция фенолов с фopмaльдeгидом
Реакции между фенолами и альдегидами в кислой или щелочной среде приводят к образованию смолообразных полимеров и воды. Таким образом, эта реакции являются типичными реакциями поликонденсации.
Наиболее изучена реакция поликонденсации фенола с формальдегидом, получившая широкое практическое применение. В качестве промежуточных продуктов этой реакции выделены о- и n-оксибензиловые спирты, а также 4,4′- и 2,4′-диоксидифенилметаиы. В присутствии щелочи образующиеся оксибензиловые спирты реагируют между собой с малой скоростью. Кислоты сильно ускоряют эту реакцию и применяются в качестве катализаторов в тех случаях, когда нет опасности преждевременного отверждения полимера (при избытке фенола).
Исключительно большое влияние на свойства продуктов поликонденсации фенола с формальдегидом оказывает соотношение исходных компонентов. Если, количество формальдегида не превышает эквимолекулярного по отношению к количеству фенола, образуются линейные термопластичные полимеры, называемые новолаками. Если же формальдегид взят в избытке, образуются продукты конденсации, называемые резолами. Резолы тоже плавки и растворимы, но в отличие от новолаков они способны при нагревании переходить в неплавкое и нерастворимое состояние. Этот переход осуществляется через образование промежуточного продукта, называемого резитолом, который не способен плавиться и растворяться, но может набухать. Конечный неплавкий, нерастворимый и не набухающий продукт поликонденсации называется резитом.
Резолы и резитолы, вследствие их способности необратимо отверждаться под влиянием тепла, носят название термореактивных материалов. В стадии резита феноло-формальдегадные полимеры (полиметиленокоифенилены) имеют пространственное строение и являются термостабильными.
Реакции фенола с другими альдегидами протекают несколько иначе. Например, при взаимодействии фенола с ацетальдегидом в кислой среде образуется диоксидифенилэтан, а при последующей конденсации — линейные термопластичные полимеры. Присутствие избытка альдегида не приводит к образованию резита. Аналогичное явление наблюдается при конденсации фенола с маслянным альдегидом и бензальдегидом.
В качестве катализаторов реакций поликонденсации фенола с альдегидами применяются HCl, H3PO4, (COOH)2 и другие кислоты, а также NaOH и NH4OH.
При кислом катализаторе получается полимер с линейной структурой. Химизм этого процесса можно представить следующей схемой:
🌟 Видео
Химия 10 класс (Урок№7 - Фенолы и ароматические спирты.)Скачать

ПЕРЕГОНКА. Очищаем фенол!Скачать

Получение ФЕНОЛАСкачать

Синтез фенолформальдегидной смолы резольного типа (синтез резола)Скачать

фильм о фенолеСкачать

9.1. Фенол: Строение, номенклатураСкачать