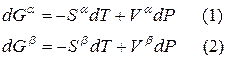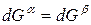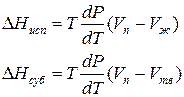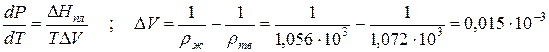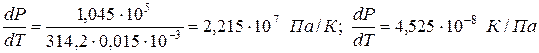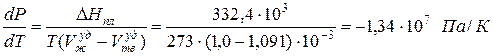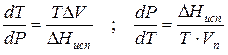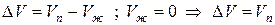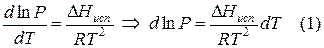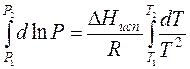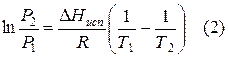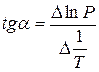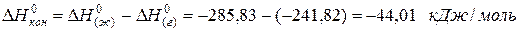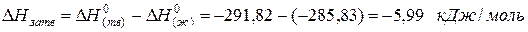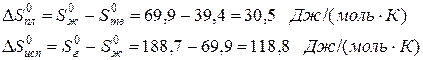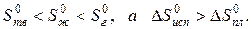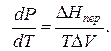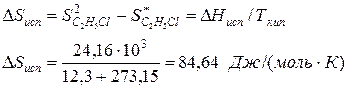ТЕПЛОВЫЕ ЭФФЕКТЫ ФАЗОВЫХ ПЕРЕХОДОВ.
УРАВНЕНИЕ КЛАПЕЙРОНА – КЛАУЗИУСА.
Переход компонента из одной фазы в другую сопровождается выделением или поглощением теплоты, которую можно определить количественно на основе фундаментального уравнения термодинамики:
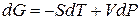
ВЫВОД И АНАЛИЗ УРАВНЕНИЯ КЛАПЕЙРОНА – КЛАУЗИУСА.
Для любого равновесного перехода вещества из одной фазы α в другую фазу β, применяя уравнение (*) к каждой из фаз, можно написать
Индексы α и β отражают принадлежность параметров к соответствующей фазе. В равновесных условиях между фазами α и β изменение энергии Гиббса отсутствует, т.е.
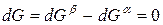
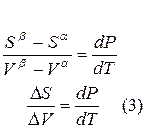
Для равновесного обратимого процесса согласно уравнениям 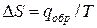
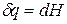
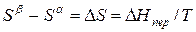
а уравнение (3) примет вид
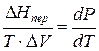
где ∆Hпер – теплота фазового перехода.
Тепловой эффект, сопровождающий фазовый переход, определяется следующим образом:
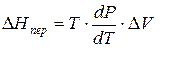
Клапейрона–Клаузиуса
где ∆V – изменение объема в результате фазового перехода; dP/dT – изменение давления в зависимости от температуры при сохранении равновесия между двумя фазами.
Уравнение Клапейрона–Клаузиуса связывает тепловой эффект процесса с изменением давления насыщенного пара, температурой и изменением объема в процессе фазового перехода.
Для процессов испарения ж→п и сублимации тв→п уравнение Клапейрона–Клаузиуса можно представить следующим образом:
где ∆Hисп , ∆Hсуб – теплоты испарения и сублимации; Vп, Vж, Vтв – мольные объемы пара, жидкости и твердого тела соответственно.
В процессе испарения и сублимации наблюдается значительное изменение удельного объема ∆V и существенное изменение величины dP/dT. При плавлении, напротив, изменение ∆V невелико, и величина dP/dT незначительна.
Пример 1. Проведем расчет по уравнению Клапейрона–Клаузиуса температуры плавления фенола Тпл. Плотность твердого фенола ρтв при атмосферном давлении составляет 1,072∙10 3 кг/м 3 , а жидкого ρж = 1,056∙10 3 кг/м 3 ; теплота плавления ∆Hпл = 1,045∙10 5 Дж/кг; температура замерзания 314,2 К. Определим dP/dT и температуру плавления при Р = 5,065∙10 7 Па:
Прирост температуры плавления при повышении давления на 1 атм ( 1,013∙10 5 Па) составляет 4,525∙10 -8 град/Па. При увеличении давления до 5,065∙10 7 Па температура плавления увеличивается на ∆T = (dT/dP)∆P = 4,525∙10 -8 ∙ 5,065∙10 7 = 2,29 К, т.е. составит Тпл = 314,2+2,29 = 316,49 К.
Следует иметь в виду, что в процессе плавления у большинства веществ Vж > Vтв , тогда ∆V>0 и при повышении давления Р↑ температура плавления повышается Т↑.
Однако, такие вещества как вода (Н2О), висмут (Bi), имеют объем твердой фазы Vтв больше, чем объем жидкой фазы Vж уд = 10 -3 м 3 /кг и Vтв уд = 1,091·10 -3 м 3 /кг; теплота плавления ∆Hпл = 332,4 кДж/кг:
Это значение показывает, что для понижения температуры таяния льда на один градус Кельвина необходимо увеличить давление на 1,34∙10 7 Па, т.е. примерно на 134 атмосферы, что нереально, поскольку такое давление лед не выдерживает – трескается.
Таяние льда происходит в основном в результате трения и превращения работы в теплоту при скольжении конька по льду, а не за счет повышения давления на лед.
Уравнение для процесса испарения 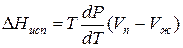
Пар подчиняется законам идеального газа: PV=RT 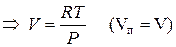
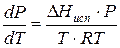
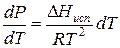
Проведем интегрирование уравнения (1) в пределах от Т1 до Т2 и соответственно от Р1 до Р2 при условии, что в области невысоких давлений пара ∆Нисп ≈ const; в результате интегрирования получим:
∆Нисп / R = const, выносим за знак интеграла
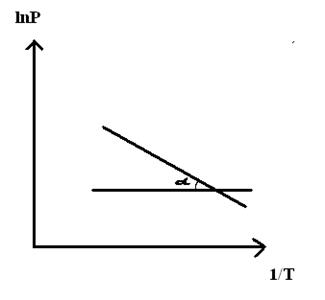
При помощи уравнения (2) можно графически определить значения теплоты испарения, если известны давления Р1 и Р2 и соответствующие им температуры испарения Т1 и Т2 . Для этого необходимо отложить на оси абсцисс значения обратной температуры, а на оси ординат – lnP.
Зависимость lnP от 1/Т будет линейной, а тангенс угла наклона этой прямой равен 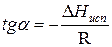
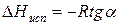
Расчетные значения ∆Нисп получаются с достаточной для практики точностью, не уступающей точности непосредственного измерения. Возможно использование уравнения (2) для обратного расчета, когда по значению ∆Нисп определяют изменение давления при изменении температуры в процессе испарения.
Теплоту фазовых переходов можно определить и по величине стандартной энтальпии образования, в зависимости от фазового состояния продуктов реакции.
Пример. Лучше всего это показать на примере теплоты образования воды из газообразных кислорода и водорода, которая составляет
для водяного пара ∆Н(г) 0 = -241,82 кДж/моль; для воды в жидком состоянии ∆Н(ж) 0 = -285,83 кДж/моль; для льда ∆Н(тв) 0 = -291,82 кДж/моль. Теплота конденсации воды равна:
а теплота превращения воды в лед:
Как видно, тепловой эффект фазовых переходов значительно меньше теплоты образования веществ.
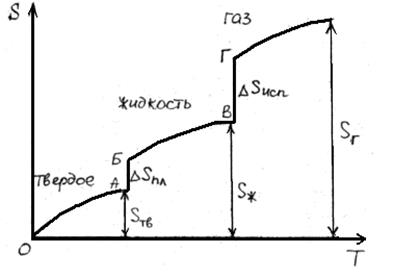
В результате фазовых переходов происходит изменение энтропии. Такие изменения в зависимости от температуры представим на рисунке.
Как известно, энтропия идеального кристалла при абсолютном нуле равна нулю. С ростом температуры атомы (ионы) флуктуировать относительно равновесного положения, число возможных способов их размещения растет, и энтропия увеличивается (ΔS>0). При достижении температуры плавления (точка А на рисунке) кристаллическая решетка разрушается скачкообразно (отрезок АБ), увеличивается термодинамическая вероятность системы W, а в соответствии с формулой S=k∙lnW (где k – постоянная Больцмана) энтропия при переходе от твердого в жидкое состояние растет. Более значительный скачок энтропии имеет место при переходе из жидкого состояния в газообразное (отрезок ВГ), когда ближний порядок расположения частиц друг относительно друга нарушается, и движение частиц становится хаотичным.
Пример. Оценим скачок энтропии на примере фазовых переходов воды:
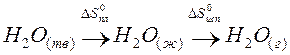
когда известны стандартные абсолютные значения энтропии Sтв 0 =39,4; Sж 0 =69,9; Sг 0 =188,7 Дж/(моль·К).
В соответствии с рисунком для воды
По известной энтальпии фазового перехода можно рассчитать изменение энтропии в соответствии с формулой
Пример.Вычислим изменение энтропии в процессе парообразования 1 моля этилхлорида при 12,3 0 С, когда теплота испарения ∆Нисп =24,16 кДж/моль.
Молекулярная масса 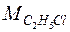
В заключение отмечу, что мы рассматривали лишь фазовые переходы I рода. При фазовых переходах I рода свойства веществ, выражаемые, например, через химический потенциал, первыми производными одной из характеристических функций, изменяются скачком при непрерывном изменении соответствующих параметров: температуры, давления, объема и энтропии. При этом выделяется или поглощается теплота перехода ∆Нпер в соответствии с уравнением Клапейрона–Клаузиуса.
Кроме них, однако, существуют фазовые переходы II рода. Они не сопровождаются выделением или поглощением теплоты, для них уравнение Клапейрона–Клаузиуса теряет смысл. Эти переходы характеризуют изменения в системе, которые не определяются объемом и запасом энергии. В этом случае первые производные одной из характеристических функций непрерывны, а вторые производные (например, теплоемкость) изменяются скачком. К фазовым переходам II рода относятся переходы парамагнетика в ферромагнетик, диэлектрика в сегнетоэлектрик, а также процессы возникновения сверхтекучести, сверхпроводимости и др.
В настоящее время насчитывается около 400 твердых минералов, для которых наблюдаются фазовые переходы II рода: рутил, анатаз, алмаз и особенно кварц, который имеет семь модификаций, причем наряду с фазовыми переходами I рода наблюдаются фазовые переходы II рода. Так, при 573 0 С и переходе модификации кварца β 
| | | следующая лекция ==> | |
| ДИАГРАММА СОСТОЯНИЯ СЕРЫ. | | | ХАРАКТЕРИСТИКА И СВОЙСТВА РАСТВОРОВ. |
Дата добавления: 2016-02-02 ; просмотров: 3086 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Видео:Лекция №6 "Фазовые переходы. Газ Ван-дер-Ваальса"Скачать

Физическая химия
Главная > Документ
| Информация о документе | |
| Дата добавления: | |
| Размер: | |
| Доступные форматы для скачивания: |
§ 3. Фазовые переходы. Уравнение Клапейрона-Клаузиуса
В системе, состоящей из нескольких фаз чистого вещества, находящихся в равновесии, возможны переходы вещества из одной фазы в другую. Такие переходы называются фазовыми переходами или превращениями агрегатных состояний.
Рассмотрим равновесный переход одного моля вещества из одной фазы (1) в другую (2), совершающийся при постоянных давлении и температуре. Энергии Гиббса ( G 1 и G 2 ) моля вещества в фазах 1 и 2 равны (условие равновесия). Следовательно:
G 2 = G 1 (III, 14)
Напишем уравнения (III, 13б) полных дифференциалов для энергии Гиббса одного моля чистого вещества в двух равновесных фазах 1 и 2:
dG 1 = V 1 dP – S 1 dT
dG 2 = V 2 dP – S 2 dT (III, 15)
Вычитая верхнее уравнение из нижнего, получим:
dG 2 – dG 1 = ( V 2 – V 1 ) dP – ( S 2 – S 1 ) dT
Изменения P и Т здесь были не независимыми, а такими, при которых сохранялось равновесие между фазами 1 и 2. Таким образом, между P и Т сохранялась функциональная связь, соответствующая фазовому равновесию. Поэтому, если G 1 = G 2 (равновесие при давлении P и температуре Т ), то G 1 + dG 1 = G 2 + dG 2 (равновесие при давлении P + dP и температуре T + dT ), т. е. dG l = dG 2 или dG 2 – dG 1 = 0. Следовательно
( V 2 – V 1 ) dP – ( S 2 – S 1 ) dT = 0

Взаимное превращение, фаз рассматривалось здесь как равновесное и изотермическое, поэтому:
S 2 – S 1 = S = 


Здесь 
Из уравнений (III, 16) и (III, 17) получим:

Уравнение (III, 18) называется уравнением Клапейрона — Клаузиуса и является общим термодинамическим уравнением, приложимым ко всем фазовым переходам чистых веществ, т.е. к превращениям агрегатных состояний.
При превращении одной фазы в другую такие свойства как удельный или мольный объём, внутренняя энергия и энтропия одного грамма или одного моля вещества изменяются скачкообразно. Однако отсюда не следует, что внутренняя энергия всей двухфазной системы не является в этом случае непрерывной функцией её состояния. В самом деле, система, состоявшая в начале процесса, например, из некоторого количества льда при 0°С и 1 атм, при постоянном давлении и подведении теплоты превращается в двухфазную систему лед-жидкая вода, в которой по мере поглощения теплоты масса льда постепенно и непрерывно убывает, а масса воды растет. Поэтому также постепенно и непрерывно изменяются такие свойства системы в целом как внутренняя энергия, энтальпия, энтропия и др.
§ 4. Фазовые переходы первого рода. Плавление. Испарение
Фазовые переходы, характеризующиеся равенством изобарных потенциалов двух сосуществующих в равновесии фаз и скачкообразным изменением энтропии и объема при переходе вещества из одной фазы в другую, – называются фазовыми переходами первого рода. К ним относятся агрегатные превращения – плавление, испарение, возгонка и др.
Из фазовых переходов первого рода рассмотрим плавление и испарение, представляющие более общий интерес, чем другие процессы.
Плавление. Теплота плавления – перехода твердой фазы в жидкую – всегда положительна. Объём (мольный, удельный) жидкой фазы ( V ж = V 2 ) в общем случае может быть больше или меньше объёма того же количества твердой фазы ( V т = V 1 ) . Отсюда в соответствии с уравнением (III, 18) вытекает, что величина dP / dT или обратная ей величина dT / dP , характеризующая изменение температуры с увеличением давления, может быть положительной или отрицательной. Это значит, что температура плавления может повышаться или понижаться с увеличением давления.
Так, для бензола ( t пл. = 5,4°C; 

Обратная величина dT / dP = 0,0282 
Величина dT / dP положительна для огромного большинства веществ. Она имеет отрицательное значение лишь для воды, висмута и немногих других веществ, для которых плотность жидкости при температуре плавления больше плотности твердой фазы и ( V ж – V т )
Испарение. Теплота испарения – перехода жидкой фазы в газообразную – так же, как и теплота плавления, положительна. В этом случае всегда объём (удельный, мольный) газа больше соответствующего объёма жидкости, т. е. в уравнении (III, 18) всегда V 2 > V 1 . Поэтому dP / dT , а значит, и dT / dP также всегда положительны. Следовательно, температура испарения всегда повышается с ростом давления.
При температурах, далеких от критической, плотность насыщенного пара во много раз меньше плотности жидкости, а обратная величина – мольный (удельный) объём пара во много раз больше мольного (удельного) объёма жидкости. Поэтому значением V 1 = V ж в уравнении (III, 18) можно пренебречь, и оно примет вид:

Если вдали от критической температуры насыщенный пар можно считать идеальным газом, тогда 


Теплота испарения жидкостей изменяется с температурой, не сильно убывая при средних температурах и очень сильно вблизи критической температуры, при которой 

Таблица 1. Энтальпия и энтропия испарения некоторых жидкостей при нормальной температуре кипения ( Р = 1 атм)

кал/моль

кал/моль· K
§ 5. Зависимость давления насыщенного пара от температуры
Давление насыщенного пара жидкости резко увеличивается с повышением температуры. Это видно из рис.2, на котором изображены кривые давления пара некоторых жидкостей, начинающиеся в точках плавления и оканчивающиеся в критических точках.
Рис. 2. Зависимость давления насыщенного пара некоторых жидкостей от температуры.
Функциональная зависимость давления насыщенного пара жидкости от температуры может быть выражена уравнением (III, 18), а вдали от критической температуры уравнением (III, 19).
Считая теплоту испарения (возгонки) постоянной в небольшом интервале температур, можно проинтегрировать уравнение (III, 19а)

Представив уравнение (III, 20) в виде неопределенного интеграла, получим:

где С – константа интегрирования.
В соответствии с этими уравнениями зависимость давления насыщенного пара жидкости (или кристаллического вещества) от температуры может быть выражена прямой линией в координатах 

На рис.3 изображена зависимость давления насыщенного пара некоторых жидкостей в указанных координатах, удовлетворительно укладывающаяся на прямые линии в интервале 0-100°С.
Однако уравнение (III, 21) не охватывает зависимости давления насыщенного пара от температуры во всем интервале температур – от температуры плавления до критической. С одной стороны, теплота испарения зависит от температуры, и интегрирование должно производиться с учётом этой зависимости. С другой стороны, насыщенный пар при высоких температурах нельзя считать идеальным газом. Поэтому уравнение, охватывающее зависимость P = f ( T ) в широком интервале температур, неизбежно становится эмпирическим.
Рис.3. Зависимость логарифма давления насыщенного пара некоторых жидкостей от обратной температуры.
§ 6. Сверхкритическое состояние вещества.
Сверхкритическое состояние – четвертая форма агрегатного состояния, в которое способны переходить многие органические и неорганические вещества.
Впервые сверхкритическое состояние вещества обнаружил Каньяр де ла Тур в 1822 году. Настоящий интерес к новому явлению возник 1869 году после экспериментов Т.Эндрюса. Проводя опыты в толстостенных стеклянных трубках, учёный исследовал свойства CO 2 , легко сжижающегося при повышении давления. В результате он установил, что при 31° С и 7,2 МПа , мениск – граница, разделяющая жидкость и находящийся в равновесии с ней пар, исчезает, при этом система становится гомогенной (однородной) и весь объем приобретает вид молочно-белой опалесцирующей жидкости. При дальнейшем повышении температуры она быстро становится прозрачной и подвижной, состоящей из постоянно перетекающих струй, напоминающих потоки теплого воздуха над нагретой поверхностью. Дальнейшее повышение температуры и давления не приводило к видимым изменениям.
Точку, в которой происходит такой переход, он назвал критической, а состояние вещества, находящегося выше этой точки – сверхкритическим. Несмотря на то, что внешне это состояние напоминает жидкость, в применении к нему сейчас используется специальный термин – сверхкритический флюид (от английского слова fluid , то есть «способный течь»). В современной литературе принято сокращенное обозначение сверхкритических флюидов – СКФ.
Расположение линий, разграничивающих области газообразного, жидкого и твердого состояний, а также положение тройной точки, где сходятся все три области, для каждого вещества индивидуальны. Сверхкритическая область начинается в критической точке (обозначена звездочкой), которая характеризуется непременно двумя параметрами – температурой ( Т кр . ) и давлением ( Р кр . ). Понижение либо температуры, либо давления ниже критических значений выводит вещество из сверхкритического состояния.
Факт существования критической точки позволил понять, почему некоторые газы, например, водород, азот и кислород долгое время не удавалось получить в жидком виде при повышении давления, из-за чего их называли перманентными газами (от латинского permanentis – «постоянный»). На приведённой выше диаграмме видно, что область существования жидкой фазы расположена слева от линии критической температуры. Таким образом, для сжижения какого-либо газа его необходимо сначала охладить до температуры ниже критической. У СО 2 критическая температура выше комнатной, поэтому его можно сжижать при указанных условиях, повышая давление. У азота критическая температура намного ниже: –146,95° С, поэтому, если сжимать азот, находящийся при нормальных условиях, можно достичь в конечном итоге сверхкритической области, но жидкий азот при этом образоваться не может. Необходимо сначала охладить азот ниже критической температуры и затем, повышая давление, достичь области, где возможно существование жидкости. Аналогичная ситуация для водорода, кислорода, поэтому перед сжижением их охлаждают до температуры ниже критической, и лишь затем повышают давление. Сверхкритическое состояние возможно для большинства веществ, нужно лишь, чтобы вещество не разлагалось при критической температуре. В сравнении с указанными веществами критическая точка воды достигается с большим трудом: t кр = 374,2° С и Р кр = 21,4 МПа .
Критическая точка признается как важный физический параметр вещества, такой же, как температуры плавления или кипения. Плотность СКФ исключительно низкая, например, вода в состоянии СКФ имеет плотность в три раза ниже, чем при обычных условиях. Все СКФ имеют крайне низкую вязкость.
Сверхкритические флюиды представляют собой нечто среднее между жидкостью и газом. Они могут сжиматься как газы (обычные жидкости практически несжимаемы) и, в тоже время, способны растворять многие вещества в твёрдом и жидком состояниях, что газам несвойственно. Сверхкритический этанол (при температуре выше 234° С) очень легко растворяет некоторые неорганические соли ( CoCl 2 , KBr , KI ). Диоксид углерода, закись азота, этилен и некоторые другие газы в состоянии СКФ приобретают способность растворять многие органические вещества – стеариновую кислоту, парафин, нафталин. Свойства сверхкритического СО 2 как растворителя можно регулировать – при повышении давления его растворяющая способность резко увеличивается.
Сверхкритические флюиды стали широко использовать только в 1980-х, когда общий уровень развития промышленности сделал установки для получения СКФ широко доступными. С этого момента началось интенсивное развитие сверхкритических технологий. СКФ – это не только хорошие растворители, но и вещества с высоким коэффициентом диффузии, т.е. они легко проникают в глубинные слои различных твердых веществ и материалов. Наиболее широкое применение нашёл сверхкритический СО 2 , который оказался растворителем широкого круга органических соединений. Диоксид углерода стал лидером в мире сверхкритических технологий, т.к. обладает целым комплексом преимуществ. Перевести его в сверхкритическое состояние достаточно легко ( t кр – 31° С, Р кр – 73,8 атм. ), кроме того, он не токсичен, не горюч, не взрывоопасен, к тому же, дешев и доступен. С точки зрения любого технолога он является идеальным компонентом любого процесса. Особую привлекательность ему придает то, что он является составной частью атмосферного воздуха и, следовательно, не загрязняет окружающую среду. Сверхкритический СО 2 можно считать экологически абсолютно чистым растворителем. Приведём только некоторые примеры его использования.
Кофеин – препарат, используемый для улучшения деятельности сердечно-сосудистой системы, получают из кофейных зерен даже без их предварительного измельчения. Полнота извлечения достигается за счет высокой проникающей способности СКФ. Зерна помещают в автоклав – ёмкость, выдерживающую повышенное давление, затем подают в неё газообразный СО 2 , далее создают необходимое давление (>73 атм. ), в результате СО 2 переходит в сверхкритическое состояние. Всё содержимое перемешивают, после чего флюид вместе с растворенным кофеином сливают в открытую емкость. Диоксид углерода, оказавшись в условиях атмосферного давления, превращается в газ и улетает в атмосферу, а экстрагированный кофеин остается в открытой емкости в чистом виде.
Применение СКФ оказалось весьма успешным для очистки от загрязнений электронных схем в процессе их производства, так как на них не остается никаких следов очищающего растворителя.
В связи с быстрыми темпами выработки активной части запасов легкой нефти резко возрос интерес к методам увеличения нефтеотдачи пластов. Если в 70–80 годы XX века число проектов, направленных на решение проблемы увеличения нефтеотдачи посредством нагнетания смешивающихся углеводородных растворителей, «инертных» газов и диоксида углерода было сопоставимо, то в конце XX и начале XXI столетий только метод нагнетания СО 2 имел устойчивую тенденцию роста. Эффективность применения СО 2 для повышения нефтеотдачи доказана не только экспериментальными и теоретическими работами, но и результатами многочисленных промышленных испытаний.
Не стоит забывать, что технология увеличения нефтеотдачи пластов с использованием СО 2 позволяет параллельно решать проблему консервации огромного количества выделяемого промышленностью углекислого газа.
Особенности процесса воздействия нагнетаемого CO 2 на нефтегазовую залежь зависят от его агрегатного состояния.
Превышение давления и температуры выше критических значений для углекислого газа (а это наиболее вероятная ситуация в пластовых условиях), предопределяет его сверхкритическое состояние. В этом случае CO 2 , обладающий исключительной растворяющей способностью по отношению к углеводородным жидкостям при прямом растворении в пластовой нефти, снижает её вязкость и резко улучшает фильтрационные свойства. Указанное обстоятельство даёт все основания отнести СКФ – технологии повышения нефтеотдачи пластов к одним из наиболее перспективных.
Видео:Теплофизика Л7. Фазовые переходы. Уравнение Клапейрона - Клаузиуса. Уравнение Ван-дер-ВаальсаСкачать

КЛАПЕЙРО́НА – КЛА́УЗИУСА УРАВНЕ́НИЕ
В книжной версии
Том 14. Москва, 2009, стр. 215
Скопировать библиографическую ссылку:
КЛАПЕЙРО́ НА – КЛ А́УЗИУСА УРАВНЕ́ НИЕ, уравнение, характеризующее фазовые переходы 1-го рода (плавление, испарение, сублимацию, полиморфные превращения); устанавливает связь между равновесными значениями абсолютной темп-ры $T$ и давления $p $ при фазовых переходах 1-го рода однокомпонентной системы с теплотой фазового перехода и изменением фазового объёма. К. – К. у. имеет вид: $$frac
🔍 Видео
Урок 194. Уравнение Ван-дер-ВаальсаСкачать

Коробов М. В. - Физическая химия. Часть 1 - Фазовые диаграммы. Фазовые переходыСкачать

Фазовые диаграммы. Тройная точка. Критическое состояние вещества. 10 класс.Скачать

Успеть за 300 секунд, #3: Уравнение Клапейрона-МенделееваСкачать

Лекция №5 "Фазовые переходы" (Попов П.В.)Скачать

Теория фазовых переходов — Михаил ФейгельманСкачать

Физика 10 класс: Уравнение Клапейрона-МенделееваСкачать

Задачи на уравнение Менделеева-Клапейрона. Ч.1. Краткая теория + решение задачиСкачать

Физическая химия # 2. Вывод уравнения Клаузиуса-КлапейронаСкачать

Грибов В. А. - Термодинамика и статистическая физика - Фазовые переходыСкачать

Физика. МКТ: Уравнение Менделеева-Клапейрона для идеального газа. Центр онлайн-обучения «Фоксфорд»Скачать

Уравнение КЛАПЕЙРОНА-КЛАЗИУСА | МОЛЕКУЛЯРКА (лекция) - КАРАВАЕВ В. А. ФизФак МГУСкачать

Физика 10 класс. Агрегатные (фазовые) переходы.Скачать

ИЗИ Физика. Уравнение теплового баланса. Фазовые переходыСкачать

Термодинамика Л13. 2023 Сравнение уравнений состояния реальных газов. Уравнение Клапейрона-КлаузиусаСкачать

Урок 156. Уравнение состояния идеального газа. Квазистатические процессыСкачать

Бушина Т. А. - Молекулярная физика - Фазовые переходыСкачать

8.9 Типы фазовых переходовСкачать