Химия | 10 — 11 классы
Факторы , позволяющие сместить химическое равновесие реакции, уравнение которой 4 NH + 5O2< ; = > ; 4NO + 6H2O + Q, в сторону образования продуктов реакции ?
1)повышение температуры и давления 2)понижение температуры и давления 3)понижение температуры и повышение давления 4)повышение температуры и понижение давления.
2)понижение температуры и давления.
- Химическое равновесие в системе 2SO2(г) + О2(г) — — — 2SO3 (г) + Q сместится в сторону продукта реакции при :1 Понижение температуры и понижении давления?
- В какую сторону сместится равновесие реакциипри : повышение давления, понижения температуры?
- Факторы, позволяющие сместить химическое равновесие реакции, уравнение которой СаО + СО2 ↔ СаСО3 + Q, в сторону образования продукта реакции : А?
- Химическое равновесие в система : C6H11 — CH3 — — — — — — — C6H5 — CH3 + 3H2 — Q сместится в сторону исходного вещества при : а)повышении температуры 2)понижении давления 3)повышении давления?
- Химическое равновесие в системе H2O + SO2 = H2SO4(р — р) + Q сместится в сторону продуктов реакции при а) понижении температуры б)повышении температуры в)понижения давления?
- Факторы, позволяющие сместить химическое равновесие реакции, уравнение которой 2NO + О2 ↔ 2NO2 + Q, в сторону образования продукта реакции : А?
- В сторону какой реакции сместится химическое равновесие 2SO2 + O2 = 2SO3, ΔH° = 192 кДж?
- Определите, при каких условиях химическое равновесие в системе H2 + Br2 = 2HBr + Q смещается в сторону продукта реакции : а)при повышении давления б)при понижении температуры в)при понижении давления ?
- Как сместиться равновесие реакций азота с кислородом и азота с водородом при повышении и понижении давления, при повышении и понижении температуры?
- 3. Равновесие в системе Н2(г) + I2(г) = 2HI(г) +Q сместится в сторону продуктов реакцииа) при повышении температуры ;б) при повышении давления ;в) в присутствии катализатора ;г) при понижении температ?
- Для реакции 4NH3 + 5O2=4NO+6H2O записать выражение закона действующих масс и указать условия смещения равновесия вправо
- Ваш ответ
- решение вопроса
- Похожие вопросы
- Презентация на тему «Химические реакции»
- 🔍 Видео
Видео:Обратимость и необратимость химических реакций. Химическое равновесие. 2 часть. 9 класс.Скачать

Химическое равновесие в системе 2SO2(г) + О2(г) — — — 2SO3 (г) + Q сместится в сторону продукта реакции при :1 Понижение температуры и понижении давления?
Химическое равновесие в системе 2SO2(г) + О2(г) — — — 2SO3 (г) + Q сместится в сторону продукта реакции при :
1 Понижение температуры и понижении давления.
2 Повышение давления и температуры .
3 повышении давления и понижении температуры.
4 увеличении концентрации SO3 и понижении температуры.
Видео:Обратимые и необратимые реакции | Химическое равновесие и условия его смещенияСкачать

В какую сторону сместится равновесие реакциипри : повышение давления, понижения температуры?
В какую сторону сместится равновесие реакциипри : повышение давления, понижения температуры.
Дайте обоснованый ответ,.
Видео:Обратимость химических реакций. Химическое равновесие | Химия 11 класс #16 | ИнфоурокСкачать

Факторы, позволяющие сместить химическое равновесие реакции, уравнение которой СаО + СО2 ↔ СаСО3 + Q, в сторону образования продукта реакции : А?
Факторы, позволяющие сместить химическое равновесие реакции, уравнение которой СаО + СО2 ↔ СаСО3 + Q, в сторону образования продукта реакции : А.
Повышения температуры и давления.
Б. Понижение температуры и давления.
В. Понижение температуры и повышение давления.
Г. Повышение температуры и понижение давления.
Видео:Условия смещения химического равновесия. 9 класс.Скачать

Химическое равновесие в система : C6H11 — CH3 — — — — — — — C6H5 — CH3 + 3H2 — Q сместится в сторону исходного вещества при : а)повышении температуры 2)понижении давления 3)повышении давления?
Химическое равновесие в система : C6H11 — CH3 — — — — — — — C6H5 — CH3 + 3H2 — Q сместится в сторону исходного вещества при : а)повышении температуры 2)понижении давления 3)повышении давления.
Видео:Химическое равновесие. Константа равновесия. Обратимость реакций.Скачать

Химическое равновесие в системе H2O + SO2 = H2SO4(р — р) + Q сместится в сторону продуктов реакции при а) понижении температуры б)повышении температуры в)понижения давления?
Химическое равновесие в системе H2O + SO2 = H2SO4(р — р) + Q сместится в сторону продуктов реакции при а) понижении температуры б)повышении температуры в)понижения давления.
Видео:Обратимые реакции и химическое равновесие (видео 5) | Химическое равновесие | ХимияСкачать
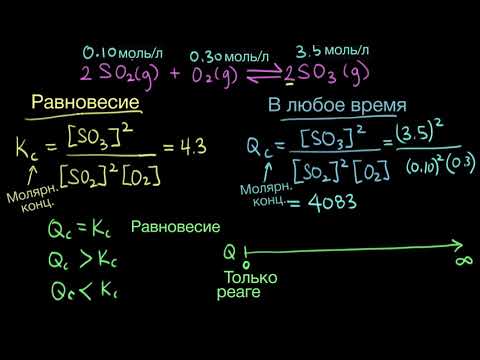
Факторы, позволяющие сместить химическое равновесие реакции, уравнение которой 2NO + О2 ↔ 2NO2 + Q, в сторону образования продукта реакции : А?
Факторы, позволяющие сместить химическое равновесие реакции, уравнение которой 2NO + О2 ↔ 2NO2 + Q, в сторону образования продукта реакции : А.
Повышения температуры и давления.
Б. Понижение температуры и давления.
В. Понижение температуры и повышение давления.
Г. Повышение температуры и понижение давления.
Видео:Химическое равновесие | Химия ЕГЭ, ЦТСкачать

В сторону какой реакции сместится химическое равновесие 2SO2 + O2 = 2SO3, ΔH° = 192 кДж?
В сторону какой реакции сместится химическое равновесие 2SO2 + O2 = 2SO3, ΔH° = 192 кДж.
При : а)понижении температуры, б) повышения давления.
Видео:Химическое равновесие. Смещение равновесия. Принцип Ле ШательеСкачать

Определите, при каких условиях химическое равновесие в системе H2 + Br2 = 2HBr + Q смещается в сторону продукта реакции : а)при повышении давления б)при понижении температуры в)при понижении давления ?
Определите, при каких условиях химическое равновесие в системе H2 + Br2 = 2HBr + Q смещается в сторону продукта реакции : а)при повышении давления б)при понижении температуры в)при понижении давления г)при использование катализатора.
Видео:Обратимость и необратимость химических реакций. Химическое равновесие. 1 часть. 9 класс.Скачать

Как сместиться равновесие реакций азота с кислородом и азота с водородом при повышении и понижении давления, при повышении и понижении температуры?
Как сместиться равновесие реакций азота с кислородом и азота с водородом при повышении и понижении давления, при повышении и понижении температуры?
Видео:84. Принцип Ле-Шателье. Смещение равновесия (часть 1)Скачать

3. Равновесие в системе Н2(г) + I2(г) = 2HI(г) +Q сместится в сторону продуктов реакцииа) при повышении температуры ;б) при повышении давления ;в) в присутствии катализатора ;г) при понижении температ?
3. Равновесие в системе Н2(г) + I2(г) = 2HI(г) +
Q сместится в сторону продуктов реакции
а) при повышении температуры ;
б) при повышении давления ;
в) в присутствии катализатора ;
г) при понижении температуры.
На этой странице находится вопрос Факторы , позволяющие сместить химическое равновесие реакции, уравнение которой 4 NH + 5O2< ; = > ; 4NO + 6H2O + Q, в сторону образования продуктов реакции ?. Здесь же – ответы на него, и похожие вопросы в категории Химия, которые можно найти с помощью простой в использовании поисковой системы. Уровень сложности вопроса соответствует уровню подготовки учащихся 10 — 11 классов. В комментариях, оставленных ниже, ознакомьтесь с вариантами ответов посетителей страницы. С ними можно обсудить тему вопроса в режиме on-line. Если ни один из предложенных ответов не устраивает, сформулируйте новый вопрос в поисковой строке, расположенной вверху, и нажмите кнопку.
Пишем реакцию 2Al + 3Cl2 = 2AlCl3 По уравнению реакции n(Cl2) = 3 / 2n(Al) = 3 / 2 * 0. 24 = 0. 36 моль Считаем объем хлора V = n * Vm = 0. 36 * 22. 4 = 8. 064 л.
Вот такая формула : C5H12.
1) С + O2 = СO2 2)CO2 + H2 = H2CO2 3) H2CO3 + Ca(OH)2 = CaCO3 + 2H20 4) CaCO3 + 2HCl = CaCl2 + H2O + CO2 C — УГЛЕРОД O — кислород H — водород CA — кальций Cl — ХЛОР.
А) 2HNO3 + CuO — Cu(NO3)2 + H2O б) H2SO4 + 2NaOH — Na2SO4 + 2H2O в) 2HCl + K2CO3 — 2KCl + H2CO3.
Последнее не знаю точно.
2) и 6) если 2 варианта надо, если один то только 6).
Найдем сперва сколько грамм весит 1 моль. D(метан) = х / 16 Делим х на 16, так как метан весит 16. И вот подставим значения. 2, 5 = х / 16 Х = 40 Нашли что вещество весит 40 грамм. Напишем реакцию горения для сгорания 10 грамм этого вещетва , то ..
Ca + 2H₂O = Ca(OH)₂ + H₂↑ Ca + SiO₂(t) = CaO + Si CaO + SiO₂ (t) = CaSiO₃ 5Ca + 2CO₂(t) = CaC₂ + 4CaO Ca + 2HCl = CaCl₂ + H₂↑ 3Ca + N₂(t) = Ca₃N₂ Ca + H₂(t) = CaH₂.
N = m / M = 5, 34 / 132, 5 = 0, 04г / моль 3 — 2 х — 0, 04 это пропорция х = 0, 06г / моль V = n * Vm = 0, 06 * 22, 4 = 1, 344л.
2Mg + H2O — MgO + H2 Cu + HCl = = = > CuCl2 + H2(протекает при 600 — 700 гр Цельсия, реакция идет с HCl в газовом состоянии, а не с жидким HCl) 4Li + O2 = 2Li2O Cu + CI₂ = CuCI₂ Mg + CuCl2 — > MgCl2 = Cu 2Al + 3Fe2SO4 = Al2(SO4)3 + 6Fe Na2O + H2O = 2..
Видео:Химия 9 класс (Урок№4 - Обратимые и необратимые реакции. Понятие о химическом равновесии.)Скачать

Для реакции 4NH3 + 5O2=4NO+6H2O записать выражение закона действующих масс и указать условия смещения равновесия вправо
Видео:Смещение химического равновесия. Принцип Ле Шателье.Скачать

Ваш ответ
Видео:Обратимые и необратимые реакции. Понятие о химическом равновесии.Скачать

решение вопроса
Видео:Химическое равновесие. Константа равновесия. 10 класс.Скачать

Похожие вопросы
- Все категории
- экономические 43,405
- гуманитарные 33,632
- юридические 17,905
- школьный раздел 607,990
- разное 16,855
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Видео:Влияние различных факторов на равновесие. Принцип смещения равновесия - Ле Шателье-Брауна. 10 класс.Скачать

Презентация на тему «Химические реакции»
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
Рабочие листы и материалы для учителей и воспитателей
Более 300 дидактических материалов для школьного и домашнего обучения
Х–11 Контрольная работа №2 «Химические реакции» Вариант №1
При выполнении заданий А1-А10 из предложенных вариантов ответов выберите тот, который вы считаете правильным. 2 балла за каждое верно выполненное задание.
А1. Характеристика реакции, уравнение которой 4 Fe + 6 H 2 O + 3 O 2 →4 Fe ( OH )3:
1) Соединения, ОВР 2) Замещения ОВР 3) Обмена не ОВР 4) Разложения ОВР
А2. Какая масса угля вступает в реакцию, термохимическое уравнение которой С+О2 = СО2 + 402 кДж, если при этом выделилось 1608 кДж теплоты?
1) 4,8 г 2) 48 г 3) 120 г 4) 240 г
А3. Химическая реакция, уравнение которой:
1) Дегидрирования 2) Изомеризации 3) Полимеризации 3) Присоединения
А4. Окислитель в реакции синтеза аммиака, уравнение которой N 2 + 3 H 2 = 2 NH 3 + Q
1) N 0 2) H 0 3) H +1 4) N –3
А5. При повышении температуры на 30 °С (температурный коэффициент равен 3) скорость увеличится
1) в 3 раза 2) в 9 раз 3) в 27 раз 4) в 81 раз
А6. Факторы, позволяющие сместить химическое равновесие, для реакции CaO (т)+ CO 2(г)↔ CaCO 3(т)+ Q , в сторону продуктов реакции:
1) Повышение температуры и понижение давления 2) Понижение температуры и давления
3) Понижение температуры и повышение давления 4) Повышение температуры и давления
А7. Щелочную среду имеет водный раствор соли, формула которой:
А8. Наиболее сильной кислотой из перечисленных является:
А9. Осадок образуется при взаимодействии хлорида калия с:
А10. Гидролизу не подвергается:
В заданиях В1-В3 установите соответствие. Ответ запишите в виде последовательности цифр.
4 балла за верно выполненное задание.
В1. Установите соответствие между схемой ОВР и коэффициентом перед формулой восстановителя:
В2. Установите соответствие между солью и реакцией среды раствора
В3. Установите соответствие между названием соли и отношением ее к гидролизу:
Отношение к гидролизу
1) гидролиз по катиону
2) гидролиз по аниону
3) гидролиз по катиону и аниону
4) гидролизу не подвергается
Для задания С1 дайте полный развернутый ответ.
С1(3 балла). Используя метод электронного баланса, составьте уравнение реакции:
Определите окислитель и восстановитель.
С2(4 балла). Вычислите рН раствора, в котором концентрация ионов ОН – (в моль/л) равна 1•10 –7 ..
С3 (5 баллов). Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения:
Для перехода 1 составьте электронный баланс, укажите окислитель и восстановитель.
Х–11 Контрольная работа №2 «Химические реакции» Вариант №2
При выполнении заданий А1-А10 из предложенных вариантов ответов выберите тот, который вы считаете правильным. 2 балла за каждое верно выполненное задание.
А1. Характеристика реакции, уравнение которой 4 KClO 3 → 2 KCl + 3 O 2:
1) Соединения, ОВР 2) Замещения ОВР 3) Обмена не ОВР 4) Разложения ОВР
А2. Какое количество теплоты выделится при взаимодействии 5,6 л водорода и избытком хлора. Термохимическое уравнение Н2+С l 2 = 2 HCl + 92,3 кДж.
1) 2,3 кДж 2) 23 кДж 3) 46 кДж 4) 230 кДж
А3. Химическая реакция, уравнение которой:
1) Дегидрирования 2) Изомеризации 3) Полимеризации 3) Присоединения
А4. Восстановитель в реакции, уравнение которой 2СО + О2 = 2СО2 + Q
1) С +2 2) С +4 3) О 0 4) О –2
А5. Для увеличения скорости химической реакции в 64 раза (температурный коэффициент равен 2) надо повысить температуру
1) на 30 °С 2) на 40 °С 3) на 50 °С 4) на 60 °С
А6. Факторы, позволяющие сместить химическое равновесие, для реакции 2 NO (г)+ O 2(г)↔2 NO 2(г)+ Q , в сторону продуктов реакции:
1) Повышение температуры и понижение давления 2) Понижение температуры и давления
3) Понижение температуры и повышение давления 4) Повышение температуры и давления
А7. Кислую среду имеет водный раствор соли, формула которой:
А8. К неэлектролитам относится:
А9. Газ образуется при взаимодействии серной кислоты с:
1) AgNO 3 2) NaOH 3) ZnS 4) Na 2 SO 4
А10. Гидролизу не подвергается:
В заданиях В1-В3 установите соответствие. Ответ запишите в виде последовательности цифр.
4 балла за верно выполненное задание.
В1. Установите соответствие между схемой ОВР и формулой восстановителя в ней:
А ) Cl 2 + KOH = KCl + KClO + H 2 O
🔍 Видео
Химическое равновесие в промышленных процессах. 10 класс.Скачать

Смещение равновесия в растворе аммиака при нагреванииСкачать

Равновесие в системе диоксида азота и его димерСкачать

119. Понятие химического равновесия. Смещение химического равновесияСкачать













