- Ваш ответ
- решение вопроса
- Похожие вопросы
- В какую сторону сместится равновесие химической реакции CaCO3 = CaO + CO2 — Q при изменении температуры и давления?
- При увеличении давления и температуры в эндотермической реакции куда сместится равновесие?
- Как надо изменить температуру и давление, чтобы равновесие реакции разложения карбоната кальция сместить в сторону продуктов разложения : CaCO3(к) = CaO(г) + СО2(г) дельтаН = 178 кДж?
- N2(г) + O2(г)↔2NO(г) — Q в какую сторону сместится равновесие химической реакций ?
- Как надо изменить температуру и давление, чтобы равновесие в реакции сместилось в сторону образования продуктов реакции СаСО3⇄CO2 + CaO — 178кДж?
- В какую сторону сместится химическое равновесие реакции caco3?
- В какую сторону сместится химическое равновесие обратимой реакции 2H2O(2) + O2(2) = 2H2(2) + O2(2) + Q при : а)?
- Помогите, пожалуйста?
- Куда сместится химическое равновесие реакции при повышении давления, понижении температуры, при увеличении концентрации водорода?
- Куда сместится химическое равновесие реакции ?
- Как нужно изменить температуру, давление и концентрацию водорода, чтобы химическое равновесие сместилось в сторону образования продуктов реакции :H2 + Br2 ⇔ 2HBr + Q?
- Химическое равновесие.. Факторы влияющие на хим. равновесие. Принцип Ле-Шателье.
- 📹 Видео
Видео:Обратимость и необратимость химических реакций. Химическое равновесие. 1 часть. 9 класс.Скачать

Ваш ответ
Видео:Обратимые и необратимые реакции | Химическое равновесие и условия его смещенияСкачать

решение вопроса
Видео:Обратимость химических реакций. Химическое равновесие | Химия 11 класс #16 | ИнфоурокСкачать

Похожие вопросы
- Все категории
- экономические 43,407
- гуманитарные 33,633
- юридические 17,905
- школьный раздел 608,009
- разное 16,855
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Видео:Химическое равновесие / Решение задач на химическое равновесиеСкачать

В какую сторону сместится равновесие химической реакции CaCO3 = CaO + CO2 — Q при изменении температуры и давления?
Химия | 10 — 11 классы
В какую сторону сместится равновесие химической реакции CaCO3 = CaO + CO2 — Q при изменении температуры и давления.
Рассмотрите все возможные случаи.
0 объемов — — — > 1 объем
1) увеличим температуру, следовательно, равновесие сместится в сторону — Q, вправо
2) уменьшим температуру, следовательно, равновесие сместитсяв сторону + Q, влево
3) увеличим давление, следовательно, равновесие сместитсяв сторону уменьшенияобъемов, влево
3) уменьшим давление, следовательно, равновесие сместитсяв сторону увеличения объемов, вправо.
Видео:Химическое равновесие. Видеоурок 40. Химия 9 классСкачать

При увеличении давления и температуры в эндотермической реакции куда сместится равновесие?
При увеличении давления и температуры в эндотермической реакции куда сместится равновесие?
Видео:Химическое равновесие. Константа равновесия. Обратимость реакций.Скачать

Как надо изменить температуру и давление, чтобы равновесие реакции разложения карбоната кальция сместить в сторону продуктов разложения : CaCO3(к) = CaO(г) + СО2(г) дельтаН = 178 кДж?
Как надо изменить температуру и давление, чтобы равновесие реакции разложения карбоната кальция сместить в сторону продуктов разложения : CaCO3(к) = CaO(г) + СО2(г) дельтаН = 178 кДж.
Видео:Влияние различных факторов на равновесие. Принцип смещения равновесия - Ле Шателье-Брауна. 10 класс.Скачать

N2(г) + O2(г)↔2NO(г) — Q в какую сторону сместится равновесие химической реакций ?
N2(г) + O2(г)↔2NO(г) — Q в какую сторону сместится равновесие химической реакций .
При увеличений а)температуры б)давление.
Видео:Химическое равновесие | Химия ЕГЭ, ЦТСкачать

Как надо изменить температуру и давление, чтобы равновесие в реакции сместилось в сторону образования продуктов реакции СаСО3⇄CO2 + CaO — 178кДж?
Как надо изменить температуру и давление, чтобы равновесие в реакции сместилось в сторону образования продуктов реакции СаСО3⇄CO2 + CaO — 178кДж.
Видео:Обратимые реакции и химическое равновесие (видео 5) | Химическое равновесие | ХимияСкачать
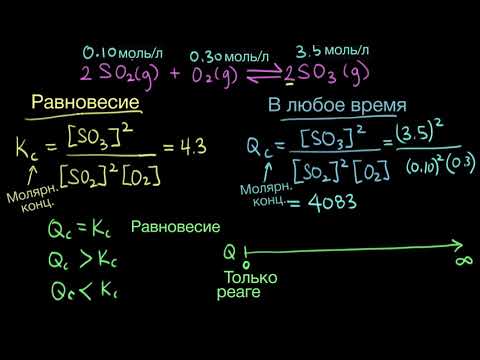
В какую сторону сместится химическое равновесие реакции caco3?
В какую сторону сместится химическое равновесие реакции caco3.
Cao — co2 — q при а) понижении t б) повышенииp.
Видео:Химическое равновесие. Смещение равновесия. Принцип Ле ШательеСкачать

В какую сторону сместится химическое равновесие обратимой реакции 2H2O(2) + O2(2) = 2H2(2) + O2(2) + Q при : а)?
В какую сторону сместится химическое равновесие обратимой реакции 2H2O(2) + O2(2) = 2H2(2) + O2(2) + Q при : а).
Повышении температуры ; б).
Видео:Химическое равновесие в промышленных процессах. 10 класс.Скачать

Помогите, пожалуйста?
В какую сторону сместится химическое равновесие системы N2 + 3H22NH3 + Q, при : а) повышении температуры ; б)повышении давления ; в)увеличении концентрации аммиака?
Видео:Решение задач на тему: "Нахождение константы равновесия и равновесных концентраций". 1ч. 10 класс.Скачать

Куда сместится химическое равновесие реакции при повышении давления, понижении температуры, при увеличении концентрации водорода?
Куда сместится химическое равновесие реакции при повышении давления, понижении температуры, при увеличении концентрации водорода?
Видео:Равновесие в системе диоксида азота и его димерСкачать

Куда сместится химическое равновесие реакции ?
Куда сместится химическое равновесие реакции :
Видео:Лабораторная работа «Химическая кинетика и химическое равновесие»Скачать

Как нужно изменить температуру, давление и концентрацию водорода, чтобы химическое равновесие сместилось в сторону образования продуктов реакции :H2 + Br2 ⇔ 2HBr + Q?
Как нужно изменить температуру, давление и концентрацию водорода, чтобы химическое равновесие сместилось в сторону образования продуктов реакции :
H2 + Br2 ⇔ 2HBr + Q.
Вы открыли страницу вопроса В какую сторону сместится равновесие химической реакции CaCO3 = CaO + CO2 — Q при изменении температуры и давления?. Он относится к категории Химия. Уровень сложности вопроса – для учащихся 10 — 11 классов. Удобный и простой интерфейс сайта поможет найти максимально исчерпывающие ответы по интересующей теме. Чтобы получить наиболее развернутый ответ, можно просмотреть другие, похожие вопросы в категории Химия, воспользовавшись поисковой системой, или ознакомиться с ответами других пользователей. Для расширения границ поиска создайте новый вопрос, используя ключевые слова. Введите его в строку, нажав кнопку вверху.
Може молекулярна маса оксиду = 230? Бо такого елементу нема якщо 5 група то формула оксиду R2O5 Ar(R) = (230 — (16 * 5)) / 2 = 75 елемент арсен.
Радуга в небе — — физическое явление (преломление света) мяч падает на землю — физич. — сила тяжести Вода кипит в чайнике — физ явление — туман на озере физ явление — испарение воды и конденсация егов воздухе подъем ртутного столбика в градуснике — ..
Считай по кислороду до реакции и после пред 3hno3 и перед 2no3.
CH3 — C(CH3)2 — C = C(C2H5) — CH2 — CH3 CH3 | CH3 — C — C = C — CH2 — CH3 | | CH3 C2H5.
Газ — иодоводород, HI Прекрасно растворяется в воде, образует сильную кислоту, диссоциирующую на два иона : HI = H( + ) + I( — ).
Валентные электроны находятся на последнем электронном слое, орбитали не могут быть валентными.
Здесь четыре вида веществ : кислота, соль, оксид, гидроксид.
А — химический элемент б — простое вещество в — простое вещество г — химический элемент д — химический элемент е — химический элемент(скорее всего) ж — простое вещество з — простое вещество и — химический элемент к — простое вещество(скорее всего).
Водород, углерод, кислород, магний, алюминий, хлор, железо, медь, серебро.
Видео:Термодинамика,кинетика,химическое равновесиеСкачать

Химическое равновесие.. Факторы влияющие на хим. равновесие. Принцип Ле-Шателье.
Читайте также:
|












