Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Содержание
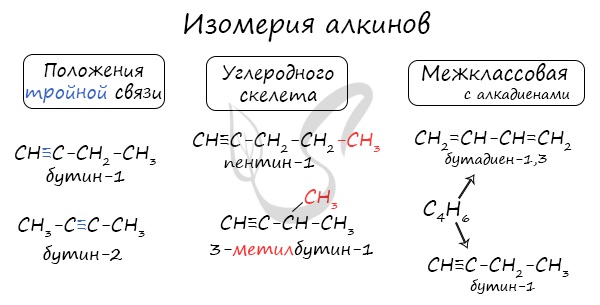
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать  АлкиныАлкины — непредельные (ненасыщенные) углеводороды, имеющие в молекуле одну тройную связь С≡С. Каждая такая связь содержит одну сигма-связь (σ-связь) и две пи-связи (π-связи). Алкины также называют ацетиленовыми углеводородами. Первый член гомологического ряда — этин — CH≡CH (ацетилен). Общая формула их гомологического ряда — CnH2n-2. Номенклатура и изомерия алкиновНазвания алкинов формируются путем добавления суффикса «ин» к названию алкана с соответствующим числом: этин, пропин, бутин и т.д. При составлении названия алкина важно учесть, что главная цепь атомов углерода должна обязательно содержать тройную связь. Нумерация атомов углерода в ней начинается с того края, к которому ближе тройная связь. В конце названия указывают атом углерода у которых начинается тройная связь. Для алкинов характерна изомерия углеродного скелета, положения тройной связи, межклассовая изомерия с алкадиенами. Пространственная геометрическая изомерия для них невозможна, ввиду того, что каждый атом углерода, прилежащий к тройной связи, соединен только с одним единственным заместителем. Некоторые данные, касающиеся алкинов, надо выучить:
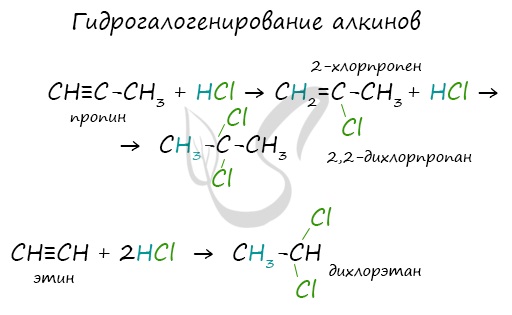
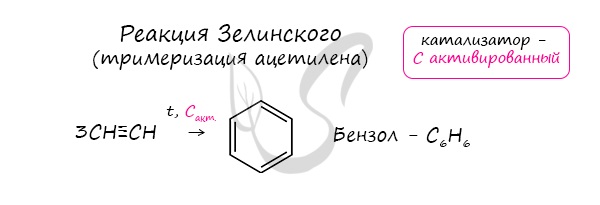
Получение алкиновАцетилен получают несколькими способами:
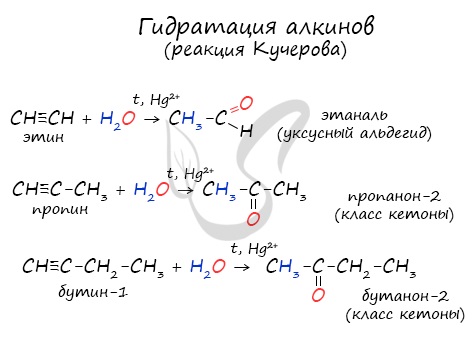
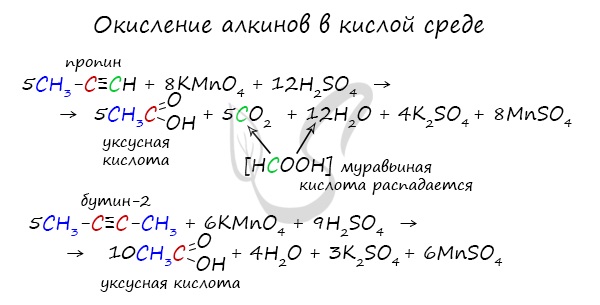
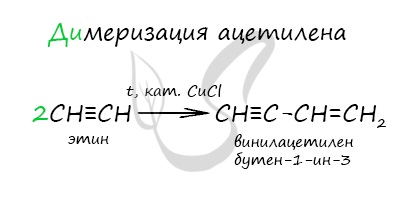
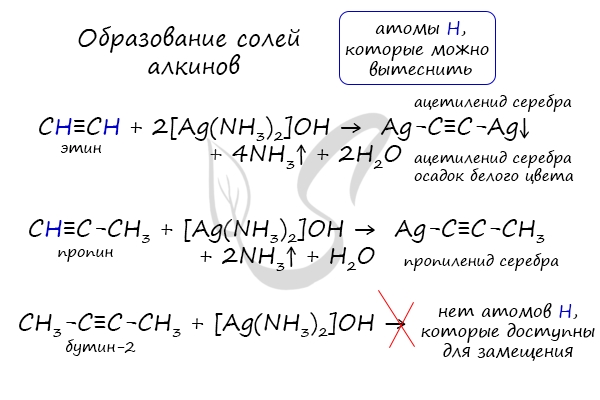
При нагревании метана до 1200-1500 °C происходит димеризация молекул метана, в ходе чего отщепляется водород. Осуществляется напрямую, из простых веществ. Протекает на вольтовой (электрической) дуге, в атмосфере водорода. 2C + H2 → (t, вольтова дуга) CH≡CH Разложение карбида кальция В результате разложения карбида кальция образуется ацетилен и гидроксид кальция II. Получение гомологов ацетилена возможно в реакциях дегидрогалогенирования дигалогеналканов, в которых атомы галогена расположены у одного атома углерода или у двух соседних атомов. Химические свойства алкиновАлкины — ненасыщенные углеводороды, легко вступающие в реакции присоединения. Реакции замещения для них не характерны. Водород присоединяется к атомам углерода, образующим тройную связь. Пи-связи (π-связи) рвутся, остается единичная сигма-связь (σ-связь). CH≡C-CH3 + H2 → (t, Ni) CH2=CH-CH3 (в реакции участвует 1 моль водорода) CH≡CH + 2H2 → (t, Ni) CH3-CH3 (в реакции участвует 2 моль водорода) Реакция с бромной водой является качественной для непредельных соединений, содержащих двойные (и тройные) связи. В ходе такой реакции бромная вода обесцвечивается, что указывает на присоединение его по кратным связям к органическому веществу. Алкины вступают в реакции гидрогалогенирования, протекающие по типу присоединения. Гидрогалогенирование протекает по правилу Марковникова, в соответствии с которым атом водорода присоединяется к наиболее гидрированному, а атом галогена — к наименее гидрированному атому углерода. Реакцией Кучерова называют гидратацию ацетиленовых соединений с образованием карбонильных соединений. Открыта русским химиком М.Г. Кучеровым в 1881 году. Катализатор — соли ртути Hg 2+ . Только в реакции с ацетиленом образуется уксусный альдегид. Во всех остальных реакциях (с гомологами ацетилена) образуются кетоны. При горении алкины, как и все органические соединения, сгорают с образование углекислого газа и воды — полное окисление. Сильные окислители (особенно в подкисленной среде) способны разрывать молекулы алкинов в самом слабом месте — в месте тройной связи. Так, при окислении пропина, образуется уксусная кислота и муравьиная кислота, окисляющаяся до угольной кислоты, которая распадается на углекислый газ и воду. Данная реакция протекает при пропускании ацетилена над активированным углем при t = 400°C. В результате образуется ароматический углеводород — бензол. Димеризация ацетилена происходит при наличии катализатора — солей меди I. В результате реакции две молекулы ацетилена соединяются, образуя винилацетилен. В случае если тройная связь прилежит к краевому атому углерода, то имеющийся у данного атома водород может быть замещен атомом металла. Если тройная связь спрятана внутри молекулы, то образование солей невозможно. Реакция аммиачного раствора серебра и ацетилена — качественная реакция, в ходе которой выпадает осадок ацетиленида серебра. © Беллевич Юрий Сергеевич 2018-2022 Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию. Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать  Помогите пожалуйста , срочно прошу присоединение водорода к этену присоединение водорода к этину присоединение воды к этену присоединение воды к этину присоединение брома к этину?Химия | 5 — 9 классы Помогите пожалуйста , срочно прошу присоединение водорода к этену присоединение водорода к этину присоединение воды к этену присоединение воды к этину присоединение брома к этину. CH₂ = CH₂ + H₂ = > ; CH₃ — CH₃ этен водород этан. Видео:Реакции металлов с кислородом и водой. 8 класс.Скачать  В результате присоединения избытка брома к этину образуется : 1) 1, 2 — дибромэтан 2)дибромэтан 3)бромэтан 4)1, 1, 2, 2 — тетрабромэтан?В результате присоединения избытка брома к этину образуется : 1) 1, 2 — дибромэтан 2)дибромэтан 3)бромэтан 4)1, 1, 2, 2 — тетрабромэтан. Видео:Уравнивание реакций горения углеводородовСкачать  Напишите реакции присоединения водорода и хлороводорода к 2, 5 диметилгексену 1 назовите вещества?Напишите реакции присоединения водорода и хлороводорода к 2, 5 диметилгексену 1 назовите вещества. Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать  Продуктом присоединения воды к пентену — 1 является ?Продуктом присоединения воды к пентену — 1 является ? Видео:ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать  1. Для этана характерны реакции : 1)Присоединения водорода 2)Присоединения бромоводорода 3)Отщипления водорода 4)Окисление раствором перманганата калия 2?1. Для этана характерны реакции : 1)Присоединения водорода 2)Присоединения бромоводорода 3)Отщипления водорода 4)Окисление раствором перманганата калия 2. Бутан 1)Взаимодействует и с хлором, и с водородом 2)взаимодействует с хлором , но не реагирует с воды 3)не взаимодействует ни с хлором , ни с водородом 4)Не взаимодействует с хлором, но реагирует с водородом. Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать  Для циклопропана не характерны реакции 1)присоединения бромоводорода 2)замещения атомов водорода 3)гидрирования 4)присоединения брома?Для циклопропана не характерны реакции 1) присоединения бромоводорода 2) замещения атомов водорода 3) гидрирования 4) присоединения брома. Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать  Гидратация ( присоединение молекул воды ) C6H10?Гидратация ( присоединение молекул воды ) C6H10. Видео:25. Схема реакции и химическое уравнениеСкачать  Химические свойства алкенов 1)горение 2)присоединения водорода гидрирование?Химические свойства алкенов 1)горение 2)присоединения водорода гидрирование. Видео:Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать  Метан, как и бензол, может реагировать с : А водородом Б водой В бромом Г этеном?Метан, как и бензол, может реагировать с : А водородом Б водой В бромом Г этеном. Видео:Реакции ионного обмена. 9 класс.Скачать  Укажите реакцию, характерную для алкенов : 1) отщепление водорода 2) отщепление молекул воды 3) этерфикации 4) присоединение хлороводорода?Укажите реакцию, характерную для алкенов : 1) отщепление водорода 2) отщепление молекул воды 3) этерфикации 4) присоединение хлороводорода. Видео:7 ВАЖНЕЙШИХ РЕАКЦИЙ, которые тебе нужно знать (Алкины)Скачать  Реакцию присоединения воды называют реакцией гидратации, а как следует назвать реакцию присоединения водорода?Реакцию присоединения воды называют реакцией гидратации, а как следует назвать реакцию присоединения водорода? Напишите уравнения реакций присоединения водорода для этилена и для пропилена. Вопрос Помогите пожалуйста , срочно прошу присоединение водорода к этену присоединение водорода к этину присоединение воды к этену присоединение воды к этину присоединение брома к этину?, расположенный на этой странице сайта, относится к категории Химия и соответствует программе для 5 — 9 классов. Если ответ не удовлетворяет в полной мере, найдите с помощью автоматического поиска похожие вопросы, из этой же категории, или сформулируйте вопрос по-своему. Для этого ключевые фразы введите в строку поиска, нажав на кнопку, расположенную вверху страницы. Воспользуйтесь также подсказками посетителей, оставившими комментарии под вопросом. 1) NaOH + H2 2) ZnS 3) ZnO 4) ZnCl2 + H2 5) ZnCl2 + Fe 6) Mg(OH)2 + H2 7) Mg3P2 8) — 9) MgCl2 10) — 11) MgSO4 + Ni 12) AlBr3 13) Al2(SO4)3 + Fe 14) AlI3 + H2. FeO + P = Fe + P2O5 1)восстановитель Fe (в степени — 2) – 2е = Fe (в нулевой степени) 2)окислитель Р (в нулевой степени) + 5е = P (в степени + 5). Химия используется при уборке в доме , мытьё посуды . В сельской хозяйственности для орошения полей от вредителей . В медецине для создания лекарств . Ba — металлическая BaBr2 — ионная HBr — ковалентная полярная Br2 — ковалентная не полярная. Ba — металлическая HBr — Ковалентная полярная Br2 — ковалентная не полярная BaBr2 — ионная. Ми знаємо формулу знаходження масової частки елемента в речовині і у цю формулу підставляємо значення, знаходимо скількі атомів Оксигена у формулі . В этих местах останутся желтые пятна, а потом они станут оранжевые. 2Al(OH)3 = Al2O3 + 3H2O H2CO3 = CO2 + H2O CACO3 = CAO + CO2( газ) CU(OH)2 = CUO + H2O Zn + 2HCl = ZnCl2 + H°2(газ) Ca° + H2SO4 = CaSO4 + H°2(газ) 3Mg° + 2H3PO4 = Mg3(PO4)2 + H°2(газ) 2Al° + Fe2O3 = Al2O3 + 2Fe° Cu(No3) + NaOH = Cu(OH) (осадок) + NaNo.. 2Al(OH)3 — — >Al2O3 + 3H2O H2CO3 — — >CO2 + H2O CaCO3 — — >CaO + CO2 Cu(OH)2 — — >CuO + H2O Zn + 2HCL — — >ZnCL2 + H2 Ca + H2SO4 — — >CaSO4 + H2 3Mg + 2H3PO4 — — >Mg3(PO4)2 + 3H2 2Al + Fe2O3 — — >2Fe + Al2O3 Cu(NO3)2 + 2NaOH — — >Cu(OH)2 + 2NaNO3 HNO.. Вещества : вода, медь Тела : льдина , ваза, труба, гвоздь, сосулька. 📹 ВидеоКарбид кальция и ацетилен - что это такое?Скачать  ВСЕ ПРО АЛКАНЫ за 8 минут: Химические Свойства и ПолучениеСкачать  Реакции ионного обмена. 9 класс.Скачать  Проклятая химическая реакция 😜 #shortsСкачать  Химия | Тепловой эффект химической реакции (энтальпия)Скачать  Реакция оксида кальция с водой | CaO + H2O = Ca(OH)2Скачать  ХИМИЧЕСКИЕ УРАВНЕНИЯ | Как составлять уравнения реакций | Химия 8 классСкачать  Составление уравнений реакций горения. 11 класс.Скачать  |