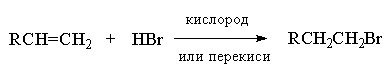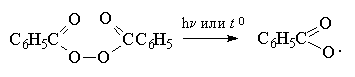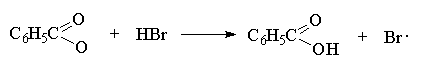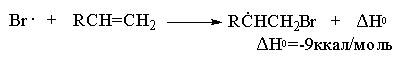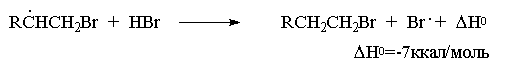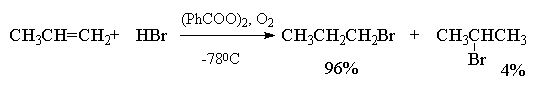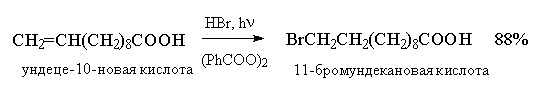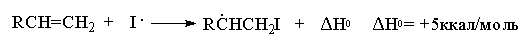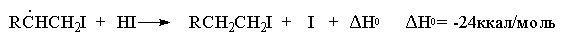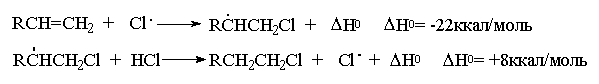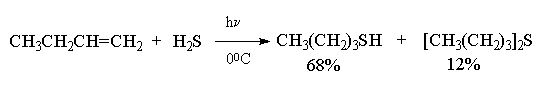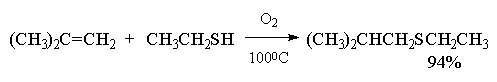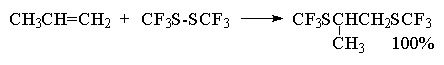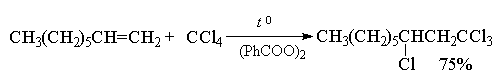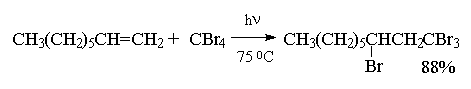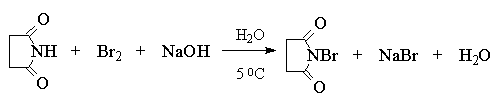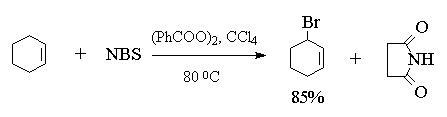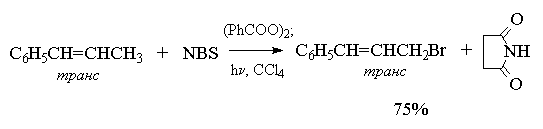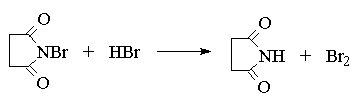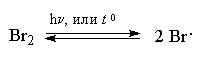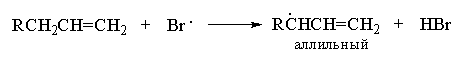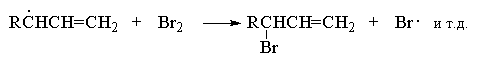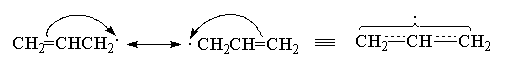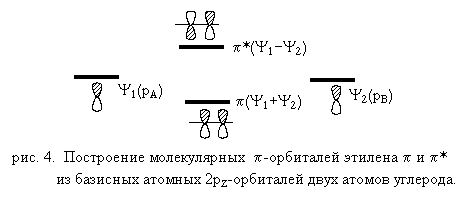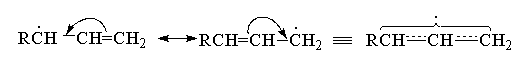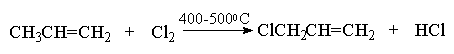Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
В уравнениях приведите структурные формулы органических веществ.
Ответ включает в себя пять уравнений реакций, соответствующих схеме превращений:
| Критерии оценивания выполнения задания | Баллы |
|---|---|
| Правильно записаны 5 уравнений реакций | 5 |
| Правильно записаны 4 уравнения реакций | 4 |
| Правильно записаны 3 уравнения реакций | 3 |
| Правильно записаны 2 уравнения реакций | 2 |
| Правильно записано 1 уравнение реакции | 1 |
| Все элементы ответа записаны неверно | 0 |
| Максимальный балл | 5 |
Примечание. Допустимо использование структурных формул разного вида (развёрнутой, сокращённой, скелетной), однозначно отражающих порядок связи атомов и взаимное расположение заместителей и функциональных групп в молекуле органического вещества.
Видео:Составление уравнений реакций горения. 11 класс.Скачать

Этилен br2 ccl4 уравнение реакции
4.4. Радикальные реакции алкенов
4.4.а. Радикальное присоединение бромистого водорода, катализируемое перекисями и родственные реакции
Присоединение бромистого водорода к алкенам резко отличается от присоединения остальных галогеноводородов — HF, HCl и HI. В зависимости от условий при присоединении HBr к несимметричным алкенам образуются продукты присоединения или в соответствии с правилом Марковникова, или против правила Марковникова. Было установлено, что при полном отсутствии кислорода или пероксидов гидробромирование алкенов строго подчиняется правилу Марковникова. Однако в присутствии кислорода или каталитических количеств пероксидов присоединение HBr осуществляется против правила Марковникова (анти-марковниковское присоединение). Наиболее эффективными инициаторами анти-марковниковского присоединения HBr к алкенам оказались пероксиды, такие как перекись бензоила (C6H5COO)2, трет-бутилгидропероксид (CH3)3COOH и др. Рациональное объяснение этого явления было дано М. Харашем (1933 г). Он показал, что механизм реакции изменяется с электрофильного на радикальный., что в свою очередь приводит к полному изменению региоселективности гидробромирования алкена.
Присоединение бромистого водорода, инициируемое кислородом или перекисями, осуществляется по цепному радикальному механизму. Инициирование радикальной цепи заключается в образовании атома брома, который вызывает развитие радикальной цепи.
Образование радикала Br . при зарождении цепи происходит в результате взаимодействия перекисного радикала или кислорода с бромистым водородом. С чисто энергетической точки зрения образование С6H5COOH и Br . гораздо выгоднее, чем образование С6H5COOBr и H . , поскольку энергия связи О-Н значительно превышает энергию связи О-Br и, следовательно, в радикальном процессе образование С6H5COOН и Br . предпочтительнее. Обе стадии развития цепи экзотермичны и характеризуются низкой энергией активации, что обеспечивает развитие цепного процесса. Атом брома присоединяется к концевому атому углерода алкена с образованием более замещенного вторичного радикала. Аналогично карбокатионам, вторичные алкильные радикалы стабильнее первичных. Поэтому на первой стадии развития цепи образуется только вторичный радикал RCH . CH2Br, а не первичный радикал RCHBrСН2 . . В конечном итоге это приводит к анти-марковниковскому продукту радикального гидробромирования RCH2CH2Br.
Аномальное гидрогалогенирование, инициируемое перекисями, характерно для присоединения НBr, но не HCl, HI или HF. Энергия связи С-I настолько мала, что присоединение радикала I . к двойной связи в первой стадии развития цепи эндотермично и требует высокой энергии активации:
хотя вторая стадия развития цепи экзотермична
При радикальном присоединении HCl и особенно HF к двойной связи, напротив, вторая стадия развития цепи характеризуется поглощением тепла, поскольку энергия связи HCl очень высока (103,1 ккал/моль).
Цепные радикальные процессы осуществляются легко только в том случае, когда обе стадии развития цепи экзотермичны. Наличие эндотермичной стадии соответствует медленной реакции с быстрым обрывом цепи. Поэтому радикальное присоединение HF, HCl и HI к двойной связи не происходит.
Целый ряд других соединение с подходящей энергией связи могут присоединяться к двойной связи по радикальному механизму, подобному радикальному присоединению HBr к алкенам. Известны многочисленные примеры присоединения к алкенам сероводорода, тиолов, дисульфидов, четыреххлористого и четырехбромистого углерода, бромтрихлорметана:
CCl4 и CBr4 легко реагируют с алкенами в присутствии перекисей, инициирующих радикальные процессы, с образованием аддуктов состава 1:1.
4.4.б. Аллильное бромирование алкенов N-бромсукцинимидом по К. Циглеру
В 1942 г. К. Циглер обнаружил, что реакция алкенов с N-бромсукцинимидом в CCl4, инициированная перекисями, является общим методом бромирования алкенов в так называемое аллильное положение (аллильным называется атом углерода в -положении по отношению к двойной связи). N-Бромсукцинимид (NBS) получается при взаимодействии сукцинимида (имида янтарной кислоты) с бромом в щелочной среде:
NBS селективно бромирует и циклические алкены только по аллильному атому углерода:
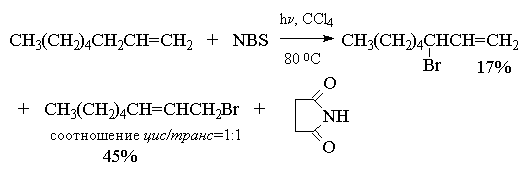
Как можно объяснить бромирование исключительно в аллильное положение и как объяснить образование при бромировании октена-1 сразу двух продуктов, из которых в одном произошло изменение положения двойной связи? Ответ на этот вопрос сводится к рассмотрению особой стабильности аллил-радикала. Бромирование алкенов по Циглеру с NBS представляет собой цепной радикальный процесс с участием атома брома. Атом брома образуется при фотолизе или термической гомолитической диссоциации молекулярного брома, образующегося в очень низкой концентрации из NBS и следов HBr.
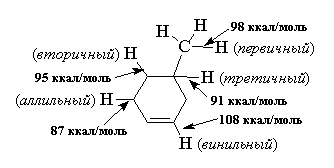
Направление радикального галогенирования NBS или хлорсукцинимидом определяется относительной стабильностью радикала, образующегося в качестве интермедиата. Радикальное галогенирование алкенов в аллильное положение обусловлено более низкой энергией С-Н-связи в аллильном положении по сравнению с энергией других C-H-связей. Эти данные для большей наглядности удобно рассмотреть на примере 4-метилциклогексена:
Из них следует, что аллильный радикал стабильнее вторичного алкильного радикала на
8 ккал/моль, на 11 ккал/моль стабильнее первичного алкильного радикала и на 20 ккал/моль стабильнее винильного радикала.
4.4.в. Стабильность аллил-радикала
Рассмотрим строение аллил-радикала CH2=CHCH2 . . Все атомы углерода в аллил-радикале находятся в sp 2 -гибридном состоянии, а не спаренный электрон располагается на р-орбитали, которая параллельна р-орбиталям двойной связи. Электронная структура незамещенного аллил-радикала характеризуется полной симметрией и р-орбиталь центрального атома углерода в равной степени перекрывается с р-орбиталями обоих соседних атомов углерода и длина связи С1-С2 равна длине связи С2-С3. Другими словами, стабильность аллил-радикала обусловлена резонансной делокализацией не спаренного электрона по единой -электронной системе.
В теории резонанса реальная структура молекулы или интермедиата вообще не может быть выражена графически с помощью одной формулы, а является наложением нескольких резонансных форм. Для незамещенного аллил-радикала обе резонансные формы эквивалентны, в других случаях они не эквивалентны. Один из самых важных постулатов концепции резонанса заключается в том, что чем больше для данного соединения или интермедиата можно записать резонансных форм, тем выше его термодинамическая стабильность. Другой постулат связывает стабильность с различием в резонансных формах. Эквивалентность резонансных форм, как например для аллил-радикала, аллил-катиона, аллил-аниона, карбоксилат-иона и т. д. повышает стабильность данной частицы по сравнению с другой, для которой резонансные формы неэквивалентны.
С другой стороны, строение аллил-радикала наглядно может быть выражено с помощью молекулярных -орбиталей этой простейшей сопряженной системы. Для того, чтобы построить молекулярные -орбитали аллильного радикала, катиона или аниона, необходимо прежде всего построить -орбитали простейшей молекулы с -связью — этилена.
Молекулярные орбитали этилена.
Молекулярные -орбитали этилена можно построить с помощью метода возмущения молекулярных орбиталей (ВМО) из двух атомных рZ-орбиталей двух атомов углерода. Согласно теории возмущения при сближении двух атомных р-орбиталей происходит перекрывание этих орбиталей и из двух атомных 2рZ-орбиталей образуются две новые «возмущенные» молекулярные орбитали и *, одна из которых лежит ниже, а вторая выше базисных атомных 2р-орбиталей. Нижняя возмущенная -молекулярная орбиталь образуется сложением волновых функций y 1 и y 2 (y 1+y 2), т. е. их перекрывание в фазе (положительная интерференция) и амплитуда волновой функции в пространстве между ядрами возрастает. Эта -МО называется связывающей и обозначается . Верхняя возмущенная МО образуется вычитанием волновых функций базисных орбиталей y 1 и y 2 (y 1-y 2), т. е. они перекрываются в противофазе (отрицательная интерфереция). Эта МО называется разрыхляющей или антисвязывающей и обозначается *. Связывающая и разрыхляющая -орбитали этилена образуются при взаимодействии двух рZ-орбиталей одинаковой энергии, поэтому реализуется возмущение первого порядка, т. е. уровень энергии связывающей орбитали лежит настолько же ниже уровня энергии атомных орбиталей рZ насколько уровень энергии разрыхляющей орбитали * лежит выше уровня рZ-орбиталей. Другими словами, в рамках возмущения первого порядка связывающая орбиталь в той же степени «связывает», в какой разрыхляющая «антисвязывает» атомные орбитали рZ (рис. 4).
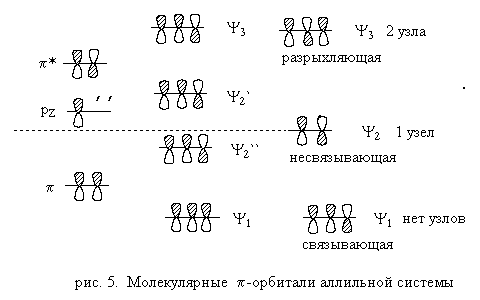
-Орбитали аллильной системы.
По аналогии с этиленом строятся -молекулярные орбитали простейшей сопряженной системы — аллильной. Для этого рассматриваются возмущения, возникающие при объединении связывающей и разрыхляющей орбиталей и * этилена и одиночной р-атомной орбитали. Возмущения при образовании аллильной системы изображены на рис. 5.
В результате возмущения второго порядка орбиталь , взаимодействуя с атомной р-орбиталью в фазе, дает орбиталь y 1, а в противофазе — орбиталь y 2`. Орбиталь *, взаимодействуя с р-орбиталью в фазе, дает орбиталь y 2«, а в противофазе — орбиталь y 3. Таким образом из этих трех базисных орбиталей получилось четыре возмущенные МО, хотя согласно теории из трех базисных атомных орбиталей должно образоваться три молекулярные орбитали. Обратим внимание на форму и способ образования орбиталей y 2` и y 2«. Несвязывающий уровень р под влиянием возмущения со стороны -орбитали этилена повышаются до y 2`, а под влиянием возмущения со стороны орбитали * понижается до y 2«, причем по энергии орбиталь y 2` настолько же выше несвязывающего уровня р-орбитали, насколько ниже этого уровня лежит орбиталь y 2«. Это означает, что несвязывающий р-уровень практически не изменился. Другими словами, орбитали y 2` и y 2« следует заменить одной несвязывающей орбиталью y 2 (рис. 5 справа). Несвязывающая орбиталь y 2 по энергии эквивалентна атомной орбитали базиса. Рассмотрим теперь симметрию несвязывающей орбитали y 2 аллильной системы. Для этого необходимо сравнить диаграммы некорректных y 2` и y 2«. Правые и левые составляющие р-АО для обеих орбиталей y 2` и y 2« выглядят одинаково, но средняя АО орбитали y 2` имеет относительные знаки верхней и нижней долей противоположные относительным знакам верхней и нижней долей средней части y 2«. Значит, несвязывающая орбиталь y 2 должна иметь нулевой вклад от центрального атома углерода аллильной системы, т. е. на диаграмме несвязывающей орбитали y 2 вклад центральной р-АО отсутствует, т. е. центральный атом углерода в орбитали y 2 является узловым. Таким образом три -орбитали аллильной системы y 1, y 2 и y 3 имеют симметрию, показанную на рис. 5.
Из рисунка 5 следует, что сопряжение понижает энергию -электронов в аллильной системе по сравнению с изолированной двойной связью и изолированной р-орбиталью. Отметим также, что разрыхляющая орбиталь y 3 аллильной системы лежит выше разрыхляющей орбитали * этилена. Нижняя y 1 не имеет узлов (область, где волновая функция изменяет знак), орбиталь y 2 имеет один узел, совпадающий с атомом С2 аллильной системы, а орбиталь y 3 имеет два узла. Орбиталь y 1 симметрична относительно зеркальной плоскости , проходящей через центральный атом С2 перпендикулярно цепи атомов углерода. Орбиталь y 2 антисимметрична относительно зеркальной плоскости , а третья орбиталь y 3 снова симметрична. В аллил-катионе СН2=СНСН2 + два -электрона размещаются на орбитали y 1, а орбитали y 2 и y 3 не заняты электронами. В аллил-радикале СН2=СНСН2 . два -электрона размещаются на орбитали y 1, а третий неспаренный электрон на орбитали y 2 на атоме С1 или С3, но не на С2. В аллил-анионе СН2=СНСН2 — две пары -электронов находятся на орбиталях y 1 и y 2. Для всех трех частиц разрыхляющая орбиталь y 3 не занята электронами.
Оба способа описания строения аллильного радикала сводятся в конечном итоге к делокализации неспаренного электрона между атомами С1 и С3 аллильной системы.
Делокализация неспаренного электрона в аллил-радикале находит отражение и в его реакционной способности. Как уже было отмечено ранее, радикальное бромирование октена-1 и других алкенов-1 с помощью NBS приводит к образованию двух изомерных аллильных бромидов, содержащих атом брома у первого и третьего атома углерода аллильной системы. Это означает, что при радикальном бромировании несимметричных алкенов образуется смесь бромидов с преобладанием более стабильного из них дизамещенного при двойной связи изомера (изомер RCH=CHCH2Br более стабилен, чем изомер RCHBrCH=CH2). Вместо NBS в качестве галогенирующего агента можно применять N-хлорсукцинимид, который хлорирует алкены в аллильное положение. Реакцией, родственной аллильному галогенированию по Циглеру, является газофазное галогенирование (хлорирование и бромирование) пропилена при 400-500 0 С (галогенирование по Львову).
В настоящее время именно этим способом получают аллилхлорид и аллилбромид в большом масштабе в промышленности. При высокой температуре присоединение галогена к двойной связи становится обратимой реакцией, где равновесие сильно смещено в сторону исходных реагентов. С этой реакцией успешно конкурирует прямое радикальное замещение водорода в аллильном положении.
Таким образом, реакции радикального замещения водорода в аллильном положении, также как и реакции радикального присоединения по двойной связи являются столь же типичными для алкенов как и процессы электрофильного присоединения по кратной связи.


Сервер создается при поддержке Российского фонда фундаментальных исследований
Не разрешается копирование материалов и размещение на других Web-сайтах
Вебдизайн: Copyright (C) И. Миняйлова и В. Миняйлов
Copyright (C) Химический факультет МГУ
Написать письмо редактору
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. 💥 ВидеоХимические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать  25. Схема реакции и химическое уравнениеСкачать  Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать  Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать  Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать  Химия | Тепловой эффект химической реакции (энтальпия)Скачать  Как расставлять коэффициенты в уравнениях реакций? #shorts #youtubeshortsСкачать  Решение задач по уравнениям реакций, если одно из реагирующих веществ взято в избытке. 2 ч. 9 класс.Скачать  Решение задач по уравнениям реакций, если одно из реагирующих веществ взято в избытке. 3 ч. 9 класс.Скачать  РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать  Расчеты по уравнениям химических реакций. 1 часть. 8 класс.Скачать  Качественные реакции на двойную связьСкачать  ДВИ по химии. Термохимия. Уравнение Аррениуса, закон Гесса, задачи на теплоемкостьСкачать  ЛЕКЦИЯ №4 || Химическая кинетика || Методы определения порядка реакцииСкачать  Самые красивые химические реакции - образование Сu(OH)₂Скачать  Реакция ВюрцаСкачать  Реакции разложения. Как понять?Скачать  Химия | Cкорость химической реакцииСкачать  |