Амины – это органические производные аммиака NH3, в молекуле которого один, два или три атома водорода замещены на углеводородные радикалы.
- Строение аминов
- Классификация аминов
- Номенклатура аминов
- Изомерия аминов
- Изомерия углеродного скелета
- Изомерия положения аминогруппы
- Изомерия между типами аминов
- Физические свойства аминов
- Химические свойства аминов
- 1.1. Взаимодействие с водой
- 1.2. Взаимодействие с кислотами
- 1.3. Взаимодействие с солями
- 2. Окисление аминов
- 3. Взаимодействие с азотистой кислотой
- 4. Алкилирование аминов
- Особенности анилина
- Получение аминов
- Восстановление нитросоединений
- Алкилирование аммиака и аминов
- Гидрирование нитрилов
- Соли аминов
- 15 комментариев
- Добавить ваш
- Амины
- Acetyl
Видео:Реакция нейтрализации гидроксида натрия соляной (хлороводородной) кислотойСкачать

Строение аминов
Атом азота находится в состоянии sp 3 -гибридизации, поэтому молекула имеет форму тетраэдра.
Также атом азота в аминах имеет неподелённую электронную пару, поэтому амины проявляют свойства органических оснований.
Видео:Реакция нейтрализацииСкачать

Классификация аминов
По количеству углеводородных радикалов, связанных с атомом азота, различают первичные, вторичные и третичные амины.
По типу радикалов амины делят на алифатические, ароматические и смешанные.
| Амины | Первичные | Вторичные | Третичные |
| Алифатические | Метиламин CH3-NH2 | Диметиламин CH3-NH-CH3 | Триметиламин (CH3)3N |
| Ароматические | Фениламин C6H5-NH2 | Дифениламин (C6H5)2NH | Трифениламин (C6H5)3N |
| Смешанные | Метилфениламин CH3-NH-C6H5 | Диметилфениламин (CH3)2N-C6H5 |
Видео:Реакция нейтрализацииСкачать

Номенклатура аминов
- Названия аминов образуют из названий углеводородных радикалов и суффикса амин. Различные радикалы перечисляются в алфавитном порядке.
При наличии одинаковых радикалов используют приставки ди и три.
- Первичные амины могут быть названы как производные углеводородов, в молекулах которых один или несколько атомов водорода замещены на аминогруппы -NH2.
В этом случае аминогруппа указывается в названии приставкой амино-:
| 1-Аминопропан | 1,3-Диаминобутан |
| CH3-CH2-CH2-NH2 | NH2-CH2-CH2-CH(NH2) -CH3 |
- Для смешанных аминов, содержащих алкильные и ароматические радикалы, за основу названия обычно берется название первого представителя ароматических аминов – анилин.
Например, N-метиланилин:
Символ N- ставится перед названием алкильного радикала, чтобы показать, что этот радикал связан с атомом азота, а не является заместителем в бензольном кольце.
Видео:Химия | Тепловой эффект химической реакции (энтальпия)Скачать

Изомерия аминов
Для аминов характерна изомерия углеродного скелета, изомерия положения аминогруппы и изомерия различных типов аминов.
Видео:Занятие 23 | Реакция нейтрализации | Курс химии | 7 классСкачать

Изомерия углеродного скелета
Для аминов характерна изомерия углеродного скелета (начиная с С4H9NH2).
| Например. Ф ормуле С4Н9NH2 соответствуют два амина-изомера углеродного скелета. |
| н-Бутиламин (1-аминобутан) | Изобутиламин (1-амин-2-метилпропан) |
 |  |
Видео:Практическая работа № 2. Опыт 3. Реакция нейтрализации (в присутствии фенолфталеина).Скачать

Изомерия положения аминогруппы
Для аминов характерна изомерия положения аминогруппы (начиная с С3H9N).
| Например. Ф ормуле С4Н11N соответствуют амины положения аминогруппы. |
| 1-Аминобутан (н-бутиламин) | |
 |  |
Видео:25. Схема реакции и химическое уравнениеСкачать

Изомерия между типами аминов
| Например. Формуле С3Н9N соответствуют первичный, вторичный и третичный амины. |
| Пропиламин (первичный амин) | Метилэтиламин (вторичный амин) | Триметиламин (третичный амин) |
 |  |  |
Видео:Реакция фенолфталеина на гидроксид натрияСкачать

Физические свойства аминов
При обычной температуре низшие алифатические амины CH3NH2, (CH3)2NH и (CH3)3N – газы (с запахом аммиака), средние гомологи – жидкости (с резким рыбным запахом), высшие – твердые вещества без запаха.
Ароматические амины – бесцветные жидкости с высокой температурой кипения или твердые вещества.
Первичные и вторичные амины образуют слабые межмолекулярные водородные связи:
Это объясняет относительно более высокую температуру кипения аминов по сравнению с алканами с близкой молекулярной массой.
Амины также способны к образованию водородных связей с водой:
Поэтому низшие амины хорошо растворимы в воде.
С увеличением числа и размеров углеводородных радикалов растворимость аминов в воде уменьшается. Ароматические амины в воде не растворяются.
Видео:Качественные анализы на амины. Химический опытСкачать

Химические свойства аминов
| Амины имеют сходное с аммиаком строение и проявляют подобные ему свойства. |
Как в аммиаке, так и в аминах атом азота имеет неподеленную пару электронов:


| Поэтому амины и аммиак обладают свойствами оснований. |
1. Основные свойства аминов
| Алифатические амины являются более сильными основаниями, чем аммиак, а ароматические — более слабыми. |
Это объясняется тем, что радикалы СН3–, С2Н5– увеличивают электронную плотность на атоме азота:
Это приводит к усилению основных свойств.
| Основные свойства аминов возрастают в ряду: |
1.1. Взаимодействие с водой
В водном растворе амины обратимо реагируют с водой. Среда водного раствора аминов — слабощелочная:
1.2. Взаимодействие с кислотами
Амины реагируют с кислотами, как минеральными, так и карбоновыми, и аминокислотами, образуя соли (или амиды в случае карбоновых кислот):
При взаимодействии аминов с многоосновными кислотами возможно образование кислых солей:
1.3. Взаимодействие с солями
Амины способны осаждать гидроксиды тяжелых металлов из водных растворов.
| Например, при взаимодействии с хлоридом железа (II) образуется осадок гидроксида железа (II): |
Видео:Изучение реакции нейтрализации (фенолфталеин). | Практическая работа № 4. Опыт 3.Скачать

2. Окисление аминов
Амины сгорают в кислороде, образуя азот, углекислый газ и воду. Например, уравнение сгорания этиламина:
Видео:Самый легкий способ уравнять ОВР в органике!Скачать

3. Взаимодействие с азотистой кислотой
Первичные алифатические амины при действии азотистой кислоты превращаются в спирты:
| Это качественная реакция на первичные амины – выделение азота. |
Вторичные амины (алифатические и ароматические) образуют нитрозосоединения — вещества желтого цвета:
Видео:ВСЕ ПРО АЛКАНЫ за 8 минут: Химические Свойства и ПолучениеСкачать

4. Алкилирование аминов
Первичные амины способны взаимодействовать с галогеналканами с образованием соли вторичного амина:
Из полученной соли щелочью выделяют вторичный амин, который можно далее алкилировать до третичного амина.
Видео:12.3. Амины: Химические свойства. ЕГЭ по химииСкачать

Особенности анилина
Анилин С6H5-NH2 – это ароматический амин.
| Анилин – бесцветная маслянистая жидкость с характерным запахом. На воздухе окисляется и приобретает красно-бурую окраску. Ядовит. В воде практически не растворяется. |
При 18 о С в 100 мл воды растворяется 3,6г анилина. Раствор анилина не изменяет окраску индикаторов.
| Для анилина характерны реакции как по аминогруппе, так и по бензольному кольцу. |
- Бензольное кольцо уменьшает основные свойства аминогруппы по сравнению алифатическими аминами и даже с аммиаком:
Анилин не реагирует с водой, но реагирует с сильными кислотами, образуя соли:
- Бензольное кольцо в анилине становится более активным в реакциях замещения, чем у бензола.
Реакция с галогенами идёт без катализатора во все три орто- и пара- положения.
| Качественная реакция на анилин: реагирует с бромной водой с образованием 2,4,6-триброманилина (белый осадок ↓). |
Видео:РЕАКЦИЯ ЭТЕРИФИКАЦИИСкачать

Получение аминов
Видео:Качественные реакции в органической химии | ХИМИЯ ЕГЭ | Лия МенделееваСкачать

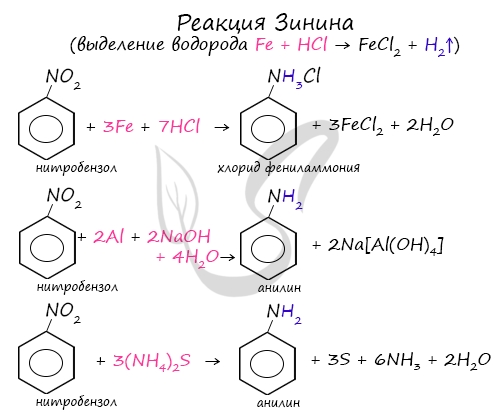
Восстановление нитросоединений
Первичные амины можно получить восстановлением нитросоединений.
- Гидрирование водородом:
- Восстановление сульфидом аммония:
- Алюминий в щелочнойсреде.
Алюминий реагирует с щелочами с образованием гидроксокомплексов.
В щелочной и нейтральной среде получаются амины.
Восстановлением нитробензола получают анилин.
- Металлами в кислой среде – железом, оловом или цинком в соляной кислоте.
При этом образуются не сами амины, а соли аминов:
Амины из раствора соли выделяют с помощью щелочи:
Видео:Качественные реакции в неорганической химии | ХИМИЯ ЕГЭ | Лия МенделееваСкачать

Алкилирование аммиака и аминов
При взаимодействии аммиака с галогеналканами происходит образование соли первичного амина, из которой действием щелочи можно выделить сам первичный амин.
Если проводить реакцию с избытком аммиака, то сразу получится амин, а галогеноводород образует соль с аммиаком:
Видео:10 класс § 44 "Химические свойства спиртов"Скачать

Гидрирование нитрилов
Таким образом получают первичные амины. Возможно восстановление нитрилов водородом на катализаторе:
.
Видео:Все качественные реакции органических соединений за 45 минут | Химия 10 класс | УмскулСкачать

Соли аминов
- Соли аминов — это твердые вещества без запаха, хорошо растворимые в воде, но не растворимые в органических растворителях (в отличие от аминов).
- При действии щелочей на соли аминов выделяются свободные амины:
- Соли аминов вступают в обменные реакции в растворе:
- Взаимодействие с аминами.
Соль амина с более слабыми основными свойствами может реагировать с другим амином, образуя новую соль (более сильные амины вытесняют менее сильные из солей):
Видео:12.4. Анилин: Строение, химические свойства, способы получения. ЕГЭ по химииСкачать

15 комментариев
Видео:Реакция ВильямсонаСкачать

Добавить ваш
Где получение аминов , там 2) Реакция Зинина слева написано R как радикал, а справа (после равно) уже метиламин, почему метиламин справа, а слева просто R? Разве Зинин не анилин получил этим способом?
Да, спасибо, поправил. В узком смысле реакцией Зинина называют получение именно ароматических аминов, в широком смысле так называют восстановление любых нитросоединений сульфидом аммония.
Здравствуйте! Скажите, пожалуйста, реагируют ли третичные амины с галогеналканами? Если да, то как идет реакция и что получается? Например,при взаимодействии триметиламина с хлорметаном?
Здравствуйте! Реагируют, но дальнейшее замещение по связям N-H не идет.
Здравствуйте! Не показано взаимодействие аминов со спиртами.
Третичные амины с алкилгалогенидами реагируют. Получаются четвертичные аммониевые соли. Говорить, что они вообще не реагируют, неправильно. Они не вступают в реакцию алкилирования.
R3N + RCl = R4N(+)Cl(-)
По такой схеме за счет пары электронов на азоте реагируют алифатические амины, ароматические амины, пиридин с получением N-алкилпиридинийхлорида (иодида) и пр.
Да, спасибо за комментарий. Я имел в виду, что не идет дальнейшее замещение.
спасибо, отличная идея!
для полноты информации я бы добавил оптическую изомерию и примеры этой изомерии ко всем классам органических веществ, потому что на егэ это есть
На ЕГЭ пока оптической изомерии нет.
Admin>Здравствуйте! Реагируют, но дальнейшее замещение по связям N-H не идет.
что значит «дальнейшее»? у триметиламина — и так уже нет N-H связей, может вы имели в виду протонированный триметил-амин (скажем) солянокислый, что в форме соли он останется третичным амином например до момента щелочного депротонирования(высвобождения основания амина)
—
а что кстати, есть способ галоидным алкилом моноалкилирование первичного ароматического амина до вторичного осуществить, избежав образования третичного амина — диалкилированного уже
на этилировании уже проще, а вот метиллирование нейромедиаторов не удавалось остановить на стадии N,N-ДиМет.(например в ацетоне с карбонатом калия, или с DIPEA), выход третичного целевого амина всегда оказывался либо самым низким из продуктов реакции, либо просто очень низким(10% в сложной смеси аминов с преобладанием четвертичной соли триметиламмония метилиодида, а сейчас подумал — если при N-метилировании первичного ароматического амина метилиодидом, образуется гидроиодид N-метил…исх.пер.амина, он же даже во второе метиллирование уже не должен входить, усиленным основанием став (скажем адреналином, основнее норадреналина исходного как я понимаю за счет появившегося электроннодонороного метила) и так будет выведен из реакционной среды(например выпав осадком соли, не солватированной в неполярной РС)
получается в отсутствие основного катализа алкилирование первичных аминов ограничивается моно-алкилированием — не далее чем до вторичного амина? или на практике соли не так надёжны как в оптимистичных прогнозах теоретизирующего учащегося?
Амины
Амины — органические соединения, продукты замещения атомов водорода в аммиаке NH3 различными углеводородными радикалами. Функциональная группой аминов является аминогруппа — NH2.
Классификация аминов
По числу углеводородных радикалов амины подразделяются на первичные, вторичные и третичные.
Запомните, что основные свойства аминов выражены тем сильнее, чем больше электронной плотности присутствует на атоме азота. Однако, у третичных аминов три углеводородных радикала создают значительные затруднения для химических реакций.
Таким образом, у третичных аминов основные свойства выражены слабее, чем у вторичных аминов. Основные свойства возрастают в ряду: третичные амины (слабые основные свойства) → первичные амины → вторичные амины (основные свойства хорошо выражены).
Номенклатура и изомерия аминов
Названия аминов формируются путем добавления суффикса «амин» к названию соответствующего углеводородного радикала: метиламин, этиламин, пропиламин, изопропиламин, бутиламин и т.д. В случае если радикалов несколько, их перечисляют в алфавитном порядке.
Общая формула предельных аминов CnH2n+3N. Атомы углерода находятся в sp3 гибридизации.
Для аминов характерна структурная изомерия: углеродного скелета, положения функциональной группы и изомерия аминогруппы.
Получение
- Нагревание галогеналканов с аммиаком
В основе этой реакции лежит замещение атома галогена в галогеналканах на аминогруппу, при этом образуются амин и соль аммония.
При такой реакции нитрогруппа превращается в аминогруппу, образуется вода.
Знаменитой является предложенная в 1842 году Н.Н. Зининым реакция получения аминов восстановления ароматических нитросоединений (анилина и других). Она возможна в нескольких вариантах, главное, чтобы в начале реакции выделился водород.
Реакция сопровождается разрушением карбонильной группы и отщеплении ее от молекулы амида в виде воды.
Этим способом в промышленности получают гексаметилендиамин, используемый в изготовлении волокна — нейлон.
В промышленности амины получают реакцией аммиака со спиртами, в ходе которой происходит замещение гидроксогруппы на аминогруппу.
В ходе реакции галогеналканов с аммиаком, аминами, становится возможным получение первичных, вторичных и третичных аминов.
Химические свойства аминов
- Основные свойства
Как и аммиак, амины обладают основными свойствами, их растворы окрашивают лакмусовую бумажку в синий цвет.
В реакции с водой амины образуют гидроксиды алкиламмония, которые аналогичны гидроксиду аммония. Анилин с водой не реагирует, так как является слабым основанием.
Как основания, амины вступают в реакции с различными кислотами и образуют соли алкиламмония.
Данная реакция помогает различить первичные, вторичные и третичные амины, которые по-разному с ней взаимодействуют.
При конденсации первичных аминов с альдегидами и кетонами получают основания Шиффа, соединения, которые содержат фрагмент «N=C».
Соли аминов легко разлагаются щелочами (растворимыми основаниями). В результате образуется исходный амин, соль кислоты и вода.
При горении аминов азот чаще всего выделяется в молекулярном виде, так как для реакции азота с кислородом необходима очень высокая температура. Выделение углекислого газа и воды обыкновенно при горении органических веществ.
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. |