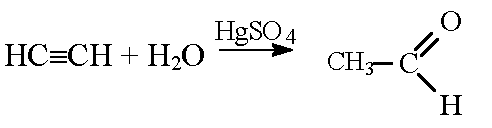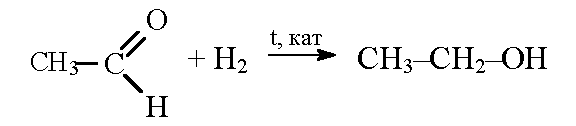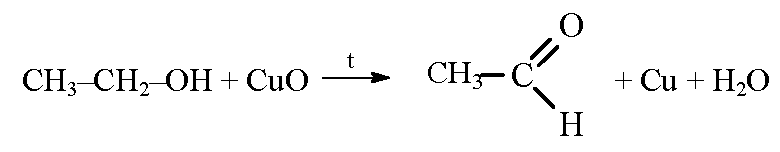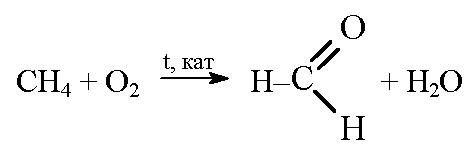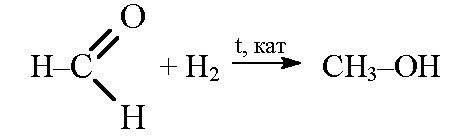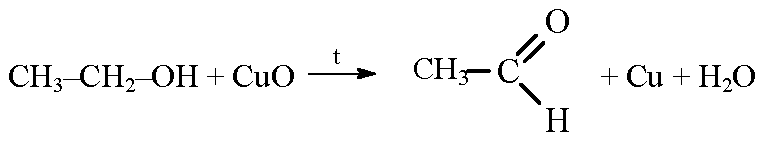Опубликовано в категории Химия, 22.06.2018 >>
Если твой вопрос не раскрыт полностью, то попробуй воспользоваться поиском на сайте и найти другие ответы по предмету Химия.
- Два способа получения этанола из этана. Как получить из этана этиловый спирт
- 42. Спирты как производные углеводородов. Промышленный синтез метанола
- Инструкция
- Этанол: химические свойства и получение
- Строение этанола
- Водородные связи и физические свойства спиртов
- Изомерия спиртов
- Структурная изомерия
- Химические свойства этанола
- 1.1. Взаимодействие с раствором щелочей
- 1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
- 2. Реакции замещения группы ОН
- 2.1. Взаимодействие с галогеноводородами
- 2.2. Взаимодействие с аммиаком
- 2.3. Этерификация (образование сложных эфиров)
- 2.4. Взаимодействие с кислотами-гидроксидами
- 3. Реакции замещения группы ОН
- 3.1. Внутримолекулярная дегидратация
- 3.2. Межмолекулярная дегидратация
- 4. Окисление этанола
- 4.1. Окисление оксидом меди (II)
- 4.2. Окисление кислородом в присутствии катализатора
- 4.3. Жесткое окисление
- 4.4. Горение спиртов
- 5. Дегидрирование этанола
- Получение этанола
- 1. Щелочной гидролиз галогеналканов
- 2. Гидратация алкенов
- 3. Гидрирование карбонильных соединений
- 4. Получение этанола спиртовым брожением глюкозы
- Please wait.
- We are checking your browser. gomolog.ru
- Why do I have to complete a CAPTCHA?
- What can I do to prevent this in the future?
Видео:Как решать ОРГАНИЧЕСКИЕ ЦЕПОЧКИ? Основные типы химических реакцийСкачать

Два способа получения этанола из этана. Как получить из этана этиловый спирт
Метиловый спирт, или метанол, его особенности:
1) структурная формула – СН 3 ОН;
2) это бесцветная жидкость с температурой кипения 64,5 °C;
3) ядовит (может вызывать слепоту, смерть);
4) в больших количествах метиловый спирт получается синтезом из оксида углерода (II) и водорода при высоком давлении (20–30 МПа) и высокой температуре (400 °C) в присутствии катализатора (около 90 % ZnО и 10 % Сr 2 O 3): СО + 2Н 2 → СН 3 ОН;
5) метиловый спирт образуется и при сухой перегонке дерева, поэтому его называют также древесным спиртом. Применяется он в качестве растворителя, а также для получения других органических веществ.
Этиловый (винный) спирт, или этанол, его особенности:
1) структурная формула – СН 3 СН 2 ОН;
2) температура кипения 78,4 °C;
3) этанол – это одно из важнейших исходных веществ в современной промышленности органического синтеза.
Способы получения этанола:
1) для получения используются различные сахаристые вещества (виноградный сахар, глюкоза, которая путем «брожения» превращается в этиловый спирт). Реакция протекает по схеме:
C 6 H 12 O 6 (глюкоза) → 2C 2 H 5 OH + 2CO 2 .
2) глюкоза в свободном виде содержится, например, в виноградном соке, при брожении которого получается виноградное вино с содержанием спирта от 8 до 16 %;
3) исходным продуктом для получения спирта может служить полисахарид крахмал, который содержится, например, в клубнях картофеля, зернах ржи, пшеницы, кукурузы;
4) для превращения в сахаристые вещества (глюкозу) крахмал предварительно подвергают гидролизу.
Для этого мука или измельченный картофель заваривается горячей водой и по охлаждении в него добавляется солод.
Солод – это проросшие, а затем подсушенные и растертые с водой зерна ячменя.
В солоде содержится диастаз, который действует на процесс осахаривания крахмала каталитически.
Диастаз – это сложная смесь ферментов;
5) по окончании осахаривания к полученной жидкости прибавляются дрожжи, под действием ферментов которых (зимазы) образуется спирт;
6) его отгоняют и затем очищают повторной перегонкой.
В настоящее время осахариванию подвергается также полисахарид – целлюлоза (клетчатка), которая образует главную массу древесины.
Для этого целлюлоза подвергается гидролизу в присутствии кислот (например, древесные опилки при 150–170 °C обрабатываются 0,1–5 %-ной серной кислотой под давлением 0,7–1,5 МПа).
Видео:Уравнивание реакций горения углеводородовСкачать

42. Спирты как производные углеводородов. Промышленный синтез метанола
Генетическая связь между спиртами и углеводородами:
1) спирты могут рассматриваться как гидроксильные производные углеводородов;
2) их можно отнести также к частично окисленным углеводородам, так как, кроме углерода и водорода, они содержат еще кислород;
3) довольно трудно непосредственно заменить атом водорода на гидроксильную группу или внедрить атом кислорода в молекулу углеводорода;
4) это можно осуществить через галогено-производные.
Например, чтобы получить этиловый спирт из этана, нужно сначала получить бромэтан:
С 2 Н 6 + Вr → С 2 Н 5 Вr + НВr.
А затем бромэтан превратить в спирт нагреванием с водной щелочью:
С 2 Н 5 Вr + Н ОН → С 2 Н 5 ОН + НВr;
5) щелочь нужна, чтобы нейтрализовать бромоводород и устранить возможность реакции его со спиртом;
6) таким же образом метиловый спирт можно получить из метана: СН 4 → СН 3 Вr → СН 3 ОН;
7) спирты связаны генетически и с непредельными углеводородами.
Например, этанол получается при гидратации этилена:
СН 2 =СН 2 → Н 2 О=СН 3 -СН 2 -ОН.
Реакция идет при температуре 280–300 °C и с давлением 7–8 МПа в присутствии ортофосфорной кислоты в качестве катализатора.
Промышленный синтез метанола, его особенности.
1. Метиловый спирт нельзя получить гидратацией непредельного углеводорода.
2. Его получают из синтез-газа, который представляет собой смесь оксида углерода (II) с водородом.
Метиловый спирт из синтез-газа получается по реакции:
СО + 2Н 2 → СН 3 ОН + Q.
Характерные особенности реакции.
1. Реакция идет в сторону уменьшения объема смеси, при этом смещению равновесия в сторону образования нужного продукта будет способствовать повышение давления.
2. Чтобы реакция шла с достаточной скоростью, необходимы катализатор и повышенная температура.
3. Реакция обратимая, исходные вещества при прохождении через реактор реагируют не полностью.
4. В целях экономного их использования спирт, который образуется, необходимо выделять из продуктов реакции, а непрореагировавшие газы снова направлять в реактор, т. е. осуществить циркуляционный процесс.
5. В целях экономии энергетических затрат отходящие продукты экзотермической реакции необходимо использовать для нагревания газов, которые идут на синтез.
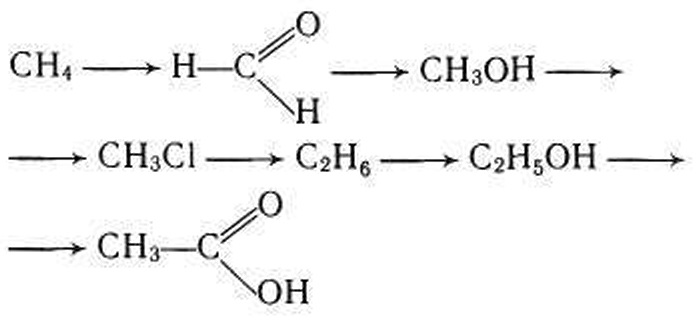
а) из метана при нагревании можно получить ацетилен:
ацетилен в присутствии сульфата ртути (ii) присоединяет воду, образуется уксусный альдегид (реакция кучерова):
уксусный альдегид можно восстановить до этилового спирта:
при действии на этиловый спирт бромоводорода в присутствии серной кислоты образуется бромэтан (этилбромид):
при действии на этилбромид спиртового раствора щелочи при нагревании отщепляется бромоводород и образуется этилен:
при присоединении к этилену воды в присутствии кислот образуется этиловый спирт:
б) при окислении метана в присутствии катализатора образуется мета-наль:
метаналь при гидрировании превращается в метанол:
при действии на метанол хлороводорода в присутствии серной кислоты образуется хлорметан (метилхлорид):
при взаимодействии хлорметана с натрием образуется этан (реакция вюрца):
из этана в две стадии можно получить этанол. при хлорировании этана образуется хлорэтан:
при действии на хлорэтан водного раствора щелочи происходит замещение атома хлора на гидроксильную группу и образуется этанол.
этанол окисляется оксидом меди при нагревании в уксусный альдегид:
Этан — С2Н6 — газ без запаха и цвета, класса алканов. В природе находится в составе нефти, природного газа, других углеводородов, поэтому относится к органическим соединениям. Из этана можно получить этиловый . Правда, этот процесс достаточно трудоемкий, поэтому спирт обычно иным путем.
Видео:Опыты по химии. Получение этилена и опыты с нимСкачать

Инструкция
Этиловый спирт получают преимущественно как результат брожения сахаросодержащих продуктов, зерна, фруктов, ягод, овощей. Для этого используют ректификационные аппараты, нагревание, перегонку.
Получить этиловый спирт из этана простой реакцией можно в процессе каталитического окисления при нагревании до 2000 градусов в присутствии катализатора.
Другой способ получения этилового спирт а из этана заключается в проведении следующих реакций:1. галогенирование при температуре 1000°С и в присутствии ультрафиолетового света:С2Н6 + Cl2 = C2H5Cl2. далее проведите реакцию с щелочью:С2H5Cl +NaOH = C2H5OH + NaCl
Этиловый спирт из этана можно получить и еще одним способом. Проведите дегидрирование этана при 400-5000°С в присутствии катализаторов платины Pt, никеля Ni, Al2O3:С2Н6 = С2Н4 + Н2
Этан горюч, почти нерастворим в воде, в смеси с воздухом взрывоопасен, нетоксичен. При нагревании этана до температуры 575-10000°С он распадается на ацетилен и водород, дальнейшее нагревание приводит к обугливанию и появлению ароматических углеводородов.
В промышленности этан применяется для производства этилена — бесцветного газа, имеющего ту же химическую формулу, что и этан. В прошлом веке в сочетании с кислородом этилен применялся для наркоза. Сегодня этилен является сырьем для получения полиэтилена, винилацетата, окиси этилена, уксусной кислоты и многого другого. Этилен также является фитогормоном, влияющим на здоровье и рост многих живых организмов.
Внимание, только СЕГОДНЯ!
Химическая формула этилового спирта (этанола) – С2Н5ОН. А вещество хлорэтан, применяемое в качестве хладагента и для наркоза в медицинских целях, имеет формулу С2Н5Сl. Эти вещества близки по составу, только в первом случае к этильному радикалу С2Н5…
Этан и пропан – газы, простейшие представители ряда предельных углеводородов — алканов. Их химические формулы С2Н6 и С3Н8 соответственно. Этан служит сырьем для производства этилена. Пропан же используется в качестве топлива, как в чистом виде, так…
Бутан – органическое соединение алканового ряда. Это бесцветный газ, который образуется в процессе переработки (крекинге) нефти. При высоких концентрациях бутан ядовит, также этот углеводород горюч и взрывоопасен. Получают его в лаборатории и в…
Этанол, или этиловый спирт, как и этилен относятся к органическим соединениям. Этанол – это одноатомный спирт, а этилен – непредельный углеводород класса алкенов. Однако между ними существует генетическая связь, согласно которой из одного вещества…
Ацетилен относится к непредельным углеводородам. Его химические свойства определяются тройной связью. Он способен вступать в реакции окисления, замещения, присоединения и полимеризации. Этан – предельный углеводород, для которого характеры реакции…
Цепочка химических превращений — это последовательность химических реакций, в результате которых одни вещества превращаются в другие. Чтобы осуществить такую цепочку, нужно прежде всего уметь правильно записывать уравнения реакций и знать, при каких…
Этанол – бесцветное органическое вещество, обладающее резким специфическим запахом. Его используют промышленности, в лабораториях — как лучший органический растворитель, в медицине – как прекрасный антисептик. Этиловый спирт также применяют для…
Уксусный альдегид (другие названия – этаналь, ацетальдегид) имеет химическую формулу CH3COH. Внешний вид – прозрачная бесцветная жидкость, с резким «обжигающим» запахом. Кипит при комнатной температуре. Легко растворяется в воде, и…
Этан – бесцветный газ, представитель класса алканов, имеющий химическую формулу С2Н6. Этилен – также бесцветный газ, но, в отличие от этана, в природе почти не представлен. Это вещество — простейший представитель родственного алканам класса алкенов,…
Метан представляет собой простейший предельный углеводород, из которого путем последующих реакций могут быть получены другие органические вещества, в том числе и этилен. Он, как и метан, является простейшим веществом, но, в отличие от него,…
Этан — один из часто встречающихся в природе газов. Это органическое вещество, которое наравне с метаном входит в состав нефти и природного газа. Из него получают этилен, который, в свою очередь, является сырьем для получения уксусной кислоты,…
Хлорэтан (другие названия – хлористый этил, этилхлорид) представляет собою бесцветный газ, имеет химическую формулу C2Н5Cl. Смешивается с этиловым спиртом и диэтиловым эфиром, почти не смешивается с водой. Каким образом можно получить это вещество? …
Существует 2 основных способа получения этанола — микробиологический (спиртовое брожение) и синтетический (гидратация этилена). Если именно из этана надо, то как-то так:
Условия проведения реакции к сожалению подсказать не могу 🙁 . зато получается почти текила — спирт с солью :)))
Видео:Решение задач на термохимические уравнения. 8 класс.Скачать

Этанол: химические свойства и получение
Этанол C2H5OH или CH3CH2OH, этиловый спирт – это органическое вещество, предельный одноатомный спирт .
Общая формула предельных нециклических одноатомных спиртов: CnH2n+2O.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Строение этанола
В молекулах спиртов, помимо связей С–С и С–Н, присутствуют ковалентные полярные химические связи О–Н и С–О.
| Электроотрицательность кислорода (ЭО = 3,5) больше электроотрицательности водорода (ЭО = 2,1) и углерода (ЭО = 2,4). |
Электронная плотность обеих связей смещена к более электроотрицательному атому кислорода:
| Атом кислорода в спиртах находится в состоянии sp 3 -гибридизации. |
В образовании химических связей с атомами C и H участвуют две 2sp 3 -гибридные орбитали, а еще две 2sp 3 -гибридные орбитали заняты неподеленными электронными парами атома кислорода.
Поэтому валентный угол C–О–H близок к тетраэдрическому и составляет почти 108 о .
Водородные связи и физические свойства спиртов
Спирты образуют межмолекулярные водородные связи. Водородные связи вызывают притяжение и ассоциацию молекул спиртов:
Поэтому этанол – жидкость с относительно высокой температурой кипения (температура кипения этанола +78 о С).
Водородные связи образуются не только между молекулами спиртов, но и между молекулами спиртов и воды. Поэтому спирты очень хорошо растворимы в воде. Молекулы спиртов в воде гидратируются:
| Чем больше углеводородный радикал, тем меньше растворимость спирта в воде. Чем больше ОН-групп в спирте, тем больше растворимость в воде. |
Этанол смешивается с водой в любых соотношениях.
Видео:Химия 10 класс (Урок№6 - Одноатомные предельные спирты.)Скачать

Изомерия спиртов
Видео:7.1. Спирты: Номенклатура, классификация, изомерия. ЕГЭ по химииСкачать

Структурная изомерия
Для этанола характерна структурная изомерия – межклассовая изомерия.
Межклассовые изомеры — это вещества разных классов с различным строением, но одинаковым составом. Спирты являются межклассовыми изомерами с простыми эфирами. Общая формула и спиртов, и простых эфиров — CnH2n+2О.
| Например. Межклассовые изомеры с общей формулой С2Н6О этиловый спирт СН3–CH2–OH и диметиловый эфир CH3–O–CH3 |
| Этиловый спирт | Диметиловый эфир |
| СН3–CH2–OH | CH3–O–CH3 |
Видео:ВСЕ ПРО АЛКАНЫ за 8 минут: Химические Свойства и ПолучениеСкачать

Химические свойства этанола
Спирты – органические вещества, молекулы которых содержат, помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.
1. Кислотные свойства
| Спирты – неэлектролиты, в водном растворе не диссоциируют на ионы; кислотные свойства у них выражены слабее, чем у воды. |
1.1. Взаимодействие с раствором щелочей
При взаимодействии этанола с растворами щелочей реакция практически не идет, т. к. образующийся алкоголят почти полностью гидролизуется водой.
Равновесие в этой реакции так сильно сдвинуто влево, что прямая реакция не идет. Поэтому этанол не взаимодействуют с растворами щелочей.
1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
Этанол взаимодействует с активными металлами (щелочными и щелочноземельными).
| Например, этанол взаимодействует с калием с образованием этилата калия и водорода . |
Алкоголяты под действием воды полностью гидролизуются с выделением спирта и гидроксида металла.
| Например, этилат калия разлагается водой: |
Видео:10 класс. Химия. Промышленное получение этилового спирта. 13.05.2020.Скачать

2. Реакции замещения группы ОН
2.1. Взаимодействие с галогеноводородами
При взаимодействии спиртов с галогеноводородами группа ОН замещается на галоген и образуется галогеналкан.
| Например, этанол реагирует с бромоводородом. |
2.2. Взаимодействие с аммиаком
Гидроксогруппу спиртов можно заместить на аминогруппу при нагревании спирта с аммиаком на катализаторе.
| Например, при взаимодействии этанола с аммиаком образуется этиламин. |
2.3. Этерификация (образование сложных эфиров)
Одноатомные и многоатомные спирты вступают в реакции с карбоновыми кислотами, образуя сложные эфиры.
| Например, этанол реагирует с уксусной кислотой с образованием этилацетата (этилового эфира уксусной кислоты): |
2.4. Взаимодействие с кислотами-гидроксидами
Спирты взаимодействуют и с неорганическими кислотами, например, азотной или серной.
| Например, при взаимодействии этанола с азотной кислотой образуется сложный эфир этилнитрат : |
Видео:Получение алканов. Реакция Вюрца (механизм + сложные случаи). ЕГЭ по химии.Скачать

Видео:Химия 10 класс (Урок№3 - Непредельные углеводороды – алкены.)Скачать

3. Реакции замещения группы ОН
В присутствии концентрированной серной кислоты от спиртов отщепляется вода. Процесс дегидратации протекает по двум возможным направлениям: внутримолекулярная дегидратация и межмолекулярная дегидратация.
3.1. Внутримолекулярная дегидратация
При высокой температуре (больше 140 о С) происходит внутримолекулярная дегидратация и образуется соответствующий алкен.
| Например, из этанола под действием концентрированной серной кислоты при температуре выше 140 градусов образуется этилен: |
Видео:ЭТО ПОМОЖЕТ разобраться в Органической Химии — Алкены, Урок ХимииСкачать

В качестве катализатора этой реакции также используют оксид алюминия.
3.2. Межмолекулярная дегидратация
При низкой температуре (меньше 140 о С) происходит межмолекулярная дегидратация по механизму нуклеофильного замещения: ОН-группа в одной молекуле спирта замещается на группу OR другой молекулы. Продуктом реакции является простой эфир.
| Например, при дегидратации этанола при температуре до 140 о С образуется диэтиловый эфир: |
Видео:Получение этилена и изучение его свойств. | Практическая работа № 1.Скачать

4. Окисление этанола
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на каталитическое, мягкое и жесткое.
| При окислении первичных спиртов они последовательно превращаются сначала в альдегиды, а потом в карбоновые кислоты. Глубина окисления зависит от окислителя. Первичный спирт → альдегид → карбоновая кислота |
Типичные окислители — оксид меди (II), перманганат калия KMnO4, K2Cr2O7, кислород в присутствии катализатора.
4.1. Окисление оксидом меди (II)
Cпирты можно окислить оксидом меди (II) при нагревании. При этом медь восстанавливается до простого вещества.
| Например, этанол окисляется оксидом меди до уксусного альдегида |
4.2. Окисление кислородом в присутствии катализатора
Cпирты можно окислить кислородом в присутствии катализатора (медь, оксид хрома (III) и др.).
4.3. Жесткое окисление
При жестком окислении под действием перманганатов или соединений хрома (VI) первичные спирты окисляются до карбоновых кислот.
| Например, при взаимодействии этанола с перманганатом калия в серной кислоте образуется уксусная кислота |
4.4. Горение спиртов
Образуются углекислый газ и вода и выделяется большое количество теплоты.
| Например, уравнение сгорания этанола: |
Видео:ТЕРМОХИМИЯ ЦТ\ЦЭСкачать

5. Дегидрирование этанола
При нагревании спиртов в присутствии медного катализатора протекает реакция дегидрирования.
| Например, при дегидрировании этанола образуется этаналь |
Видео:Видео №3. Как составить изомерыСкачать

Получение этанола
Видео:Практическая работа "Получение этилена и опыты с ним" 10 классСкачать

1. Щелочной гидролиз галогеналканов
При взаимодействии галогеналканов с водным раствором щелочей образуются спирты. Атом галогена в галогеналкане замещается на гидроксогруппу.
| Например, при нагревании хлорэтана с водным раствором гидроксида натрия образуется этанол |
Видео:КАК ДАВАТЬ НАЗВАНИЯ органическим соединениям | КАК СОСТАВЛЯТЬ ФОРМУЛЫ в органической химииСкачать

2. Гидратация алкенов
Гидратация (присоединение воды) алкенов протекает в присутствии минеральных кислот. При присоединении воды к алкенам образуются спирты.
| Например, при взаимодействии этилена с водой образуется этиловый спирт. |
Видео:Получение и изучение свойств этилена. Опыт 2Скачать

3. Гидрирование карбонильных соединений
Присоединение водорода к альдегидам и кетонам протекает при нагревании в присутствии катализатора. При гидрировании альдегидов образуются первичные спирты, при гидрировании кетонов — вторичные спирты, а из формальдегида образуется метанол.
| Например, при гидрировании этаналя образуется этанол |
Видео:1.4. Алканы: Решение цепочек. ЕГЭ по химииСкачать

Видео:ЦТ-форум. Химия. Решение задач по органической химииСкачать

4. Получение этанола спиртовым брожением глюкозы
Для глюкозы характерно ферментативное брожение, то есть распад молекул на части под действием ферментов. Один из вариантов — спиртовое брожение.
Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6df1ddf47d005aae • Your IP : 85.95.188.35 • Performance & security by Cloudflare