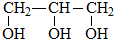Этиленгликоль C2H4(OH)2 или CH2(OH)CH2OH, этандиол-1,2 – это органическое вещество, предельный двухатомный спирт .
Общая формула предельных нециклических двухатомных спиртов: CnH2n+2O2 или CnH2n(OН)2
- Строение этиленгликоля
- Водородные связи и физические свойства спиртов
- Химические свойства этиленгликоля
- 1.1. Взаимодействие с раствором щелочей
- 1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
- 2. Реакции замещения группы ОН
- 2.1. Взаимодействие с галогеноводородами
- 2.2. Этерификация (образование сложных эфиров)
- 2.4. Взаимодействие с кислотами-гидроксидами
- 3. Дегидратация
- 4. Окисление этиленгликоля
- 4.1. Окисление оксидом меди (II)
- 4.2. Окисление кислородом в присутствии катализатора
- 4.3. Жесткое окисление
- 4.4. Горение этиленгликоля
- 5. Дегидрирование этаниленгликоля
- Получение этиленгликоля
- 1. Щелочной гидролиз дигалогеналканов
- 2. Гидрирование карбонильных соединений
- 3. Гидролиз сложных эфиров
- 4. Мягкое окисление алкенов
- Acetyl
- Этанол х этиленгликоль
- Этиленгликоль, полученный дегидратацией этилового спирта.
- ХИМИЧЕСКИЕ СВОЙСТВА ЭТИЛЕНГЛИКОЛЯ
- Этанол х этиленгликоль
- 💥 Видео
Видео:Как решать ОРГАНИЧЕСКИЕ ЦЕПОЧКИ? Основные типы химических реакцийСкачать

Строение этиленгликоля
В молекулах спиртов, помимо связей С–С и С–Н, присутствуют ковалентные полярные химические связи О–Н и С–О.
| Электроотрицательность кислорода (ЭО = 3,5) больше электроотрицательности водорода (ЭО = 2,1) и углерода (ЭО = 2,4). |
Электронная плотность обеих связей смещена к более электроотрицательному атому кислорода:
| Атом кислорода в спиртах находится в состоянии sp 3 -гибридизации. |
В образовании химических связей с атомами C и H участвуют две 2sp 3 -гибридные орбитали, а еще две 2sp 3 -гибридные орбитали заняты неподеленными электронными парами атома кислорода.
Поэтому валентный угол C–О–H близок к тетраэдрическому и составляет почти 108 о .
Водородные связи и физические свойства спиртов
Спирты образуют межмолекулярные водородные связи. Водородные связи вызывают притяжение и ассоциацию молекул спиртов:
Поэтому этиленгликоль – жидкость с относительно высокой температурой кипения.
Водородные связи образуются не только между молекулами спиртов, но и между молекулами спиртов и воды. Поэтому спирты очень хорошо растворимы в воде. Молекулы спиртов в воде гидратируются:
| Чем больше углеводородный радикал, тем меньше растворимость спирта в воде. Чем больше ОН-групп в спирте, тем больше растворимость в воде. |
Видео:Опыты по химии. Получение этилена и опыты с нимСкачать

Химические свойства этиленгликоля
Спирты – органические вещества, молекулы которых содержат, помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.
1. Кислотные свойства
| Спирты – неэлектролиты, в водном растворе не диссоциируют на ионы; кислотные свойства у них выражены слабее, чем у воды. |
1.1. Взаимодействие с раствором щелочей
При взаимодействии этиленгликоля с растворами щелочей реакция практически не идет, т. к. образующийся алкоголят почти полностью гидролизуется водой.
Равновесие в этой реакции так сильно сдвинуто влево, что прямая реакция не идет. Поэтому этиленгликоль не взаимодействует с растворами щелочей.
1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
Этиленгликоль взаимодействует с активными металлами (щелочными и щелочноземельными).
| Например, этиленгликоль взаимодействует с калием с образованием гликолята калия и водорода . |
Алкоголяты под действием воды полностью гидролизуются с выделением спирта и гидроксида металла.
Видео:Уравнивание реакций горения углеводородовСкачать

2. Реакции замещения группы ОН
2.1. Взаимодействие с галогеноводородами
При взаимодействии этиленгликоля с галогеноводородами группы ОН замещаются на галоген и образуются дигалогеналкан.
| Например, этиленгликоль реагирует с бромоводородом. |
2.2. Этерификация (образование сложных эфиров)
Многоатомные спирты вступают в реакции с карбоновыми кислотами, образуя сложные эфиры.
| Например, этиленгликоль реагирует с уксусной кислотой с образованием эфира: |
2.4. Взаимодействие с кислотами-гидроксидами
Этиленгликоль взаимодействует и с неорганическими кислотами, например, азотной или серной.
| Например, при взаимодействии этиленгликоля с азотной кислотой образуется нитроэтиленгликоль : |
Видео:Составление уравнений реакций горения. 11 класс.Скачать

Видео:ВСЕ ПРО АЛКАНЫ за 8 минут: Химические Свойства и ПолучениеСкачать

3. Дегидратация
В присутствии концентрированной серной кислоты от спиртов отщепляется вода. При высокой температуре (180 о С) протекает внутримолекулярная дегидратация этиленгликоля и образуется соответствующий ацетальдегид.
Видео:Химия с нуля — Химические свойства АлкеновСкачать

Видео:8.3. Многоатомные спирты (этиленгликоль, глицерин): Химические свойства. ЕГЭ по химииСкачать

4. Окисление этиленгликоля
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
Типичные окислители — оксид меди (II), перманганат калия KMnO4, K2Cr2O7, кислород в присутствии катализатора.
4.1. Окисление оксидом меди (II)
Этиленгликоль можно окислить оксидом меди (II) при нагревании. При этом медь восстанавливается до простого вещества.
4.2. Окисление кислородом в присутствии катализатора
Этиленгликоль можно окислить кислородом в присутствии катализатора (медь, оксид хрома (III) и др.).
4.3. Жесткое окисление
При жестком окислении под действием перманганатов или соединений хрома (VI) этиленгликоль окисляется до щавелевой кислоты.
| Например, при взаимодействии этиленгликоля с перманганатом калия в серной кислоте образуется щавелевая кислота |
4.4. Горение этиленгликоля
При сгорании этиленгликоля образуется углекислый газ и вода и выделяется большое количество теплоты.
Видео:7.1. Спирты: Номенклатура, классификация, изомерия. ЕГЭ по химииСкачать

5. Дегидрирование этаниленгликоля
При нагревании спиртов в присутствии медного катализатора протекает реакция дегидрирования.
| Например, при дегидрировании этиленгликоля образуется этандиаль |
Видео:10 класс - Химия - Химические свойства этанола. Применение на базе свойствСкачать

Получение этиленгликоля
Видео:ЭТО ПОМОЖЕТ разобраться в Органической Химии — Алкены, Урок ХимииСкачать

1. Щелочной гидролиз дигалогеналканов
При взаимодействии дигалогеналканов с водным раствором щелочей образуются двухатомные спирты. Атомы галогенов в дигалогеналканах замещаются на гидроксогруппы.
| Например, при нагревании 1,2-дихлорэтана с водным раствором гидроксида натрия образуется этиленгликоль |
Видео:Видеоурок по химии "Типы химических реакций в органической химии"Скачать

2. Гидрирование карбонильных соединений
| Например, при гидрировании этандиаля образуется этиленгликоль |
О=CН-CH=O + 2H2 → CH2(OH)-CH2OH
Видео:Получение этилена и изучение его свойств. | Практическая работа № 1.Скачать

3. Гидролиз сложных эфиров
При гидролизе сложных эфиров этиленгликоля и карбоновых кислот образуются этиленгликоль и карбоновая кислота.
Видео:Химические свойства алкенов | Химия 10 класс | УмскулСкачать

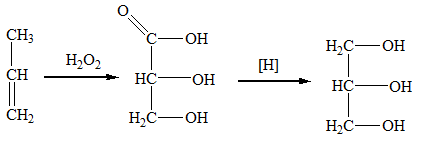
4. Мягкое окисление алкенов
Мягкое окисление протекает при низкой температуре в присутствии перманганата калия. При этом раствор перманганата обесцвечивается.
В молекуле алкена разрывается только π-связь и окисляется каждый атом углерода при двойной связи.
При этом образуются двухатомные спирты (диолы).
Видео:Химия 10 класс (Урок№3 - Непредельные углеводороды – алкены.)Скачать

Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Видео:Взаимодействие этилена с раствором перманганата калияСкачать  Этанол х этиленгликольВидео:Этиленовые углеводороды (базовый уровень)Скачать  Этиленгликоль, полученный дегидратацией этилового спирта.Применение этилового спирта Этиленгликоль. Дегидратация этилового спирта. Дистилляция этилового спирта из бражки Эпюрация и ректификация этилового спирта Этиленгликоль, полученный дегидратацией этилового спирта: С 1990 года мировой спрос на рынке полиэфирной продукции резко возрос, и это привело к быстрому росту и развитию производства этиленгликоля в мире. В 1996 году, производственные мощности гликоля в мире составляет 11,2 млн. тонн в год. В течение 1996 и 2004 года темпы роста производственных мощностей гликоля в мире составляют 5%, а ежегодные темпы роста производства этиленгликоля составляет 5,8%. В 2004 году, производственные мощности в мире по этиленгликолю составили 16,98 млн. т / год, продукциями 14.96 млн. тонн, средний уровень операционных составляет 92%. В структуре потребления этиленгликоля производенного в мире, 80,4% используется в производстве полиэфиров, 12% используется в производстве антифриза, 7,6% используется в производстве антиобледенительной жидкости, нанесения покрытий и др. Ожидается, что в 2010 году, гликоль производственных мощностей в мире будет около 22,4 млн. тонн / год, в 2015 году составит около 22 млн т / год. Рост в основном в Азии и на Ближнем Востоке; рост Западной Европы и Северной Америки становится сравнительно меньше. Спрос на гликоль в мире составляет около 19,2 млн. тонн в 2010 году, из которых средний ежегодный рост спроса на 4,4% и 1,1% в Северной Америке и Западной Европе, соответственно, и ожидается, что спрос на потребление гликоля в мире в 2015 г. достигнет 23.36 млн. тонн, а среднегодовые темпы роста спроса составят примерно на 4 процента. Китай является крупным потребителем гликоля, около 80% гликоля используется в полиэфирных производствах и 8% для антифриза и 12% для других производств. В настоящее время отечественные китайские заводы, включая Яньшань нефтехимическую корпорацию, Шанхайскую нефтехимическую компанию “, ООО Sinopec Янцзы нефтехимической Ко, Лтд, Кыргызская компания, Maoming нефтехимическая компания, чья общая мощность производства 1,28 млн. тонн, а общий объем производства 1.2564 млн. тонн в 2006. Одновременно, фактическое китайское потребление составило 5.3177 млн. тонн с годовым объемом импорта 4.0613 млн. тонн, эти цифры показали, что спрос на гликоль в промышленности сильно вырос. Из-за ограниченности ресурсов гликоля, в период 2006-2010 годов, гликолевый производственный потенциал основном концентрируется в China Petrochemical Corporation, дочерних предприятий и китайско-иностранных совместные предприятиях, соответственно – 60% и 23%. К 2010 году в Китае ожидается, что производственные мощности по гликолю будут увеличены на 1,92 млн. т / год , и как ожидается, достигнет 3,1 млн. тонн / год в 2010 году. В соответствии с внутренним производством полиэфиров 19 млн. тонн в 2010 году прогноз потребления гликоля составит 6,4 млн. тонн и возникнет разрыв на рынке на 3,3 млн. тонн полиэфирного сырья по самых низким оценкам. Кто закроет разрыв в производстве этиленгликоля ? Отщепление воды от спиртов (реакция дегидратации). При действии на одноатомные спирты (метиловый спирт CH3OH, этиловый спирт С2H5OH, пропиловый спирт С3H7OH, бутиловый спирт С4H9OH, амиловый спирт С5H11OH и т.д.) различных водоотнимающих средств происходит отщепление молекул воды. При этом атом водорода отщепляется от углеводородного атома, соседнего с тем, при котором находится гидроксильная группа спирта. Это приводит к образованию непредельного углеводорода В этой реакции также проявляется правило Зайцева: если есть выбор, водород отщепляется преимущественно от того соседнего углеродного атома, который содержит меньшее число атомов водорода. Дегидратация спиртов происходит, например, при пропускании паров спирта над нагретой при 350 – 500 градусов Цельсия окисью алюминия. Старый же лабораторный метод заключается в нагревании спиртов с концентрированной серной кислотой; обычно так получают по приведенной выше реакции этилен из этилового спирта. При смешивании концентрированной серной кислоты со спиртом вначале образуется сложный эфир – алкисернистая кислота. В этом случае, при избытке спирта, дегидратация протекает межмолекулярно, т.е. путем выделения молекулы воды за счет гидроксильных групп двух молекул спирта; при этом образуются так называемые простые эфиры При дальнейшем нагревании алкисернистая кислота разлагается с образованием непредельного углеводорода этилена и серной кислоты Из этилена легко получить окись этилена. В промышленности ее получают прямым окислением этилена кислородом воздуха в присутствии катализатора (серебро) при температуре до 350 градусов Цельсия Окись этилена – бесцветная, легко летучая жидкость с температурой кипения 10,7 градусов Цельсия; d = 0,897, окись этилена хорошо растворима в воде. Окись этилена очень активное в реакциях соединение. Трехчленное кольцо окиси этилена легко раскрывается, и она присоединяет различные реагенты; на этом основано применение окиси этилена для многих синтезов. Присоединяя молекулу воды окись этилена образует этиленгликоль. Этиленгликоль именно так и получают в промышленности : Таким образом, реакция получения этиленгликоля из этилового спирта может быть записана следующими формулами: Этиленгликоль может быть получен также щелочным гидролизом 1,2-дихлорэтана, а 1,2-дихлорэтан – хлорированием этилена Этиленгликоль из этилена может быть получен и путем окисления в водном растворе / По такой же реакции получают пропиленгликоль – антиобледенительная жидкость для Авиакомпаний – авиационный антифриз При взаимодействии окиси этилена с этиленгликолем получаются полигликоли Синтетические моющие средства – ценные заменители мыл. Производство мыл требует большого расхода растительных и животных жиров. Синтетические моющие средства – это различные композиции основой которых являются изготовляемые путем синтеза разнообразные поверностно-активные вещества ПАВ. 131 Диоксан – это соединение иначе называют диэтиленовым эфиром, так как в нем через кислород соединены два этиленовых радикала. Диоксан образуется из двух молекул этиленгликоля с выделением двух молекул воды; для этого этиленгликоль достаточно нагревать с небольшим количеством серной кислоты. Диоксан – бесцветная жидкость, температура кипения 101 градус Цельсия, температура плавления 11,8 гр Цельсия d=1,0338. Диоксан смешивается с водой. По химическим свойствам диокан подобен простым эфирам. Диоксан применяется как очень хороший растворитель высокомолекулярных соединений, жиров, масел. 131 К неионогенным моющим веществам относятся соедиенния с различными относительно высокими молекулярными массами, содержащие гидроксильные и эфирные группы, придающие им растворимость в воде и поверхностно-активные свойства. Примером могут служить продукты взаимодействия высших спиртов с окисью этилена по схеме Соединения этого типа предствавляют собой эфиры полигликолей. Радикал R может содержать, например, 18 углеродных атомов. В зависимости от числа молекул окиси этилена, введенных в реакцию (величина n=6-8, 10-15 или 20-30) получают поверхностно-активные вещества различных назначений (моющие средства для шерсти, искусственного шелка, хлопка, эмульгаторы масел и т.п.) Видео:Алкены. Ч.3-3. Химические свойства. Реакции окисления и горения.Скачать  ХИМИЧЕСКИЕ СВОЙСТВА ЭТИЛЕНГЛИКОЛЯЕкатеринбург 2016 Содержание – Понятие об Спиртах – Применение спиртов в промышленности Введение СПИРТЫ (алкоголи) – класс органических соединений, содержащих одну или несколько группировок С–ОН, при этом гидроксильная группа ОН связана с алифатическим атомом углерода (соединения, у которых атом углерода в группировке С–ОН входит в состав ароматического ядра, называются фенолами) Классификация спиртов разнообразна и зависит от того, какой признак строения взят за основу. 1. В зависимости от количества гидроксильных групп в молекуле спирты делят на: а) одноатомные (содержат одну гидроксильную ОН-группу), например, метанол СН3ОН, этанол С2Н5ОН, пропанол С3Н7ОН б) многоатомные (две и более гидроксильных групп), например, этиленгликоль HO–СH2–CH2–OH, глицерин HO–СH2–СН(ОН)–CH2–OH, пентаэритрит С(СН2ОН)4. Многоатомные спирты Многоатомными являются спирты, содержащие две и более гидроксильные группы в составе молекулы органического вещества. Все двухатомные спирты называются гликолями. Этиленгликоль Этиленгликоль (тривиальное название) или этандиол (систематическое название). Химическая формула HO−CH2CH2−OHHO−CH2CH2−OH. Двухатомный спирт, простейший представитель многоатомных спиртов. В очищенном виде представляет собой прозрачную бесцветную жидкость слегка маслянистой консистенции. Не имеет запаха и обладает сладковатым вкусом. Этиленгликоль токсичен. По степени воздействия на организм относится к веществам 3-го класса опасности. Попадание этиленгликоля или его растворов в организм человека может привести к необратимым изменениям в организме и к летальному исходу. Этиленгликоль — горючее вещество. Температура вспышки паров 120 градусов C. Этиленгликоль находит широкое применение в технике в качестве охлаждающего реагента систем охлаждения двигателей и компьютеров, антифризов и тормозных жидкостей. Используется в органическом синтезе. ПОЛУЧЕНИЕ ЭТИЛЕНГЛИКОЛЯ В промышленности этиленгликоль получают путём: · (I) гидратацией 1,2-дихлорэтана; · (II) гидратацией хлоргидринов; · (III) гидратации окиси этилена при повышенном давлении и температуре в присутствии 0,1—0,5 % серной или ортофосфорной кислоты, достигая 90 % выхода; · (IV) окислением этилена перманганатом калия: ХИМИЧЕСКИЕ СВОЙСТВА ЭТИЛЕНГЛИКОЛЯ Этиленгликоль обладает всеми свойствами гликолей. 1. Взаимодействие с щелочными металлами: образует соли гликоляты
2. Взаимодействие с органическими кислотами: образует -одно- и двухзамещенные сложные эфиры (аналогично глицерину) 3. Взаимодействие с галогеноводородами HHal: образует этиленгалогенгидрины HOCH2CH2OH+HHal⟶HOCH2CH2Hаl+H2O 4. Дегидратация при нагревании в присутствии концентрированной серной кислоты: образуется ацетальдегид 5. Окисление в зависимости от условий и окислителя: могут образовываться · глиоксалевая и щавелевая кислоты; Окисление молекулярным кислородом приводит к образованию формальдегида HCOH и муравьиной кислоты HCOOH. Глицерин Глицерин(тривиальное название) или пропантриол-1,2,3 (название по систематической номенклатуре). Трехатомный спирт,входящий в состав сложных эфиров природного происхождения – жидких и твердых жиров. Бесцветная вязкая жидкость, за счет наличия водородных связей смешивается с водой в любых отношениях. Безводный глицерин очень гигроскопичен, при попадании на кожу вызывает ожоги, но в разбавленном состоянии используется при изготовлении косметических средств (кремов, гелей), и даже в пищевой промышленности для приготовления ликеров. Получение глицерина Глицерин получают гидролизом жиров, а также из пропилена (через получение 2,3-гидроксипропановой кислоты с последующим ее восстановлением): Дата добавления: 2016-11-18 ; просмотров: 11263 | Нарушение авторских прав Видео:7.4. Спирты: Химические свойства. ЕГЭ по химииСкачать  Этанол х этиленгликольНеэлектролитом является каждое вещество пары 1) хлорид аммония и этанол 2) ацетон и этиленгликоль 3) уксусная и серная кислоты 4) сульфат и ацетат натрия Хлорид аммония, уксусная и серная кислоты, сульфат и ацетат натрия – электролиты, а вот этанол, ацетон и этиленгликоль – нет. Установите соответствие между реагирующими веществами и реагентом, с помощью которого их можно отличить друг от друга: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
A) этаналь и ацетон — альдегиды окисляются до карбоновых кислот под действием даже мягких окислителей, например, 2) Б) пропанол-1 и этиленгликоль — 2) B) метиламин и пропан — 1) метилоранж (р-р) — метиламин имеет щелочную реакцию среды. Г) этанол и глицерин — 2) Метиламин имеет щелочную реакцию среды, НО, при н.у. это же газ? А метилоранж дан раствором, на газ же мы жидкостью не капнем? Газы пропускаются через раствор метилоранжа, который меняет цвет в зависимости от среды пропускаемого газа. Метиламин проявляет основные свойства, а пропан не будет реагировать с серной кислотой. Тоже возможно различить. Видимых изменений раствора серной кислоты при пропускании газов не будет. И этиленгликоль, и этанол 1) реагируют с уксусной кислотой 2) используются в пищевой промышленности 3) взаимодействуют с гидроксидом меди(II) 4) окисляются кислородом при нагревании 5) являются спиртами 6) плохо растворяются в воде
Эти спирты могут образовывать сложные эфиры (например, с уксусной кислотой). Этиленгликоль не используется в пищевой промышленности. С гидроксидом меди(II) реагирует только этиленгликоль. Оба соединения могут окисляются кислородом при нагревании. Конечно, оба они являются спиртами. Оба хорошо растворимы в воде. Установите соответствие между веществами и реагентом, с помощью которого их можно отличить друг от друга: к позиции, обозначенной буквой, подберите позицию, обозначенную цифрой.
А) ацетилен и этилен — только ацетилен прореагирует с 2) Б) этилен и этан — только этилен прореагирует с бромной водой ((1) В) этандиол-1, 2 и этанол — только этиленгликоль прореагирует с 5) Г) фенол и этанол — только фенол прореагирует с бромной водой ((1) а разве ацетилен будет с бромной водой ? У него же с серебром характерная реакция. А этилен наоборот с бромной водой? Так почему мне не выбрать А) 1 И ацетилен, и этилен иvt.n кратные связи, поэтому обесцвечивают бромную воду, таким способом отличить их нельзя, так как будем видеть одинаковый результат в обеих пробирках, но только ацетилен реагирует с серебряной солью, что является его отличительной чертой от того же этилена. И с металлическим натрием, и с гидроксидом меди(II) реагирует Из приведенных веществ все реагируют с металлическим натрием, но только двухатомный спирт этиленгликоль реагирует с гидроксидом меди(II). Этиленгликоль можно получить при окислении раствором перманганата калия При окислении водным раствором перманганата калия алкенов получаются диолы. Например, при окислении этилена – этиленгликоль. При окислении этанола оксидом меди (II) при нагревании образуется 1) уксусная кислота 2) уксусный альдегид 4) оксид углерода (IV) и вода При окислении этанола оксидом меди (II) при нагревании протекает реакция дегидрирования – отщепление водорода от гидроксильной (спиртовой) группы и водорода от атома углерода, соединенного непосредственно с гидроксильной группой. Взаимодействие этилена с водой протекает 1) по цепному свободнорадикальному механизму 2) без катализатора 3) с промежуточным образованием частицы 4) с разрывом 5) с образованием этанола 6) с преимущественным образованием этиленгликоля Молекула воды полярна и ей не характерны радикальные реакции — к этилену сначала присоединяется катион водорода (с промежуточным образованием частицы 💥 ВидеоХимия 9 класс (Урок№30 - Производные углеводородов. Спирты.)Скачать  Практическая работа "Получение этилена и опыты с ним" 10 классСкачать  |



















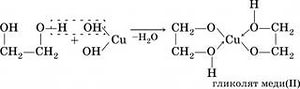
 В отличие от одноатомных спиртов, многоатомные взаимодействуют также и соснованиями. Качественным реактивом на многоатомные спирты является щелочной раствор гидроксида меди(II), при взаимодействии с которым многоатомные спирты образуют комплексное соединение с медью ярко-синего цвета.
В отличие от одноатомных спиртов, многоатомные взаимодействуют также и соснованиями. Качественным реактивом на многоатомные спирты является щелочной раствор гидроксида меди(II), при взаимодействии с которым многоатомные спирты образуют комплексное соединение с медью ярко-синего цвета.