Члены гомологического ряда алканов имеют общие химические свойства. В обычных условиях алканы химически инертны. Они устойчивы к действию многих реагентов: не взаимодействуют с концентрированной серной и азотной кислотами, с концентрированными и расплавленными щелочами, не окисляются сильными окислителями – КМnО4 и т.п
Видеоопыт «Отношение метана к раствору перманганата калия и бромной воде»
Химическая устойчивость алканов объясняется высокой прочностью σ–связей С ─ С и С ─ Н, а также их неполярностью. Неполярные связи С ─ С и С ─ Н в алканах не склонны к ионному разрыву, но способны расщепляться гомолитически под действием активных свободных радикалов. Поэтому для алканов характерны радикальные реакции (реакции замещения), в результате которых получаются соединения, где атомы водорода замещены на другие атомы или группы атомов.
Алканы вступают в реакции, протекающие по свободно-радикальному (цепному) механизму и протекают обычно на свету или при нагревании. По этому механизму легче всего замещаются атомы водорода у третичных, затем вторичных и первичных атомов углерода. При хлорировании эта закономерность не соблюдается при T>400˚C.
Алканы относятся к углеводородам, в которых отсутствуют кратные связи. Из-за предельности алканов реакции присоединения для них нехарактерны.
- Реакции замещения (разрыв связей С ─ Н)
- Механизм реакции
- Реакции окисления
- Термические превращения алканов (реакции разложения)
- Реакции отщепления
- Реакции перегруппировки (изомеризация)
- Этан: способы получения и свойства
- Гомологический ряд этана
- Строение этана
- Изомерия этана
- Химические свойства этана
- 1. Реакции замещения
- 1.1. Галогенирование
- 1.2. Нитрование этана
- 2. Дегидрирование этана
- 3. Окисление этана
- 3.1. Полное окисление – горение
- Получение этана
- 1. Взаимодействие галогеналканов с металлическим натрием (реакция Вюрца)
- 2. Декарбоксилирование солей карбоновых кислот (реакция Дюма)
- 3. Гидрирование алкенов и алкинов
- 4. Синтез Фишера-Тропша
- 5. Получение этана в промышленности
- Действие концентрированной серной кислоты на предельные углеводороды
- 🔍 Видео
Реакции замещения (разрыв связей С ─ Н)
1. Галогенирование (замещение атома водорода атомом галогена — F, Cl, Br с образованием галогеналкана).
Реакция галогенирования алканов протекает по радикальному цепному механизму, т.е. как цепь последовательных превращений с участием свободно-радикальных частиц.
Теорию цепных реакций разработал советский ученый, один из основоположников химической физики, академик Н.Н. Семенов (1896—1986), за что в 1956 г. был награжден Нобелевской премией.
Скорость реакции зависит от активности галогенов, которая уменьшается с увеличением радиуса атома.
Алканы очень активно реагируют с фтором, реакция алканов с его участием сопровождается взрывом и окислением до СF4.
Реакции хлорирования и бромирования протекают под действием света (фотохимическая цепная реакция) или при 300–400 о C.
Иодирование проходит обратимо, поэтому требуется окислитель для удаления НI из реакции.
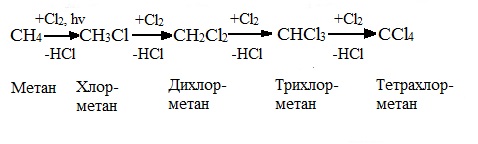
Низшие алканы (СН4, С2Н6, С3Н8) можно прохлорировать полностью. В молекуле метана атомы хлора могут заместить от одного до четырех атомов водорода в зависимости от соотношения реагентов
(hv — формула кванта света)
Тривиальное название трихлорметана – хлороформ.
Механизм реакции
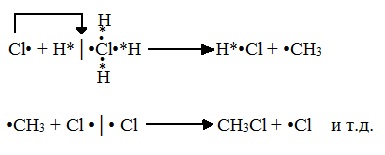
Реакция осуществляется в три стадии:
А) Инициирование (зарождение цепи) – гомолитическое расщепление молекулы Сl2 с образованием свободных радикалов хлора:
Свободные радикалы – это атомы или группы атомов с неспаренными электронами (•Сl, •Н, •СН3…)
Б) Развитие цепи (взаимодействие радикала хлора с молекулой алкана, метильного радикала с новой молекулой хлора и т.д.):
В) Обрыв цепи (происходит при соединении двух радикалов друг с другом):
Скорость реакции замещения водорода на атом галогена у галогеналканов выше, чем у соответствующего алкана, это связано с взаимным влиянием атомов в молекуле:
Электронная плотность связи С – Cl смещена к более электроотрицательному атому хлора, в результате этого на нем образуется частичный отрицательный заряд, а на атоме углерода – частичный положительный заряд.
На атоме углерода в метильной группе (-СН3) создаётся недостаток электронной плотности, поэтому он оттягивает на себя электронную плотность от соседних атомов водорода, в результате этого связи С – Н становятся менее прочными и атомы водорода легче замещаются на атомы хлора.
При увеличении углеводородного радикала наиболее подвижными остаются атомы водорода у атома углерода ближайшего к заместителю:
Алканы обесцвечивают раствор брома при нагревании, вступая в реакцию радикального замещения.
Видеоопыт «Взаимодействие алканов с бромом при нагревании»
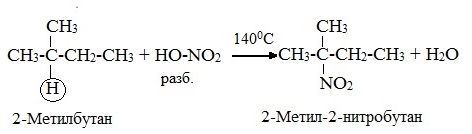
2.Нитрование (замещение атома водорода нитрогруппой – NO2 с образованием нитроалканов R-NO2). Нитрующий реагент – разбавленная азотная кислота HNO3 (НО─NО2).
Нитрование разбавленной азотной кислотой при t = 140 0 С и при повышенном или нормальном давлении — реакция М.И.Коновалова.
В результате реакции образуется смесь изомерных нитросоединений. Наиболее легко замещаются атомы водорода у третичного атома углерода, труднее – у вторичного, наиболее трудно – у первичного:
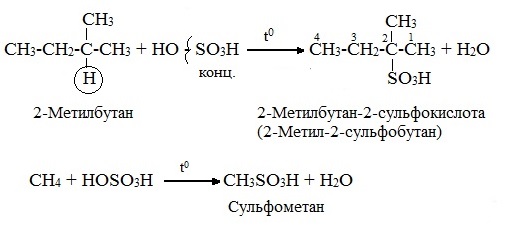
3.Сульфирование (замещение атомов водорода сульфогруппой SO3Н с образованием алкансульфокислот RSO3Н). Сульфирующий реагент – серная кислота Н2SO4 (НО─SO3Н). Сульфирование алканов происходит при действии очень концентрированной Н2SO4 при небольшом нагревании.
Наиболее легко замещается атом водорода у третичного атома углерода:
Реакции окисления
Алканы – соединения с низкими степенями окисления углерода и в зависимости от условий реакции они могут окисляться с образованием различных соединений.
При обычных условиях алканы устойчивы к действию сильных окислителей (КМnO4, К2Сr2О7).
1. Горение (окисление кислородом воздуха при высоких температурах)
А) Полное окисление (избыток О2)
При избытке кислорода происходит полное окисление алканов до СО2, где углерод имеет высшую степень окисления +4, и воды. Горение углеводородов приводит к разрыву всех связей С–С и С–Н и сопровождается выделением большого количества тепла (экзотермическая реакция).
Низшие гомологи (метан, этан, пропан, бутан) образуют с воздухом взрывоопасные смеси, что необходимо учитывать при их использовании. С увеличением молекулярной массы алканы загораются труднее.
Видеоопыт «Взрыв смеси метана с кислородом»
Видеоопыт «Горение жидких алканов»
Видеоопыт «Горение твердых углеводородов (на примере парафина)»
Процесс горения углеводородов широко используется для получения энергии (в двигателях внутреннего сгорания, в тепловых электростанциях и т.п.).
Общий вид реакции горения алканов:
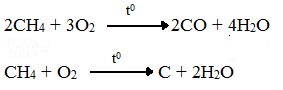
Б) Неполное окисление (недостаток О2)
При горении высших алканов ((n >>1)) при недостатке кислорода образуются продукты частичного окисления: угарный газ СО (степень окисления углерода +2), сажа (мелкодисперсный углерод, со степенью окисления 0).
Поэтому высшие алканы горят на воздухе коптящим пламенем, выделяя токсичный угарный газ, представляющий опасность для человека.
Горение метана при недостатке кислорода происходит по уравнениям:
Последняя реакция используется в промышленности для получения сажи из природного газа, содержащего 80-97% метана.
2. Каталитическое окисление
Частичное окисление алканов при относительно невысокой температуре и с применением катализаторов сопровождается разрывом только части связей С–С и С–Н и используется для получения ценных продуктов: карбоновых кислот, кетонов, альдегидов, спиртов.
Например, при неполном окислении бутана происходит разрыв связи (С2–С3) и получается две молекулы уксусной кислоты:
Этим способом в промышленности получают уксусную кислоту.
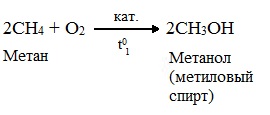
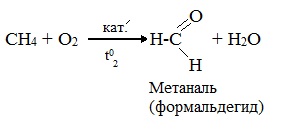
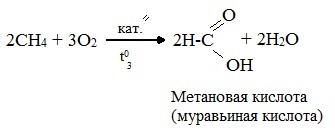
При мягком окислении метана кислородом воздуха в присутствии катализаторов могут быть получены метиловый спирт, формальдегид и муравьиная кислота.
Высшие алканы (n>25) под действием кислорода воздуха в жидкой фазе в присутствии солей марганца превращаются в смесь карбоновых кислот со средней длиной цепи С12–С18, которые используются для получения моющих средств и поверхностно-активных веществ.
Учебный фильм «Каталитическое окисление высших парафиновых углеводородов»
Термические превращения алканов (реакции разложения)
1. Крекинг (анг. сracking — расщепление) алканов является основой переработки нефти с целью получения продуктов меньшей молекулярной массы, которые используются в качестве моторных топлив, смазочных масел, а также сырья для химической и нефтехимической промышленности.
Для осуществления этого процесса используют два способа: термический крекинг (при нагревании без доступа воздуха) и каталитический крекинг (более умеренное нагревание в присутствии катализатора).
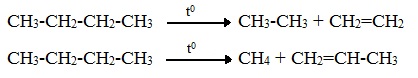
Термический крекинг — это разрыв связей С ─ С в молекулах алканов с длинными углеродными цепями, в результате которого образуются алканы и алкены с меньшим числом атомов углерода.
Термический крекинг (пиролиз) осуществляется при температуре 450 – 700 0 С:
Крекинг н-гексана (работа Литвишко Алексея, г. Самара)
Каталитический крекинг проводят в присутствии катализаторов (обычно оксидов алюминия и кремния) при температуре 500 0 С и атмосферном давлении. При этом с разрывом молекул происходит реакция изомеризации и дегидрирования.
Крекинг октана (работа Литвишко Алексея, г. Самара)
2.При нагревании метана или этана до температуры 1000 0 С начинается пиролиз – разложение на простые вещества:
Полученный этим способом углерод является достаточно чистым, в технике называется сажей и используется, например, при производстве автомобильных покрышек.
3. Конверсия метана с образованием синтез – газа (СО + Н2)
Важное значение имеет реакция взаимодействия метана с водяным паром, в результате которой образуется смесь оксида углерода (II) с водородом – «синтез-газ» (водяной газ, генераторный газ):

Реакции отщепления
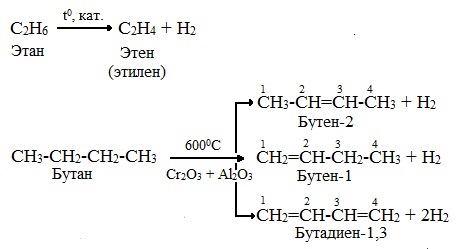
1.Дегидрирование (отщепление водорода; происходит в результате разрыва связей С ─ Н; осуществляется в присутствии катализатора при повышенных температурах).
В ходе пропускания алканов над катализатором (Pt, Pd, Ni, А1203, Сг203) при высокой температуре (400 — 600°С) происходит отщепление молекулы водорода и образование алкена:
2. Если метан нагреть до более высокой температуры (1500 0 С) и быстро охладить, то происходит межмолекулярное дегидрирование и образуется этин (ацетилен):
3.Дегидроциклизация (ароматизация) — реакция дегидрирования, которая приводит к замыканию цепи в устойчивый цикл.
Алканы, содержащие в основной цепи больше 4-х атомов углерода, используются для получения циклических соединений.
Если основная цепь молекулы алкана содержит 5 (но не более) атомов углерода (н-пентан и его алкильные производные), то при температуре 300 0 С над Pt-катализатором атомы водорода отщепляются от концевых атомов углеродной цепи и образуется пятичленный цикл (циклопентан или его производные):
Алканы с шестью или более углеродными атомами в цепи в присутствии катализатора циклизуются с образованием бензола м его производных:
Реакции перегруппировки (изомеризация)
1.Изомеризация (превращение химического соединения в его изомер):
Нормальные алканы под влиянием катализаторов и при нагревании способны превращаться в алканы с разветвленной цепью без изменения состава молекул. В этих случаях участвуют алканы, молекулы которых содержат не менее 4-х углеродных атомов:
Эта реакция является важной для производства бензина, поскольку наличие в его составе разветвленных углеводородов повышает октановое число, т.е. качество топлива.
Видеоопыт «Установление качественного состава предельных углеводородов«
Видео:СЕРНАЯ КИСЛОТА разбавленная и концентрированная - в чем отличия? | Химия ОГЭСкачать

Этан: способы получения и свойства
Этан C2H6 – это предельный углеводород, содержащий два атома углерода в углеродной цепи. Бесцветный газ без вкуса и запаха, нерастворим в воде и не смешивается с ней.
Видео:Изучаем химические свойства концентрированной серной кислоты!Скачать

Гомологический ряд этана
Все алканы — вещества, схожие по физическим и химическим свойствам, и отличающиеся на одну или несколько групп –СН2– друг от друга. Такие вещества называются гомологами, а ряд веществ, являющихся гомологами, называют гомологическим рядом.
Самый первый представитель гомологического ряда алканов – метан CH4. , или Н–СH2–H.
Продолжить гомологический ряд можно, последовательно добавляя группу –СН2– в углеводородную цепь алкана.
| Название алкана | Формула алкана |
| Метан | CH4 |
| Этан | C2H6 |
| Пропан | C3H8 |
| Бутан | C4H10 |
| Пентан | C5H12 |
| Гексан | C6H14 |
| Гептан | C7H16 |
| Октан | C8H18 |
| Нонан | C9H20 |
| Декан | C10H22 |
Общая формула гомологического ряда алканов CnH2n+2.
Первые четыре члена гомологического ряда алканов – газы, C5–C17 – жидкости, начиная с C18 – твердые вещества.
Видео:Серная кислота и ее соли. 9 класс.Скачать

Строение этана
В молекулах алканов встречаются химические связи C–H и С–С.
Связь C–H ковалентная слабополярная, связь С–С – ковалентная неполярная. Это одинарные σ-связи. Атомы углерода в алканах образуют по четыре σ-связи. Следовательно, гибридизация атомов углерода в молекулах алканов – sp 3 :
При образовании связи С–С происходит перекрывание sp 3 -гибридных орбиталей атомов углерода:
При образовании связи С–H происходит перекрывание sp 3 -гибридной орбитали атома углерода и s-орбитали атома водорода:
Четыре sp 3 -гибридные орбитали атома углерода взаимно отталкиваются, и располагаются в пространстве так, чтобы угол между орбиталями был максимально возможным.
Поэтому четыре гибридные орбитали углерода в алканах направлены в пространстве под углом 109 о 28′ друг к другу:
Это соответствует тетраэдрическому строению молекулы.
| Например, в молекуле этана C2H6 атомы водорода располагаются в пространстве в вершинах двух тетраэдров, центрами которых являются атомы углерода |
Видео:Химия 9 класс (Урок№13 - Оксид серы (VI). Серная кислота и ее соли.)Скачать

Изомерия этана
Для этана не характерно наличие изомеров – ни структурных (изомерия углеродного скелета, положения заместителей), ни пространственных.
Видео:Серная кислота. Химические свойства. Реакции с металлами.Скачать

Химические свойства этана
Этан – предельный углеводород, поэтому он не может вступать в реакции присоединения.
Для метана характерны реакции:
Разрыв слабо-полярных связей С – Н протекает только по гомолитическому механизму с образованием свободных радикалов.
Поэтому для этана характерны радикальные реакции.
Этан устойчив к действию сильных окислителей (KMnO4, K2Cr2O7 и др.), не реагирует с концентрированными кислотами, щелочами, бромной водой.
Видео:Серная кислота и металлы за 10 минут | ХИМИЯ ЕГЭ | СОТКАСкачать

1. Реакции замещения
В молекулах алканов связи С–Н более доступны для атаки другими частицами, чем менее прочные связи С–С.
1.1. Галогенирование
Этан реагирует с хлором и бромом на свету или при нагревании.
При хлорировании этана сначала образуется хлорэтан:
Хлорэтан может взаимодействовать с хлором и дальше с образованием дихлорэтана, трихлорэтана, тетрахлорметана и т.д.
1.2. Нитрование этана
Этан взаимодействует с разбавленной азотной кислотой по радикальному механизму, при нагревании и под давлением. Атом водорода в этане замещается на нитрогруппу NO2.
| Например. При нитровании этана образуется преимущественно нитроэтан: Видео:Концентрированная серная кислота и ее особые свойства | Химия ЕГЭ | УмскулСкачать  2. Дегидрирование этанаДегидрирование – это реакция отщепления атомов водорода. В качестве катализаторов дегидрирования используют никель Ni, платину Pt, палладий Pd, оксиды хрома (III), железа (III), цинка и др. При дегидрировании алканов, содержащих от 2 до 4 атомов углерода в молекуле, разрываются связи С–Н у соседних атомов углерода и образуются двойные и тройные связи.
Видео:Все про серную кислоту | Химия ОГЭ 2023 | УмскулСкачать  3. Окисление этанаЭтан – слабополярное соединение, поэтому при обычных условиях он не окисляется даже сильными окислителями (перманганат калия, хромат или дихромат калия и др.). 3.1. Полное окисление – горениеЭтан горит с образованием углекислого газа и воды. Реакция горения этана сопровождается выделением большого количества теплоты. Уравнение сгорания алканов в общем виде: При горении этана в недостатке кислорода может образоваться угарный газ СО или сажа С. Видео:Практическая работа №5. Разбавленная серная кислота и её соли. 9 класс.Скачать  Получение этанаВидео:Взаимодействие серной кислоты с металламиСкачать  1. Взаимодействие галогеналканов с металлическим натрием (реакция Вюрца)Это один из лабораторных способов получения этана из хлорметана или бромметана. При этом происходит удвоение углеродного скелета.
|
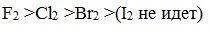

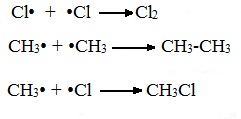
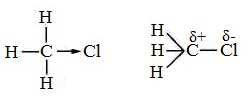
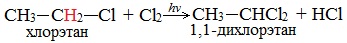

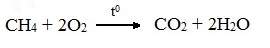
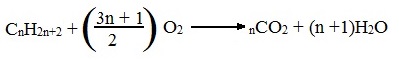
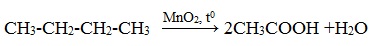
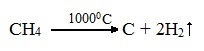
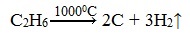
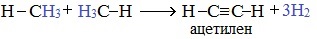
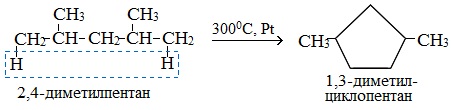
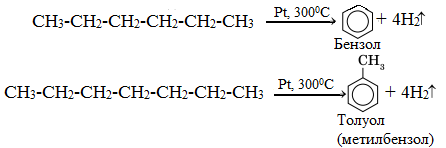
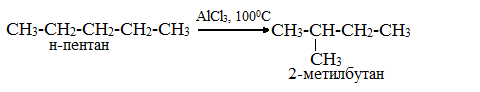















 СН3-СН2=CH2 + NaBr + H2O
СН3-СН2=CH2 + NaBr + H2O -положении к атому углерода, связанному с галогеном, находятся третичный, вторичный и первичный атомы водорода, то преимущественно отщепляется третичный атом водорода, в меньшей степени вторичный и тем более первичный (правило Зайцева).
-положении к атому углерода, связанному с галогеном, находятся третичный, вторичный и первичный атомы водорода, то преимущественно отщепляется третичный атом водорода, в меньшей степени вторичный и тем более первичный (правило Зайцева).
 СН3-CH-СН2-СН3
СН3-CH-СН2-СН3  СН3-CH=СH-СН3 + H2O
СН3-CH=СH-СН3 + H2O 
 СН3-CH-СН3
СН3-CH-СН3  СН3-CH=СН2
СН3-CH=СН2
 СН3-CH=СН2
СН3-CH=СН2 CH
CH  СН3-СН=CH2
СН3-СН=CH2 C5H10 + C5H12
C5H10 + C5H12 — и
— и  — связей, предопределяет их повышенную реакционную способность в реакциях присоединения, так как
— связей, предопределяет их повышенную реакционную способность в реакциях присоединения, так как  -связь прочнее чем
-связь прочнее чем  СН3-СН2-CH3
СН3-СН2-CH3 + — Cl
+ — Cl  [R-CHCl-CH-R]•Cl — ]
[R-CHCl-CH-R]•Cl — ] 

 R-CH-CН3
R-CH-CН3
 (СН3)2С=O + СН3COOH
(СН3)2С=O + СН3COOH



