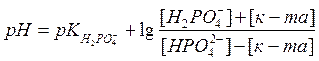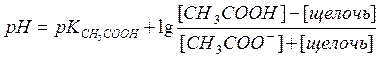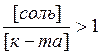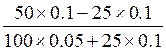Видео:Буферные растворы. 1 часть. 11 класс.Скачать

Вычисление буферной емкости по кислоте
Задача 51.
Какова буферная емкость по кислоте, если прибавление к 80 мл буферного раствора 30 мл 0,1 М раствора HCl вызвало изменение pH на единицу?
Решение:
Буферная емкость (buffer capacity) ß – число эквивалентов кислоты или щелочи, которое следует добавить к 1 л буферного раствора, чтобы изменить рН на единицу. Буферную емкость рассчитывают по уравнению:
ß = n/(z • V • ∆pH)
HCl — кислота одноосновная, поэтому z = 1:
n(HCl) = CV = 0,030 • 0,1 = 0,003 моль;
V(буфера) = 0,08 л
ß = 0,003/(1 • 0.08 • 1) = 0,0375 моль/л.
Ответ: ß = 0,0375 моль-экв/л.
Вычисление рН буферного раствора
Задача 52.
Вычислите рН раствора, полученного при смешивании 29 см 3 6,2 Н. раствора уксусной кислоты и 1 см 3 2,0 Н. раствора ацетата натрия.
Решение:
Получается буферный раствор — смесь слабой кислоты и ее соли (анионов слабой кислоты):
рН = рКа + lg[CM(соли)/CM(кислоты)];
CM = СH/z, где z — число эквивалентности.
Для кислоты z равно основности, для соли — числу катионов или анионов, умноженному на заряд соответствующего иона.
Уксусная кислота — одноосновная, поэтому z = 1.
В формуле ацетата натрия имеется по 1 иону с единичным зарядом, поэтому z = 1.
Соответственно, для обоих веществ СН = СМ.
При смешивании раствора получен буферный раствор объемом 29 + 1 = 30 мл = 0,03 л.
Ответ: рН = 6,71.
Расчет количества (моль) одноосновной кислоты
Задача 53.
Какое количество (моль) одноосновной кислоты необходимо ввести больному с рН крови 7,6 объемом 4л и буферной емкостью по кислоте 0,06 моль/л для нормализации рН крови?
Решение:
Установлено, что состоянию нормы соответствует определенный диапазон колебаний рН крови – от 7,37 до 7,44 со средней величиной 7,40. Рассчет будем производить по формуле:
ß = n/(z • V • ∆pH), где
ß — буферная емкость, n — количество вещества кислоты или соли, z — основность кислоты, V — объем раствора, ∆pH — изменене системы.
ß = 0,06 моль/л;
z = 1, потому что кислота одноосновная;
∆pH = (7,6 — 7,4) = 0,2;
V = 4л.
Рассчитаем количество (моль) одноосновной кислоты, получим:
ß = n/(z • V • ∆pH);
n(кислоты) = ß • (z • V • ∆pH) = 0,06 моль/л • (1 • 4 л •0,2) = 0,048 моль.
Ответ: n(кислоты) = 0,048 моль.
Видео:pH и буферные растворы | Медицинская химия | МедвузаСкачать

A. 5 мл 0,1н раствора гидрофосфата натрия и 15 мл 0,1н раствора дигидрофосфата натрия 8 часть
А. увеличится на 2 единицы
Б. уменьшится на 2 единицы
Г. увеличится в 2 раза
Д. уменьшится в 2 раза
19. Значение pH бикарбонатного буферного раствора при увеличении концентрации его компонентов в 2,5 раза:
А. увеличится в 2 раза
Б. уменьшится в 2 раза
Г. увеличится на 2 единицы
Д. уменьшится на 2 единицы
20. Значение pH фосфатного буферного раствора при уменьшении концентрации его компонентов в 3 раза:
А. уменьшается в 3 раза
Б. увеличится в 3 раза
Г. уменьшится на 3 единицы
Д. увеличится на 3 единицы
21. При разбавлении в 10 раз сильнее изменится концентрация ионов водорода в растворе, содержащем:
А. уксусную кислоту и ацетат натрия
Б. дигидрофосфат натрия и гидрофосфат натрия
* В. соляную кислоту
22. При значительном разбавлении pH буферной системы может измениться за счет:
А. изменения соотношения концентраций компонентов
* Б. изменения степени диссоциации слабого электролита и его соли
23. При добавлении к ацетатной буферной системе сильной кислоты протекает реакция:
А. CH3COOH 
* Б. CH3COO — + H + 
24. При добавлении к кислотной буферной системе HA/A — сильной кислоты происходит:
* А. связывание введенных ионов 
* Б. образование эквивалентного количества слабой кислоты
* В. незначительное повышение концентрации ионов водорода
Г. связывание введенных ионов 
Д. резкое изменение pH
25. При добавлении к ацетатной буферной системе небольшого количества щелочи протекает реакция:
А. CH3COOH 
Б. CH3COO — + H + 
* В. CH3COOH + OH — 
26. При добавлении к кислотной буферной системе щелочи происходит:
А. образование эквивалентного количества слабой кислоты
Б. нейтрализация введенных ионов OH — анионами соли
* В. нейтрализация введенных ионов OH — молекулами кислоты
Г. резкое изменение рН
* Д. образование эквивалентного количества соли
27. Если рН буферного раствора рассчитывается по уравнению рН = рК + 1 то его буферная емкость
* А. по кислоте больше Б. по щелочи больше
В. одинакова по кислоте и щелочи
28. Если рН буферного раствора рассчитывается по уравнению рН = рК – 1, то его буферная емкость
А. по кислоте больше
* Б. по щелочи больше
В. одинакова по кислоте и щелочи
29. Соотношение компонентов в кислотном буферном растворе, рН которого равен рК:
30. Область буферного действия соответствует изменениям рН:
31. Если в буферном растворе рН = рК + 1, то соотношение его компонентов 
32. Если в буферном растворе рН = рК — 1, то соотношение его компонентов 
33. Если рН буферного раствора рассчитывается по уравнению рН = 14 — рК — 1 то его буферная емкость
А. по кислоте больше
* Б. по щелочи больше
В. одинакова по кислоте и щелочи
34. Если рН буферного раствора рассчитывается по уравнению рН = 14 — рК + 1 то его буферная емкость
* А. по кислоте больше
Б. по щелочи больше
В. одинакова по кислоте и щелочи
35. Буферная система с рН = рКа + 1 более устойчива к добавлению:
36. Буферная система с рН = рКа — 1 более устойчива к добавлению:
37. Добавление к ацетатной буферной системе уксусной кислоты:
А. не изменяет значения pH
Б. увеличивает значение pH
* В. уменьшает значение pH
Г. увеличивает буферную емкость по кислоте
* Д. увеличивает буферную емкость по щелочи
38. Добавление к ацетатной буферной системе ацетата натрия:
А. не изменяет значения pH
* Б. увеличивает значение pH
В. уменьшает значение pH
* Г. увеличивает буферную емкость по кислоте
Д. увеличивает буферную емкость по щелочи
39. При добавлении к фосфатной буферной системе сильной кислоты протекает реакция:
* А. HPO4 2- + H + 
Б. H2PO4 — + H + 
В. H2PO4 — 
Г. PO4 3- + H + 
40. При добавлении к фосфатной буферной системе щелочи протекает реакция:
А. H3PO4 + OH — 
* Б. H2PO4 — + OH — 
В. HPO4 2- + OH — 
41. При добавлении к аммиачной буферной системе сильной кислоты протекает реакция:
* А. NH3 + H + 
Б. NH4 + + OH — 
В. NH4 + 
Г. NH4 + + HOH 
42. При добавлении к аммиачной буферной системе щелочи протекает реакция:
А. NH3 + H + 
* Б. NH4 + + OH — 
В. NH4 + + HOH 
43. После добавления к фосфатной буферной системе кислоты рН можно рассчитать по формуле:
* А.
Б.
В.
Г.
44. После добавления к ацетатной буферной системе щелочи рН можно рассчитать по формуле:
А.
* Б.
В.
Г.
45. При разбавлении фосфатной буферной системы в 2 раза:
А. pH уменьшится в 2 раза
Б. pH увеличится в 2 раза
* В. pH не изменится
* Г. буферная емкость уменьшится в 2 раза
Д. буферная емкость увеличится в 2 раза
46. Буферная емкость ацетатного буферного раствора при увеличении концентрации его компонентов в 3 раза
* А. увеличится в 3 раза
Б. уменьшится в 3 раза
47. Буферная емкость по кислоте гидрокарбонатного буферного раствора при уменьшении концентрации СО2 в 1,5 раза
А. уменьшится в 1,5 раза
Б. увеличится в 1,5 раза
48. При разбавлении дистиллированной водой фосфатного буферного раствора в 2 раза его буферная емкость
А. увеличится в 2 раза
* Б. уменьшится в 2 раза
49. Буферная емкость максимальна в случае соотношения компонентов буферного раствора:
* А.
Б.
В.
50. При увеличении концентрации уксусной кислоты и ацетата натрия в 2 раза в ацетатной буферной системе:
А. pH уменьшится в 2 раза
Б. pH увеличится в 2 раза
* В. pH не изменится
Г. буферная емкость уменьшится в 2 раза
* Д. буферная емкость увеличится в 2 раза
51. Большее количество щелочи может нейтрализовать фосфатная буферная система с соотношением компонентов:
*А.
Б.
52. Ацетатная буферная система, содержащая 50 мл 0.1н раствора ацетата натрия и 30 мл 0.1 н раствора уксусной кислоты, имеет большую буферную емкость:
*А. по кислоте
53. Для буферных систем одного и того же химического состава с уменьшением концентрации буферная емкость:
А. не изменяется
* В. уменьшается
54. Максимальную буферную емкость имеют кислотные буферные системы, для которых:
* А. pH=pK
* Г.
Д.
55. В ацетатной буферной системе ( 
* А.
Б.
В.
56. В аммиачной буферной системе ( 
А.
Б.
* В.
57. Кислотно-основное равновесие в крови обеспечивается буферными системами:
58. Нормальное значение pH плазмы крови имеет значение:
59. При физиологическом значении pH»7.4 в плазме крови концентрация бикарбонат-ионов:
* А. значительно выше концентрации растворенного в ней углекислого газа
Б. значительно ниже концентрации растворенного в ней углекислого газа
В. равна концентрации растворенного в ней углекислого газа
60. Буферная емкость бикарбонатной буферной системы в плазме крови:
А. выше по щелочи, чем по кислоте
* Б. выше по кислоте, чем по щелочи
В. одинакова по кислоте и щелочи
61. Если в плазме крови при физиологическом значении pH»7.4 соотношение компонентов бикарбонатного буфера 
* А. продуктов кислого характера в 20 раз больше, чем основного
Б. продуктов основного характера в 20 раз больше, чем кислого
62. Избыток молочной кислоты, которая образуется в результате интенсивной физической нагрузки, нейтрализуется в соответствии со схемой:
* А. HLac + HCO3 — 
Б. Lac — + CO2 + H2O 
В. HLac 
* Г. HLac + HPO4 2- 
63. При поступлении в кровь продуктов кислого характера:
* А. увеличивается концентрация углекислого газа, растворенного в плазме
Б. уменьшается концентрация углекислого газа, растворенного в плазме
* В. усиливается вентиляция легких
Г. ослабляется вентиляция легких
* Д. используется щелочной резерв крови
64. При поступлении в кровь продуктов основного характера:
А. увеличивается концентрация углекислого газа, растворенного в плазме
* Б. уменьшается концентрация углекислого газа, растворенного в плазме
В. усиливается вентиляция легких
* Г. ослабляется вентиляция легких
* Д. почки начинают выделять большие количества основных солей
65. Бикарбонатная буферная система нейтрализует в эритроцитах продуктов кислого характера:
А. в 20 раз больше, чем основного
Б. в 20 раз меньше, чем основного
* В. в 7 раз больше, чем основного
Г. в 7 раз меньше, чем основного
66. Буферная емкость бикарбонатной буферной системы по кислоте в эритроцитах по сравнению с плазмой крови:
67. Если в плазме крови при физиологическом значении pH»7.4 соотношение компонентов фосфатного буфера 
* А. продуктов кислого характера в 4 раза больше, чем основного
Б. продуктов основного характера в 4 раза больше, чем кислого
68. Фосфатная буферная система в плазме крови может нейтрализовать:
А. только продукты кислого характера
Б. только продукты основного характера
* В. продукты и кислого, и основного характера
* Г. продуктов кислотного характера больше, чем основного
Д. продуктов основного больше, чем кислотного
69. При нейтрализации фосфатной буферной системой продуктов кислого характера почки выделяют избыток ионов:
* А.
Б.
В.
70. Фосфолипиды клеточных мембран при pH = 7.25 образуют буферную систему:
* А. кислотного типа
Б. основного типа
* В.
Г.
71. В физиологических условиях при рН»7.4 белки плазмы крови (альбумины и глобулины) находятся преимущественно в формах:
А. белок – кислота
* Б. белок – основание
72. В физиологических условиях при рН»7.4 свободные аминокислоты плазмы крови…
* А. практически не проявляют буферного действия
Б. проявляют буферное действие
* В. находятся в анионной форме
Г. находятся в изоэлектрическом состоянии
73. В буферной системе 
* А. белок – основание + H + 
Б. белок — соль + H + 
В. белок — соль 
74. В буферной системе 
А. белок – основание + H2O 
* Б. белок – соль + OH — 
В. белок – основание + H + 
75. В эритроцитах наиболее важными являются буферные системы:
* А.
* Б.
В.
Г.
76. При добавлении кислоты к белковой буферной системе 
* А.
Б.
В.
77. При добавлении кислоты к белковой буферной системе 
А.
* Б.
В.
78. В связывании избытка ионов Н + в крови принимают участие ионы:
* А.
* Б.
В.
* Г.
Д.
79. Поступающий в венозную кровь 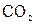
* А.
Б.
В.
Г.
80. Поглощение 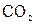
А. HbO2 
* Б. H + + HbO — 2 
* В. HHbO2 
* Г. Hb — + CO2 + H2O 
Д. HHb + O2 
81. Схема Hb — + CO2 
* А. нейтрализации избытка метаболического CO2 в венозной крови
Б. легочной вентиляции
* В. буферного действия гемоглобиновой буферной системы
82. В капиллярах легких протекают реакции:
Б. HHb + HCO — 3 
* В. HHbO2 + HCO — 3 
83. Значение рН буферного раствора, содержащего 10 мл 0.1н раствора уксусной кислоты ( 
84. Гемоглобиновая буферная система является:
85. В бикарбонатной буферной системе при 


86. В фосфатной буферной системе при 

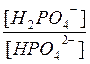
87. Фосфатная буферная система является:
88. Буферная система плазмы, имеющая наибольшую буферную емкость по кислоте:
89. Буферная емкость по кислоте уменьшается в ряду буферных систем плазмы:
А.
Б.
В.
* Г.
90. Значение рН буферного раствора, содержащего 50 мл 0.1н раствора NaH2PO4 и 100 мл 0.05н раствора Na2HPO4 , после добавления к нему 25 мл 0.1н раствора гидроксида натрия рассчитывается по уравнению:
А. рН = рКII + lg
Б. рН = рКII + lg
В. рН = рКII — lg
* Г. рН = рКII + lg
Д. рН = рКII — lg
91. Для получения 110 мл ацетатного буферного раствора, рН которого рассчитывается по уравнению
5.76 = 4.76 + lg 
А. по 55 мл растворов CH3COONa и CH3COOH
Б. 70 мл раствора CH3COONa и 40 мл раствора CH3COOH
В. 30 мл раствора CH3COONa и 80 мл раствора CH3COOH
* Г. 100 мл раствора CH3COONa и 10 мл раствора CH3COOH
Д. 10 мл раствораCH3COONa и 100 мл раствора CH3COOH
92. Значение рН буферного раствора, содержащего 50 мл 0.1н раствора NaH2PO4 и 100 мл 0.05н раствора Na2HPO4 , после добавления к нему 25 мл 0.1н раствора HCl рассчитывается по уравнению:
* А. рН = рКII + lg
Б. рН = рКII + lg
* В. рН = рКII — lg
Г. рН = рКII + lg
Д. рН = рКII — lg
93. Снижение рН крови может происходить в результате:
* А. генерирования CO2 в процессе усвоения пищи
* Б. превращения гемоглобина в оксигемоглобин
В. превращения оксигемоглобина в гемоглобин
* Г. накопления молочной кислоты при физических нагрузках
Д. избыточной вентиляции легких
94. При ацидозе кислотно-щелочное равновесие крови смещается в сторону:
* А. повышения равновесной концентрации ионов H +
Б. понижения равновесной концентрации ионов H +
95. При алкалозе кислотно-щелочное равновесие крови смещается в сторону:
А. повышения равновесной концентрации ионов H +
* Б. понижения равновесной концентрации ионов H +
96. Избыточное количество нелетучей кислоты может удаляться из организма за счет щелочного резерва крови, который обусловлен присутствием в ней:
97. Ацидоз может быть вызван:
А. вдыханием чистого кислорода
* Б. уменьшением вентиляции легких
В. увеличением вентиляции легких
* Г. накоплением в тканях органических кислот
98. Алкалоз может быть вызван:
* А. вдыханием чистого кислорода
* Б. увеличением вентиляции легких
В. уменьшением вентиляции легких
Г. накоплением в тканях органических кислот
* Д. накоплением в крови избытка бикарбонат-ионов
99. Значение рН фосфатной буферной системы может уменьшиться при добавлении к ней:
Б. большого количества гидроксида натрия
* В. большого количества соляной кислоты
* Г. дигидрофосфата натрия
Д. гидрофосфата натрия
100. Значение рН аммиачной буферной системы может повыситься при добавлении к ней:
Видео:Расчёты pH буферных растворов (видео 5) | Буферные растворы | ХимияСкачать

Буферные растворы
Буферные растворы — это растворы, величина рН которых мало изменяется при добавлении к ним небольших количеств сильных кислот или щелочей, а также при разбавлении.
C точки зрения протонной теории простейший буферный раствор состоит из слабой кислоты и сопряженного ей основания или слабого основания и его сопряженной кислоты. В этом случае буферное действие растворов характеризуется наличием кислотно-основного равновесия:
Образуемые сопряженные кислотно-основные пары НА/А– и В/ВН+ называют буферными системами.
Классификация буферных систем
1. Кислотные. Состоят из слабой кислоты и соли этой кислоты. Например, ацетатная буферная система (CH3COOH+ СН3СООNa ), гидрокарбонатная буферная система (H2CO3 +NaHCO3 ).
2. Основные. Состоят из слабого основания и его соли. Например, аммиачная буферная система (NH3⋅H2O + NH4Cl).
3. Солевые. Состоят из кислой и средней соли или двух кислых солей. Например, карбонатная буферная система (NaHCO3+Na2CO3 ), фосфатная буферная система (КН2PO4 + К2НPO4).
4. Аминокислотные и белковые. Если суммарный заряд молекулы аминокислоты или белка равен нулю (изоэлектрическое состояние), то растворы этих соединений не являются буферными. Их буферное действие начинает проявляться тогда, когда к ним добавляют некоторое количество кислоты или щелочи. Тогда часть белка (аминокислоты) переходит из изоэлектрического состояния в форму “белок-кислота” или соответственно в форму “белок-основание”. Образуется смесь двух форм белка: а) слабая “белок-кислота” + соль этой слабой кислоты; б) слабое “белок — основание” + соль этого слабого основания:

Расчет рН буферных систем
Для расчета рН в буферном растворе на примере ацетатного буфера рассмотрим процессы, в нем протекающие, и их влияние друг на друга.
Ацетат натрия практически полностью диссоциирует на ионы, ацетат-ион подвергается гидролизу, как ион слабой кислоты:
CH3COONa → Na+ + CH3COO–
CH3COO– + HOH ⇄ CH3COOH + OH–
Уксусная кислота, также входящая в буфер, диссоциирует лишь в незначительной степени:
CH3COOН ⇄CH3COO– + H+
Слабая диссоциация СН3СООН еще более подавляется в присутствии СН3СООNa, поэтому концентрацию недиссоциированной уксусной кислоты принимаем практически равной ее начальной концентрации:
С другой стороны, гидролиз соли также подавлен наличием в растворе кислоты. Поэтому можно считать, что концентрация ацетат-ионов в буферной смеси практически равна исходной концентрации соли без учета концентрации ацетат-ионов, образующихся в результате диссоциации кислоты:
Согласно закону действующих масс, равновесие между продуктами диссоциации уксусной кислоты и недиссоциированными молекулами подчиняется уравнению:
Кд = 
Подставив общую концентрацию кислоты и соли в уравнение константы диссоциации, получим: [Н+] = Кд
отсюда для кислотных буферных систем: рН = рК(кислоты) + lg 
рК — отрицательный десятичный логарифм константы диссоциации
После аналогичного вывода для основных буферных систем:
рОН = рК(основания) + lg 
где рК(кислоты),рК(основания) — отрицательный десятичный логарифм константы электролитической диссоциации слабой кислоты; слабого основания; [соль] — концентрация соли, [кислота] — концентрация кислоты, [основание] — концентрация основания.
Из этих уравнений видно, что рН кислотной (основной) буферной системы зависит от природы слабого электролита (рК(кислоты), рК(основания)) и от соотношения концентраций соли и кислоты (основания).
Следует отметить, что буферные системы эффективно поддерживают рН в диапазоне: рК(кислоты)± 1 для кислотных систем; 14 – (рК(основания)± 1) для основных систем.
Механизм действия буферных систем:
1. Разбавление. При разбавлении водой происходит уменьшение концентрации обоих компонентов в буферной системе в одинаковой степени, поэтому величина их соотношения не изменится. рК(кислоты) и рК(основания) являются постоянными при данной температуре и не зависят от разбавления. Действительно, одновременное понижение концентраций кислоты и соли в ацетатной буферной системе от 0,1М до 0,001М при разбавлении водой изменяет рН буферного раствора с 4,63 до 4,73 (это ничтожное изменение рН при разбавлении буферного раствора в 100 раз обусловлено некоторым изменением коэффициента активности соли). Следовательно, разбавление в конечном итоге мало изменяет рН буферных систем.
2. Добавление кислот и оснований. При добавлении небольших количеств сильных кислот или оснований рН буферных систем изменяется незначительно. Например, рассмотрим ацетатный буфер:
кислотный компонент – основной компонент–
слабая кислота сопряженное основание
а) При добавлении к ацетатному буферу небольшого количества HCl, происходит взаимодействие ионов Н+ с основным компонентом буферного раствора:
Н+ + СН3СОО–⇄ СН3СООН.
Степень диссоциации СН3СООН мала и концентрация [H+] практически не меняется. рН буферного раствора уменьшится, но незначительно.
Таким образом, если к ацетатному буферу добавить Х моль/л HCl, то уравнение для расчета рН буферной системы принимает вид:
рН = рК(кислоты) + lg
б) При добавлении небольшого количества NaOH, 

В результате этого, добавленное сильное основание заменяется эквивалентным количеством слабого сопряженного основания (СН3СОО–), которое в меньшей степени влияет на реакцию cреды. рН буферного раствора увеличивается, но незначительно.
Таким образом, если к ацетатному буферу добавить У моль/л NaOH, то уравнение для расчета рН буферной системы принимает вид:
рН = рК(кислоты) + lg
Способность буферного раствора сохранять значение рН при добавлении сильной кислоты или щелочи приблизительно на постоянном уровне характеризует буферная емкость.
Буферная емкость (В) — это число молей эквивалента сильной кислоты или щелочи, которое необходимо добавить к 1 л буферного раствора, чтобы сместить его рН на единицу.
Буферная емкость системы определяется по отношению к добавляемым кислоте (Вкисл.) или основанию (щелочи) (Восн.) и рассчитывается по формулам:
Вкисл.= 
где V(HA), V(B) — объемы добавленных кислоты или щелочи, л.; Сн(НА), Сн(В) — молярные концентрации эквивалента соответственно кислоты и щелочи; V(б. р.) — объем исходного буферного раствора, л.; рНо, рН — значения рН буферного раствора до и после добавления кислоты или щелочи; |рН-рНо| — разность рН по модулю.
Буферная емкость по отношению к кислоте (Вкисл.) определяется концентрацией (количеством эквивалентов) компонента с основными свойствами; буферная емкость по отношению к основанию (Восн.) определяется концентрацией (количеством эквивалентов) компонента с кислотными свойствами в буферном растворе.
Максимальная буферная емкость при добавлении сильных кислот и оснований достигается при соотношении компонентов буферного раствора равном единице, когда рН = рК, при этом Восн.= В кисл. (рис.1).Поэтому, применение любой буферной смеси ограничено определенной областью рН (областью буферирования), а именно:
рН = рК(кислоты)± 1 для кислотных систем, или
рН= 14 – (рК(основания)± 1) для основных систем.
Буферная емкость зависит не только от отношения концентраций компонентов буферного раствора, но и от общей концентрации буферной смеси.
Рис.1. Изменение буферной емкости в зависимости от величины отношения [соль]/[кислота].
Пусть, например, даны два буферных раствора, один из которых содержит по 100, а другой – по 10 миллимолей уксусной кислоты и ацетата натрия. Сравним, как изменяются их рН при добавлении к 1 л каждого раствора 5 миллимолей соляной кислоты.
Добавляемая кислота вступит в реакцию с ацетатом натрия, и это отношение в первом растворе станет равным 0,9, а во втором 0,33. В итоге у первого раствора отношение соль/кислота и, следовательно, величина рН изменились меньше. Отсюда видно, что первый буферный раствор обладает большей буферной емкостью.
Таким образом, буферная емкость в основном зависит от соотношения концентраций компонентов и их абсолютных концентраций, а следовательно, от разбавления.
Буферные системы организма
Главным источником ионов водорода в организме является углекислый газ, образующийся в результате метаболизма (обмена веществ) ≈ 15000 ммоль/сутки.
Гидратация углекислого газа приводит к образованию угольной кислоты:
СО2 + Н2О ⇄ Н2СО3⇄ 
В меньшей степени количество ионов Н+ (30–80 ммоль/сутки) обусловлено поступлением в организм, а также образованием в нем таких кислот как серной (в результате обмена серусодержащих аминокислот), фосфорной (при метаболизме фосфорсодержащих соединений), органических кислот, образующихся при неполном окислении липидов и углеводов.
Организм освобождается от кислот благодаря процессам дыхания и мочевыделения, т. е. в организме существует взаимосвязь между метаболическими процессами и газообменом. В оценке кислотно-основного состояния организма важно не только определение значения рН, но и характеристика механизмов, обеспечивающих регуляцию этого параметра.
Если бы в организме не было немедленных буферных механизмов и респираторной (дыхательной) компенсации, то тогда даже обычные, ежедневные нагрузки кислотами сопровождались бы значительными колебаниями величины рН.
Постоянство рН жидких сред организма поддерживается в живых организмах буферными системами. Главным из них являются гидрокарбонатная, гемоглобиновая, фосфатная и белковая. Действие всех буферных систем в организме взаимосвязано, что обеспечивает биологическим жидкостям постоянное значение рН. В организме человека и животных буферные системы находятся в крови (плазме и эритроцитах), в клетках и межклеточных пространствах других тканей.
Буферные системы крови представлены буферными системами плазмы крови и буферными системами эритроцитов. Буферные системы плазмы – гидрокарбонатная, белковая и фосфатная, роль последней незначительна. На их долю приходится ≈ 44% буферной емкости крови. Буферные системы эритроцитов – гемоглобиновая, гидрокарбонатная, система органических фосфатов (фосфатная). На их долю приходится ≈ 56% буферной емкости крови.
🔍 Видео
Буферные растворы. Практическая часть. 11 класс.Скачать

Буферные растворы. 2 часть. 11 класс.Скачать

Буферные системы, ацидоз и алкалоз, ур-ие Гендерсона-Гассельбаха (Атриум и Учим химию)Скачать

Буферная ёмкость (видео 7) | Буферные растворы | ХимияСкачать

Связь pH и pKa для буферных растворов (видео 6) | Буферные растворы | ХимияСкачать
Буферные системы. рНСкачать

Примеры решения задач на водородный показатель pH растворов. 11 класс.Скачать

Расчет рН растворов сильных и слабых кислот. Химия для поступающих.Скачать

Вывод формулы для расчета pH буферного раствораСкачать

Буферные растворыСкачать

Примеры решения задач на водородный показатель pH растворов. 11 класс.Скачать

Буферные системыСкачать

Введение в буферные растворы (видео 1) | Буферные растворы | ХимияСкачать

лекция 4 Протолитическая теория Буферные системы Решение задачСкачать

Химия 3.Буферные растворыСкачать

3 5 Буферные растворыСкачать

Уравнение Гендерсона-ХассельбахаСкачать