Более точную но сравнению с правилом Вант-Гоффа зависимость скорости химической реакции от температуры установил шведский химик Сванте-Август Аррениус (1859—1927).
Уравнение Аррениуса описывает влияние температуры на константу скорости химической реакции к в уравнении Гульдберга и Вааге и имеет вид
или в логарифмической записи
Здесь к <)— предэкспоненциальный множитель. По физическому смыслу эта величина отражает число активных столкновений частиц в единице объема реакционной смеси. Для большинства химических реакций второго порядка значения к0 = 10 И -И0 13 лДмоль с); ЕА — экспериментальная энергия активации.
Энергия активации — избыток энергии (но отношению к средней энергии частиц при данной температуре), который необходимо иметь частице для того, чтобы при данных условиях вступить в реакцию.
Избыток получается за счет хаотической природы температуры. При всяком среднем значении кинетической тепловой энергии в системе в ней всегда присутствуют как более медленные, так и более быстрые частицы. Те из них, у которых избыток скорости достаточно велик, и обладают нужной энергией активации. Отметим, что влияние температуры на скорость химических реакций значительно выше при низких температурах, чем при высоких. Экспоненциальный множитель в уравнении Аррениуса выражает ту долю частиц, у которых энергия равна или больше энергии активации. Энергия активации выражается в энергетических единицах, отнесенных к одному молю реагирующих частиц, и имеет размерность [кДж/моль].
Исходя из логарифмической формулы уравнения Аррениуса часто находят экспериментальную энергию активации, построив график зависимости 1п& =/(1/7) (рис. 12.3).
По экспериментальным точкам строится прямая, которая отсекает на оси ординат отрезок, равный 1п к0, а угол а связан с энергией активации ЕА соотношением
При этом нужно помнить, что Еа — величина размерная, поэтому для расчета tga нужно брать не геометрические отрезки на рисунке, а их размерные значения из экспериментальных данных.
Рис. 12.3. Нахождение энергии активации из графика зависимости k =/(1/7)
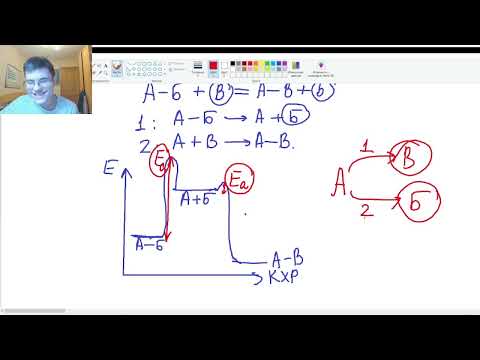
Энергетическая диаграмма реакции. Изобразим изменения энергии Е в системе
вдоль некоторой траектории, которую назовем путем реакции Я. Полученная кривая носит название энергетической диаграммы реакции (рис. 12.4).
Рис. 12.4. Энергетическая диаграмма реакции:
Е — средняя энергия теплового движения реагентов при условиях протекания реакции, Ег — энергия, необходимая для преодоления тех сил отталкивания, которые возникают между частицами на близких расстояниях, ЕА — энергия активации, Е] и Е2 — энергия продуктов реакции при значениях теплового эффекта Я, и Н2 соответственно
Видео:Химия | Тепловой эффект химической реакции (энтальпия)Скачать

Энергия активации реакции (процесса). Экспериментальной определение величины энергии активации.(см №42 тоже)
Зависимость скорости реакции от температуры дает уравнение Аррениуса:

где k — константа скорости реакции, R — универсальная газовая постоянная, Е — энергия активации химической реакции. В случае простых реакций величина Е показывает, какой минимальной (избыточной по сравнению со средней) энергией в расчете на 1 моль должны обладать реагирующие частицы, чтобы они могли вступить в химическую реакцию. В случае сложных реакций величина Е называется эмпирической или кажущейся энергией активации и в общем случае зависит от энергий активации отдельных стадий данной реакции.
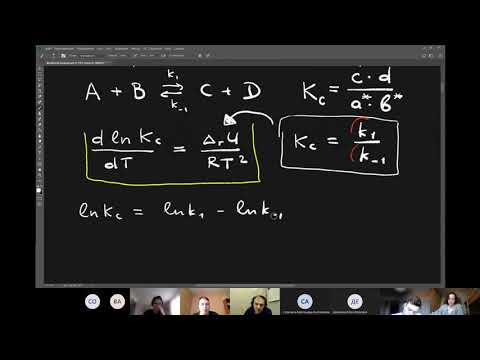
Проинтегрировав уравнение (10.16), получим уравнение Аррениуса в интегральной форме:


где А — предэкспоненциальный множитель. Физический смысл А в случае простых реакций: мономолекулярных — это частота колебаний по разрываемой связи (А » 10 13 сек -1 ), бимолекулярных — величина А пропорциональна общему числу столкновений между молекулами реагирующих веществ (А » 10 -10 ¸ 10 -11 см 3 /(мол-л·сек).
Проинтегрировав ур-е (10.16) в пределах температур от Т1 до Т2, получим:

 |
Энергию активации можно определить как аналитически по уравнению (10.18), так и графическим методом. Для этого необходимо знать ряд констант скоростей при разных температурах. Если реакция подчиняется уравнению Аррениуса, то зависимость lnk от 1/T должна выражаться прямой линией, что следует из уравнения (10.17) (рис. 7).
Рис. 7 К расчету энергии активации реакции по температурной зависимости константы скорости. Для очень большого числа реакций энергия активации находится в пределах от 60 до 240 кДж/моль, т.е. примерно соответствует энергиям химических связей. Энерг актив. Связана с Q10: Е=0,46T1*T2lgQ10
Энергии активации большинства биологических процессов того же порядка, что и для химических реакций. Они группируются в основном у трех величин — 8, 12 и 18 ккал/молъ. Однако в процессах разрушения клеток различными токсическими факторами энергии активации очень велики — порядка 150 ккал/молъ. Такая же высокая энергия активации характерна для реакций денатурации белка. Например, для свертывания гемоглобина — 60 ккал/молъ, для гемолиза при действии горячей воды энергия активации равна 64 ккал/молъ, для бактериолиза В. paratyphosus в феноле — 48,6 ккал/молъ.
Для ферментативных реакций характерны более низкие значения энергии активации. Согласно современным представлениям, ускорение реакции в присутствии ферментов связано с тем, что фермент образует комплекс с субстратом. При этом конфигурация электронного облака реагирующей молекулы изменяется так, что облегчается ее вступление в реакцию, и, следовательно, уменьшается энергия активации реакции. Например, энергия активации гидролиза сахарозы при действии амилазы равна 11 ккал/молъ, а при действии кислот — 25,6 ккал/молъ.
Для фотохимических процессов в клетках Eакт очень низка, например 500—1000 кал/моль для процессов, протекающих в сетчатке глаза.
Энергия активации связана с коэффициентом Вант-Гоффа следующим соотношением:
| Eакт = 0,46Т1 · Т2lgQ10. |
Возрастание скорости реакции при увеличении температуры происходит тем быстрее, чем больше энергия активации реакции. Поэтому, если процесс осуществляется конкурирующими реакциями, скорость которых по-разному зависит от температуры, при низких температурах основной выход продукта будет идти за счет реакции с малой энергией активации, а при повышении температуры будет возрастать роль реакции, имеющей большую энергию активации. В случае последовательных реакций скорость суммарного процесса будет определяться скоростью наиболее медленно протекающей реакции. При низкой температуре более медленно протекающей реакцией может быть реакция с большей энергией активации, а при повышении температуры — реакция с меньшей энергией активации.
Видео:Использование уравнения Аррениуса для решения задач (1/2). Химия для поступающих.Скачать

Методы расчета энергии активации химической реакции
Читайте также:
|
 |
Аналитический способ:
Энергию активации химической реакции можно вычислить по значениям констант скоростей при двух различных температурах по уравнению:
 |
Отсюда, уравнение для расчета энергии активации имеет вид:
 |
Теоретический вывод уравнения Аррениуса сделан для элементарных реакций, но опыт показывает, что подавляющее большинство сложных реакций также подчиняются этому уравнению.
Дата добавления: 2015-01-30 ; просмотров: 125 | Нарушение авторских прав
📸 Видео
Влияние температуры на скорость химических реакций. 10 класс.Скачать

Энергия активации химической реакцииСкачать

Порядок реакции и энергия активацииСкачать

Химическая кинетика. Скорость химической реакции | ХимияСкачать

Занятие 4. "Энергетический профиль химической реакции".Скачать
Тепловой эффект хим. реакции. Энтальпия. Закон Гесса. Капучинка ^-^Скачать

Решение задач на термохимические уравнения. 8 класс.Скачать

Введение в кинетикуСкачать

Скорость химических реакций. 9 класс.Скачать

Естествознание 10 класс (Урок№42 - Движение как качественное изменение. Химические реакции.)Скачать

07 Кинетика 5 эксп опред параметров реакцииСкачать

Лекция 13 || 2021 || Температурная зависимость скорости, уравнение Аррениуса, энергия активацииСкачать
ДВИ по химии. Термохимия. Уравнение Аррениуса, закон Гесса, задачи на теплоемкостьСкачать

РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Уравнение Аррениуса, часть 1Скачать

Как выучить Химию с нуля за 10 минут? Принцип Ле-ШательеСкачать

Лекция 8: уравнение Аррениуса (30.10.2019)Скачать

Химическая кинетика. Формальная кинетика простых гомогенных реакций в закрытых системахСкачать








 Энергия активации – избыточная энергия, которой должны обладать частицы для вступления в химическую реакцию. Энергия активации является постоянной величиной для данной химической реакции и практически не зависит от температуры.
Энергия активации – избыточная энергия, которой должны обладать частицы для вступления в химическую реакцию. Энергия активации является постоянной величиной для данной химической реакции и практически не зависит от температуры. Графический способ: Энергию активации графическим способом можно найти, если прологарифмировать уравнение Аррениуса:
Графический способ: Энергию активации графическим способом можно найти, если прологарифмировать уравнение Аррениуса: