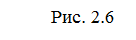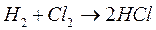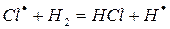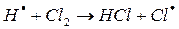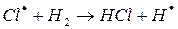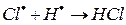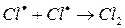Читайте также:
|
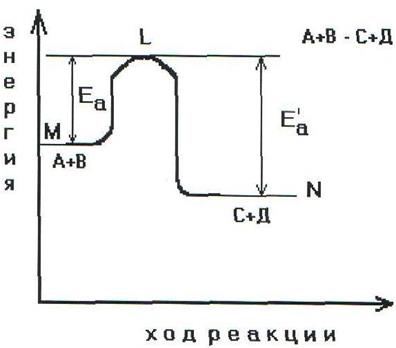 |
Энергетическая диаграмма хода реакции с образованием
Чтобы реагирующие вещества А и В образовали продукты реакции С и Д они должны преодолеть энергетический барьер МL. На это затрачивается энергия активации Еа. При этом в ходе реакции из частиц реализующих веществ, образуется промежуточная неустойчивая группировка — активированный комплекс (рис.2.6).
Этот комплекс распадается с образованием конечных продуктов, причем выделяется такое количество энергии, которое позволяет конечным продуктам спуститься до уровня средней энергии конечных продуктов.
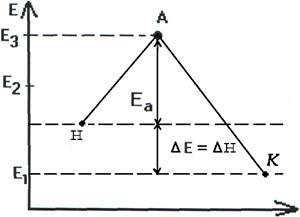
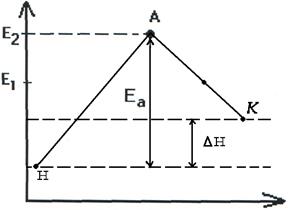
Т.о. изменение продуктов можно выразить в виде схем для эндотермической и экзотермической реакции (рис.2.7, 2.8).
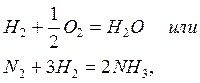 |
Обычно реакции между веществами с прочными ковалентными связями характеризуются большими значениями Еа и идут медленно. Это относится ко многим взаимодействиям, как
скорость которых при стандартных условиях равна 0.

Катализ
Общие понятия.
Катализом называется ускорение скорости реакции в присутствии специфических веществ, количество которых в ходе реакции не изменяется.
Эти вещества только ускоряют скорость реакции, но не расходуются в результате ее протекании.
Катализаторы могут участвовать в образовании промежуточных продуктов реакции, но к концу взаимодействия полностью регенерируются.
Замедление реакций осуществляется при помощи ингибиторов(отрицательных катализаторов).
– При катализе не изменяется величина теплового эффекта реакции.
– Если катализируемая реакция обратима, катализатор не влияет на равновесие, не меняет Кр и равновесных концентраций компонентов системы. Он в равной степени ускоряет прямую и обратную реакцию.
– Катализаторы действуют избирательно, селективно.
Катализатор, активно ускоряющий одно взаимодействие, безразличен к другому.
Из одних и тех же веществ можно получить различные продукты, применяя разные катализаторы.
Некоторые вещества снижают или полностью уничтожают активность катализатора их называют каталитическими ядами – соединения мышьяка, свинца, цианида.
Добавки, увеличивающие активность катализатора называют промоторами.
Активность, селективность и срок службы катализатора во многом зависит от температуры каталитической реакции.
Существуют катализаторы, не обладающие специфичностью, их называют универсальными. К ним относятся металлические Nl, Pt, палладий, которые катализируют процессы гидрирования, окисления. Многие процессы являются автокаталитическими. В этих реакциях катализатором служит один из продуктов.
Цепные реакции
Под цепными реакциями понимают такие химические реакции, в которых появление промежуточно-активной частицы вызывает большое число (цепь) превращений исходныхмолекул.
В качестве активной частицы выступают свободные атомы, возбужденные молекулы –радикалы – частицы, имеющие один неспаренный электрон.
Большую роль в создании учения цепных реакций сыграли работы
Н. Н. Семенова и С. Хиншельвуда, которые за исследования в этой области получили Нобелевскую премию (1956 г).
Цепные реакции составляют основу многих практически важных процессов (крекинга, полимеризации, сгорания топлива и т. п.).
Различают 3 типа цепных реакций:
1. С неразветвленными цепями
2. С разветвленными цепями
3. С вырожденно-разветвленными
Каждый тип реакций включает 3 этапа — зарождение цепей, их развитие и обрыв.
Химические процессы с неразветвленными цепями можно рассмотреть на примере взаимодействия между водородом и хлором:
Подумайте, какая молекула — водорода или хлора — может распасться на атомы. Энергия связи молекулы водорода равна 436 кДж/моль, хлора 243. Конечно, будет происходить распад молекулы хлора.
Если смесь 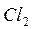
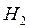
Схему реакции по этапам можно записать так:
а) 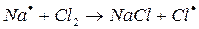


в)
г)


е)
ж)
На первом этапе в реакциях зарождения цепей (а) образуется активная частица – свободный радикал или атом (С1). Большая скорость цепных реакций объясняется высокой реакционной способностью активных частиц.
На втором этапе развития реакций (б-г) активная частица реагирует с молекулой исходного вещества с образованием молекулы продукта с новой активной частицей. Регенерированная новая частица снова реагирует с молекулой и т. д. Таким образом, образуется неразветвленная цепь с
большим числом звеньев.
Энергия активации взаимодействия радикалов или атомов с молекулами не превышает 40 кдж/моль. Длина цепи из элементарных химических реакций достигает 10 тысяч и сотен тысяч звеньев.
На третьем этапе происходит обрыв цепей (д-ж). Она происходит в результате соединения (рекомбинации) атомов в объеме реактора, захвата его стенкой с последующей рекомбинацией на стенки, образованием неактивного радикала при взаимодействии активных частиц с примесями (они играют роль ингибиторов).
Дата добавления: 2018-11-25 ; просмотров: 2445 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Видео:Влияние температуры на скорость химических реакций. 10 класс.Скачать

Уравнение Аррениуса. Энергия активации химической реакции





Видео:Порядок реакции и энергия активацииСкачать

Уравнение Аррениуса. Энергия активации химической реакции
- Уравнение Аррениуса. Энергия химической активации Вы. Формулы (V.19) и (V.20) являются только приблизительными Зависимости u = f (T) и k = f (T). Зависит от функции Константа скорости химической реакции k от температуры Обновлено шведским ученым С. Аррениусом (1889): * = (V. 2 1) Где А — предэкспоненциальный фактор. EA-acty energy.
- Реакция реакции; Т — абсолютная температура К. В химической кинетике часто используется уравнение Арре. Хорошая логарифмическая форма; в * = -E>, / RT + nA. (V.22) Из уравнения (V.22) зависимость постоянной равна Температура роста химической реакции встроена в кору Создайте чернила / T, линейные (рисунок V.3). Эта зависимость Энергию активации реакции Ea можно определить по тангенсу угла.
Наклон линии вдоль разреза и предэкспоненциальный множитель А Если ku, 1/7 = 0, обрезать вертикальную ось. Людмила Фирмаль
Исследование советских химиков (В. И. Гольданский и др.) Ультранизкая температура (ниже точки кипения азота -77 К) показала Закон Аррениуса для серии взаимодействий при очень низких температурах Остановите поведение, потому что 1 р / г зависит от 1 / т. Рис, v.u. Зависит от Химическая скорость Температура реакции Рига V.4. ^ Постоянная зависимость Скорость реакции от темпа Отклонение от Ирати: Аркениус (Рисунок V L) нелинейный.
Скорость таких реакций низкая Температура (Т ^ 10К) составляет Уравнение Аррениуса. Уравнение Аррениуса имеет две [величины; £ a и A Некоторые характеристики каждой реакции. Их фи Логический смысл получается по следующим причинам: Неплохо Предпосылки для инициирования химических взаимодействий между Две молекулы должны столкнуться.
Но не все Молекулярные столкновения заканчиваются действием химических взаимодействий Действия, то есть не все коллизии действительны. Также процент Как правило, общее количество эффективных столкновений Незначительный, большинство столкновений между молекулами Не вызывает реакции. Это можно легко проверить, рассчитав Возможное число на основе газовой кинетики.
Молекулярные столкновения и соответствующие скорости Сравните реакцию, затем ожидание (с расчетом 100% Эффективность) фактическая скорость; первое во мне Последние несколько раз. Аррениус предположил, что химический Действия выполняются только между этими конфликтами Молекулы, которые достигли определенной энергии.
Характерный уровень этой реакции, ее энергия Барьеры. Если такая молекула считается активной, эффект Столкновения происходят только между активами Pattern. Все молекулы в системе с низким накоплением энергии Энергетический барьер реакции находится в особом состоянии, Обычно это называется переходным состоянием или активным состоянием.
Комплекс, можно предположить, что система настроена Институт Активации комплекса характеризуется тем, что он в нем Уже нет исходного материала, но нет продукта реакции [1; Исходный материал передается продукту реакции. Принципиальная схема Переход лыж от исходных материалов A и B к продукту реакции C А через активированный комплекс А …
В состояние Иллюстрация льна. D.5 *. R. При взятии среднего уровня энергии исходной молекулы Вещество в системе равно £ |, а средняя энергия перехода Разность состояний E’-E представляет энергию Активация этой реакции, системная энергия (рисунок U.5) Переходное состояние максимально. Это значит Купальные сооружения очень нестабильны.
В процессе реакции он Расширяется до произведения взаимодействий C и O. На рассмотрении В этом примере средний уровень энергии молекул продукта реакции Е 2 ниже среднего уровня энергии исходной молекулы Вещество E . Это означает, что процесс будет продолжен с назначением Энергия (экзотермическая реакция). Средняя энергия молекул продукта реакции £ 2.
Может быть выше, чем средний энергетический уровень молекулы источника Детали E 1 (рисунок U.b). Процесс переходит к поглощению энергии. Гии (эндотермическая реакция) из окружающей среды. разница £ 2-¿ 1 равно тепловому эффекту процесса АЭ. Энергия активации является одним из основных параметров. ry характеризует скорость химического взаимодействия. стабилитрон Активация Процесс активации зависит от характера реакции Висячие.
- Чем выше энергия активации, тем меньше Равное условие) скорость реакции. Энергия активации Необходим в основном для ослабления химических связей Преодоление отталкивания с исходным материалом Электроны, генерируемые, когда молекулы и атомы объединяются Предотвращает взаимодействие веществ и их столкновения. Реакция между веществами, которые обычно имеют сильные ковалентные связи Облигации £ Медленно.
Это относится ко многим взаимодействиям Взаимодействие с органическим веществом Н2 + У2 0 2 = П20 и л и Н 2 + ЗЫ2 = 2НХ², скорость равна Стандартное условие практически нулевое. небольшой „„ И очень высокая скорость характеризуется ионами Взаимодействие в электролите (например: + 5 0 4 ’= $ 04 или Ag при * * + SG ‘= AgCl).
Это В связи с тем, что противоположно заряженные ионы притягиваются друг к другу. Людмила Фирмаль
Будьте друзьями и не нужно тратить энергию на преодоление силы Отталкивание взаимодействующих частиц. Простой расчет энергии активации химической реакции Согласно уравнению Аррениуса (U.22) значение известно Константы скорости k / -и k-1 при разных температурах: кг: I—, / I 1 (D.23) • nramot () и [) обрабатывают координаты реакции. Ход реакции. Axhibiro Bunny. С комплексом … LN 0 Координаты реакции Рис, д.5.
Диаметр энергии Граммы лихорадки Акии Координаты реакции Рисунок D.6. Диаметр энергии Грамм для эндотермы реакция Дает энергию активации нескольких химических реакций После: N20, -2N02, Hg + 12 ^ 2H1 C2H4 + I2 — CrNb, 2H1-Hg + b. C2H5Br ^ C2H4 + HBr. C H 4 C + 2H, Е д = 54,4 кДж / моль, £ = 165,5 кДж / моль, EV = 180,5 кДж / моль L ‘= 186,4 кДж / моль, £ = 218,0 кДж / мл £ = 334,7 кДж / моль, Обычно реакция ->! При 50 кДж / моль, Не протекать при комнатной температуре.
Замечательная энергия активации Это расстройство движения, Многие химические взаимодействия не остывают Рассмотрено с точки зрения химической термодинамики (DO •




















































Образовательный сайт для студентов и школьников
Копирование материалов сайта возможно только с указанием активной ссылки «www.lfirmal.com» в качестве источника.
© Фирмаль Людмила Анатольевна — официальный сайт преподавателя математического факультета Дальневосточного государственного физико-технического института
💡 Видео
Скорость реакции. Химия – ПростоСкачать

Уравнение Аррениуса, часть 1Скачать

Энергия активации химической реакцииСкачать

Занятие 4. "Энергетический профиль химической реакции".Скачать
Лекция 13 || 2021 || Температурная зависимость скорости, уравнение Аррениуса, энергия активацииСкачать
Лекция 21 Об энергии активацииСкачать

Влияние концентрации на скорость химических реакций. 10 класс.Скачать

ДВИ по химии. Термохимия. Уравнение Аррениуса, закон Гесса, задачи на теплоемкостьСкачать

Успенская И. А. - Химическая термодинамика и кинетика - Методы определения энергии активацииСкачать

Скорость химических реакций. 9 класс.Скачать

Экзо- и эндотермические реакции. Тепловой эффект химических реакций. 8 класс.Скачать

Химическая кинетика. Скорость химической реакции | ХимияСкачать

Физическая химия #3. Первый, второй и третий порядки химической реакции. Времена полупревращенияСкачать

Как выучить Химию с нуля за 10 минут? Принцип Ле-ШательеСкачать

Катализ. 10 класс.Скачать

Задачи на скорость реакции в зависимости от концентрации реагентовСкачать

Химическая кинетика. Формальная кинетика простых гомогенных реакций в закрытых системахСкачать


 :
: (1.1)
(1.1) , моль/(л . с)- для гомогенного катализатора (1.2)
, моль/(л . с)- для гомогенного катализатора (1.2) , моль/(кг . с)-для гетерогенного катализатора (1.3)
, моль/(кг . с)-для гетерогенного катализатора (1.3) — приращение времени (с), V — объем реакционной массы (л).
— приращение времени (с), V — объем реакционной массы (л).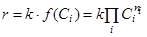 (1.4)
(1.4) (1.6)
(1.6)
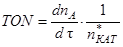 (1.7)
(1.7) (1.8)
(1.8)
 ,[1/с] или [м 3 /кг . с] (1.11)
,[1/с] или [м 3 /кг . с] (1.11) (1.12)
(1.12)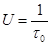 , [1/с] (1.13)
, [1/с] (1.13)
 , (кг или моль)/((л или кг)с) (1.14)
, (кг или моль)/((л или кг)с) (1.14)