- Реферат.Справочник
- Контрольные работы по химии
- Эндотермическая реакция взаимодействия метана с диоксидом углерода протекает по уравнению
Условие
Эндотермическая реакция взаимодействия метана с диоксидом углерода протекает по уравнению CH4(г) + CO2 = 2CO(г) + 2H2(г); ΔH = +247,37 кДж. При какой температуре начнется эта реакция? Дано: ΔH = 247,37 кДж S⁰(CH4(г)) =186,2Джмоль*К S⁰(CO2(г))= 213,5Джмоль*К S⁰(CО(г)) =197,6Джмоль*К S⁰( H2(г)) =130,6Джмоль*К
Ответ
реакция начнется при температуре 963,7К
Решение
CH4(г) + CO2 = 2CO(г) + 2H2(г) Т = ΔHΔS ΔS = ƩS⁰прод — ƩS⁰исх.= = (2 * S⁰( CO2(г)) + 2 * S⁰( H2(г))) – (S⁰(CH4(г)) + S⁰( CO2(г))) ΔS = (2 * 197,6 + 2 * 130,6) – (186,2 + 213,5) = =256,7 Дж/моль*К = 0,2567 кДж/моль*К Т = 247,370,2567 = 963,7 К Следовательно, реакция начнется при температуре 963,7К Ответ: реакция начнется при температуре 963,7К
Видео:Решение задач на термохимические уравнения. 8 класс.Скачать

Эндотермическая реакция взаимодействия метана с оксидом углерода (IV) протекает по уравнению CH4(г)+CO2(г)=2CO(г)+2H2(г); ΔH298
Видео:Экзо- и эндотермические реакции. Тепловой эффект химических реакций. 8 класс.Скачать

Ваш ответ
Видео:Уравнивание реакций горения углеводородовСкачать

решение вопроса
Видео:ЭКЗО- и ЭНДО- термические реакции. Химия – ПростоСкачать

Похожие вопросы
- Все категории
- экономические 43,399
- гуманитарные 33,632
- юридические 17,905
- школьный раздел 607,960
- разное 16,854
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Видео:Тепловой эффект хим. реакции. Энтальпия. Закон Гесса. Капучинка ^-^Скачать

Примеры решения задач по Химии
| 1. Эндотермическая реакция взаимодействия метана с диоксидом углерода протекает по уравнению CH4(г) + СO2(г) = 2СО(г) + 2Н2(г); ?Н = +247,37 кДж. При какой температуре начнется эта реакция? |
Решение
CH4(г) + СO2(г) = 2СО(г) + 2Н2(г); Н = +247,37 кДж.
DS =( 197,9 х2 + 130,59х2) – 186,19 + 213,65 = 257,14 Дж
Вычисляем DGo реакции:
DG = DH – TDS = 247,37 – 298 257,14= +55,28 кДж.
Так как DG > 0, то реакция при стандартных условиях невозможна; наоборот, при этих условиях идет обратная реакция
Найдем температуру, при которой DG = 0:
Т = ?Н / ?S = 247,37 / 0,257 =961,9 K.
Следовательно, при температуре » 961,9 K начнется реакция .
уравнением:
CH3OH(ж) + 1?O2(г) = CO2(г) + 2H2O(ж); ?H = ?
Вычислите тепловой эффект этой реакции, если известно, что мольная теплота парообразования CH3OH(ж) равна
+ 37,4 кДж.
Решение
?H(СН3ОН(ж.)) = -238,7 кДж/моль
?Н(Н2O(ж.)) = -285,84 кДж/моль
?Н(СО2(г.)) = -393,51 кДж/моль
?Н(О2) = 0
?Н(общ.) = Н(прод.) — Н(исх.) = (-393,51) + 2*(-285,84) + 238,7 = -726,49 кДж
а) 6,02•1022 молекул С2Н2;
б) 1,8•1024 атомов азота;
в) 3,01•1023 молекул NН3.
Какова мольная масса указанных веществ.
Решение
Моль — это такое количество вещества (или его порция), которое содержит 6,02 • 1023 (округленно 6 · 1023 частиц (молекул, атомов или других частиц).
NA= 6,02 • 1023 моль-1 = 6,02 • 1023
n = N / NA
а) 6,02•1022 молекул С2Н2;
n =6,02•1022/ 6,02 • 1023=0,1 моль
б) 1,8•1024 атомов азота;
n =1,8•1024 /6,02 • 1023= 2,9 моль
в) 3,01•1023 молекул NН3.
n =3,01•1023 /6,02 • 1023= 0,5 моль
Решение.
Эквивалентные массы вычисляются по закону эквивалентов, который математически может быть выражен зависимостью:
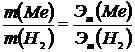
где 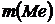
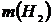
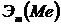
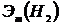
Если одно из веществ находится в газообразном состоянии, то, как правило, его количество измеряется в объемных единицах. Поэтому целесообразно воспользоваться следующей зависимостью:
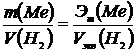
В результате получаем:
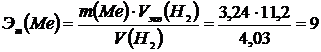
Аг = 9·3 = 27.
Решение
Квантовые числа – энергетические параметры, определяющие состояние электрона и тип атомной орбитали, на которой он находится.
Главное квaнтовое число n определяет общую энергию электрона и степень его удаления от ядра (номер энергетического уровня); оно принимает любые целочисленные значения, начиная с 1 (n = 1, 2, 3, . . .)
Орбитальное (побочное или азимутальное) квантовое число l определяет форму атомной орбитали. Оно может принимать целочисленные значения от 0 до n-1 (l = 0, 1, 2, 3,…, n-1). Каждому значению lсоответствует орбиталь особой формы. Орбитали с l = 0 называются s-орбиталями,
l = 1 – р-орбиталями (3 типа, отличающихся магнитным квантовым числом m), l = 2 – d-орбиталями (5 типов), l = 3 – f-орбиталями (7 типов).
Магнитное квантовое число mопределяет ориентацию орбитали в пространстве относительно внешнего магнитного или электрического поля. Его значения изменяются от +l до -l, включая 0. Например, при l = 1 число mпринимает 3 значения: +1, 0, -1, поэтому существуют 3 типа р-АО:  рx, рy, рz.
Спиновое квантовое число s может принимать лишь два возможных значения +1/2 и -1/2. Они соответствуют двум возможным и противоположным друг другу направлениям собственного магнитного момента электрона, называемого спином (от англ. веретено). Для обозначения электронов с различными спинами используются символы: ^ и v.
🎬 Видео
Химическое равновесие. Закон действующих масс.Скачать

Химия | Тепловой эффект химической реакции (энтальпия)Скачать

Органическая Химия — ЭТО НУЖНО ВИДЕТЬ! Гибридизация орбиталейСкачать

Новые 28 задачи на примесь ЕГЭ по химии 2023 | Екатерина СтрогановаСкачать

Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Обратимость и необратимость химических реакций. Химическое равновесие. 1 часть. 9 класс.Скачать

29. Общая реакция горения для всех углеводородов. Как расставить коэффициенты реакции легкоСкачать

Галилео. Эксперимент. Эндотермическая реакцияСкачать

Термохимические уравнения. Решение задач из ЕГЭ на тепловой эффект.Скачать

78. Тепловой эффект реакции. Термохимические уравнения (часть 1)Скачать

Оксид углерода(II). Угарный газ. Состав. Строение. Получение. СвойстваСкачать

Установление эмпирической и молек. формул по массовым долям элем., входящих в состав в-ва. 10 класс.Скачать

Тепловой эффект реакции. Экзотермические и эндотермические реакцииСкачать

Горение. 7 класс.Скачать

Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать




