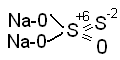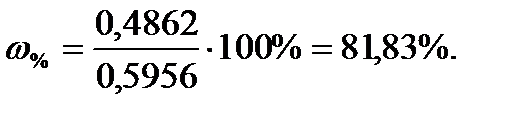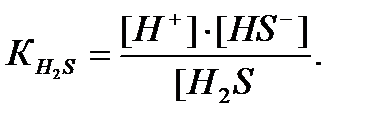- Электролиз раствора серной кислоты
- Электролиз растворов солей нитрата серебра (I), сульфата меди (II) и хлорида золота (III)
- Электролиз раствора серной кислоты с медным (активным) анодом
- Электролиз
- Электролиз
- Электролиз растворов
- Катодные процессы
- Анодные процессы
- Суммарные процессы электролиза
- Электролиз расплавов
- Электролиз с растворимыми электродами
- 📽️ Видео
Видео:Все об электролизе и задании 20 за 20 минут | Химия ЕГЭ 2023 | УмскулСкачать

Электролиз раствора серной кислоты
Задача 39.
Вычислить массу газа, выделившегося на аноде при электролизе раствора серной кислоты, производившегося в течение 10 мин при силе тока 3 А.
Решение:
р-р H2SO4;
t = 10 мин = 600 с;
I = 3 A;
F = 96 500 Кл/моль
m (O2) — ?
Электролиз раствора серый кислоты сводится к электролизу воды:
На электродах протекают следующие реакции:
Катод: 2|2Н + + 2 
Анод: 1|2H2O — 4 
После сокращения ионов водорода в левой и правой частях уравнения, получим:
Так как на аноде выделяется кислород:
2H2O — 4 
m(O2) = [M(O2) . I . t]/(n . F) = (32 г/моль . 3 А . 600 с)/ (4 . 96500 A . c/моль) = 0,15 г.
Электролиз растворов солей нитрата серебра (I), сульфата меди (II) и хлорида золота (III)
Задача 40.
Через последовательно включенные в цепь постоянного тока растворы нитрата серебра (I), сульфата меди (II) и хлорида золота (III) пропускали ток силой в течение 20 мин. Рассчитайте массы металлов, осевших на катоде.
Решение:
р-ры AgNO3; CuSO4; AuCl3
I = 2,5 A
t = 20 мин = 1200 с
F = 96500 Кл/моль
m (Ag) — ?
m (Cu) — ?
m (Au) — ?
1) Все металлы, катионами которых образованы данные соли, находятся в ряду активности металлов «после водорода», значит на катодах будет протекать реакция восстановления только металлов:
►Ag + + 1 
►Cu 2+ + 2 
►Au 3+ + 3 
2) По формуле объединенного закона электролиза:
m (в-ва) = [M(в-ва) . I . t]/(n . F)
Вычисляем массы металлов, получим:
m(Ag) = (108 г/моль . 2,5 А . 1200 с)/ (1 . 96500 A . c/моль) = 3,358 = 3,36 г;
m(Cu) = (64 г/моль . 2,5 А . 1200 с)/ (2 . 96500 A . c/моль) = 0,995 = 1,00 г;
m(Au) = (197 г/моль . 2,5 А . 1200 с)/ (3 . 96500 A . c/моль) = 2,042 = 2,00 г;
Ответ: m(Cu) = 1 г, m(Ag) = 3,36 г, m(Au) = 2 г.
Видео:Электролиз раствора серной кислоты с растворимым анодомСкачать

Электролиз раствора серной кислоты с медным (активным) анодом
Наливают в U-образную трубку 1М раствор серной кислоты. Опускают угольный и медный электроды в раствор Н2SO4. Угольный электрод соединяют с катодом, а медный — с анодом источника тока (выпрямителя). Пропускают через раствор электрический ток в течение 8 — 10 минут с напряжением 8 — 10 В. Наблюдают за процессом, протекающим на катоде. Отмечают, что в начале опыта на катоде выделяется водород, затем, по мере окраски раствора в голубой цвет, катод покрывается слоем меди.
Записывают уравнения катодного и анодного процессов, протекающих при электролизе раствора серной кислоты.
В выводах укажите:
— В чем причина появления окраски раствора кислоты в голубой цвет?
— Почему скорость выделения водорода со временем уменьшается, а на катоде начинает осаждаться медь?
— Предложите методику электролитической очистки (рафинирования «черновой» меди).
Опыт 2. Электролиз раствора хлорида олова (2+)
Заполняют электролизер раствором хлорида олова (2+). В оба колена электролизера опускают угольные электроды, соединяющие электроды с источником постоянного тока. Через 1-2 минуты после включения тока на угольном катоде наблюдают появление блестящих кристалликов металлического олова.
С целью выявления свободного хлора после окончания опыта добавляют в анодное пространство 3-4 капли раствора иодида калия и такой же объем раствора крахмала. Для этого предварительно отключают ток, анод вынимают из электролизера и промывают водой. Наблюдают появление синей окраски.
Записывают уравнения катодного и анодного процессов, протекающих при электролизе раствора хлорида олова (2+), а также суммарное уравнение.
В выводах укажите:
— Какое вещество накапливается в растворе в катодном пространстве; как доказать его присутствие?
Опыт 3. Электролиз раствора йодида калия
Наливают в электролизер раствор йодида калия. Опускают в оба колена электролизера угольные электроды, подключают их к источнику постоянного тока. На катоде наблюдают выделение газа. Через 4-5 минут отключают ток, вынимают электроды и добавляют в катодное пространство 2-4 капли раствора фенолфталеина.
С анодного пространства отбирают пипеткой 2-3 капли раствора, переносят их в пробирку и разбавляют дистиллированной водой до слабо-желтого цвета. В пробирку добавляют 1-2 капли раствора крахмала.
Записывают наблюдения, составляют схему электролиза и уравнения реакций, протекающих на электродах.
В выводах укажите:
— Почему на катоде не выделяется металлический калий?
— Появление каких ионов обусловило окраску раствора в катодном пространстве в красный цвет?
— Что произошло с йодид-ионами на аноде и чем обусловлено посинение раствора анодного пространства после добавления к нему крахмала?
Опыт 4. Электролиз раствора сульфата натрия
Наливают в электролизер раствор сульфата натрия. Опускают в оба колена электролизера угольные электроды, подключают их к источнику постоянного тока. Наблюдают выделение газа на катоде и аноде. Через 5 — 7 минут отключают электролизер, вынимают электроды и добавляют по 2 — 3 капли раствора лакмуса в оба отростка электролизера.
Записывают наблюдения, составляют схему электролиза и уравнения реакций, протекающих на электродах.
В выводах укажите:
— Какой газ выделялся на катоде и на аноде?
— Какие ионы обусловили окраску лакмуса в катодном пространстве в синий цвет, а в анодном пространстве в красный цвет?
— Какова роль Na2SO4 в процессе электролиза раствора данной соли?
— Предложите другие соли, электролиз водных растворов которых проходил бы аналогично.
Опыт 5. Нанесение гальванопокрытий (элементы НИРС)
Гальваническими называют металлические покрытия, нанесенные на поверхность изделия методом электролиза. Нанесение гальванопокрытий проводят с целью придания изделию красивого внешнего вида, коррозионной стойкости, повышенной твердости поверхностного слоя. Наиболее широко в промышленности используют покрытие никелем (никелирование), цинком (цинкование), оловом (лужение), хромом (хромирование), медью (меднение) и др.
Для гальванотехники используется низкое напряжение в пределах 2 — 12 В и большой ток (до 100 А и более). Для мелких деталей в лабораторных условиях часто достаточно батареи аккумуляторов или обычного выпрямителя тока. Электрический ток регулируют реостатами в анодной цепи (положительный полюс). Туда же включается и амперметр для его измерения. Нанесение металлических покрытий выполняется в специальных ваннах или сосудах. Небольшие детали можно покрывать в стеклянных и керамических стаканах или ванночках.
Для получения высококачественного покрытия детали предварительно должны быть хорошо очищены от всех наслоений. Это выполняется механически (шлифовкой, щеткой) или химическим путем (удаление ржавчины). Затем поверхность перед погружением в электролит необходимо тщательно обезжирить (химическим или электролитическим путем) и промыть проточной водой.
Растворы, используемые для гальванопокрытий, как правило, многокомпонентные и содержат, кроме солей металла, различные добавки, увеличивающие электропроводность растворов (чаще всего сульфат натрия), активирующие анодные процессы (хлорид натрия или аммония), корректирующие рН растворов (борная кислота ) и др. Разработкой таких составов занимаются целые научные лаборатории и коллективы. Поэтому всегда необходимо четко и строго соблюдать инструкции и режимы электролиза при выполнении работ по электролитическому осаждению металлов. Полезным пособием для ознакомления с основами электротехники является книга: Шкержик Я. Рецептурный справочник для электротехника. — М.: Энергоиздат, 1989. — 142 с.
Заполняют электролитические ванны соответствующими сложными растворами (табл. 12). К катоду присоединяют пластинку металла, на который будет нанесено покрытие.
Анодом служит металл, указанный в таблице 12.
Т а б л и ц а 12
Состав растворов для электролитического осаждения металлов
| Вариант | Состав растворов | Аноды |
| ZnSO4×7H2O – 300 г/л | Цинковый | |
| Al2(SO4)3 – 30 г/л | ||
| Na2SO4×10H2O – 50 г/л | ||
| КAl(SO4)2×12H2O – 50 г/л | ||
| NiSO4×7H2O – 300 г/л | Никелевый | |
| Na2SO4×10H2O – 100 г/л | ||
| NaCl –10 г/л | ||
| Н3PO4 — 30 г/л |
Пропускают через раствор электрический ток в течение 20-30 минут с напряжением 8 — 10 В. Наблюдают за процессом, протекающим на катоде. Отмечают, выделяется ли на катоде вместе с металлом водород. Оценивают визульно качество покрытия. Записывают уравнения катодного и анодного процессов, протекающих при нанесении гальванопокрытия.
В выводах укажите:
— Какую роль выполняют компоненты сложных составов, используемых в гальванике.
— Какими методами наносят металлопокрытия на сложнопрофильные детали?
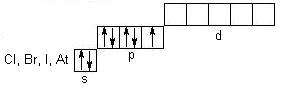
Свойства неметаллов VIIА группы (F, Cl, Br, I)
Элементы VIIА группы (F, Cl, Br, I, At) относятся к семейству р-электронных аналогов и имеют общую формулу ns 2 np 5 . В ряду от F до At радиус атомов возрастает, а энергия ионизации уменьшается, и, как следствие, неметаллические свойства ослабевают. В невозбужденном состоянии распределение электронов по квантовым ячейкам такое:
Итак, у атома фтора нет вакантной d-орбитали, поэтому для него возможна только отрицательная степень окисления: — 1 (HF, NaF). Для Cl, Br, I наиболее характерны степени окисления: — 1, 0, +1, +3, +5, +7. Фтор — один из самых сильных окислителей (окислительно-восстановительный потенциал E 0 F2/2F- = +2,87 B). В атмосфере фтора сгорают большинство металлов и неметаллов, органические вещества. Фтор окисляет даже инертные газы (за исключением гелия, неона и аргона):
Xe + 2F2 = XeF4; ΔH 0 = — 252 кДж/моль.
С другими галогенами фтор образует интергалиды (ClF, ClF3, BrF5, IF5, IF7). В оксиде фтора F2O кислород имеет формальную степень окисления +2, с водородом фтор образует газ HF, водный раствор которого представляет собой слабую кислоту (HF)2 — димер (для 0,1 н. HF α = 0,08). В отличие от водородных соединений других галогенов, для H2F2 известны «кислые» соли (KHF2), а также комплексные соединения типа K[H2F3], K[H3F4], K[H4F5]. Комплексные фториды — многочисленны, координационное число металлов в них 4, 6, 7, но может повышаться до 8 и даже 9: K 2[BeF4], K3[AlF6], K2[NbF7], K2[WF8], K2[ReF9].
Следует обратить внимание на различия свойств хлора, брома и йода от свойств фтора. Их окислительно-восстановительные потенциалы равны +1,36; +1,08; +0,53 В соответственно; следовательно, в этом же ряду окислительные свойства галогенов ослабевают. В нулевой степени окисления эти галогены проявляют окислительно-восстановительную двойственность, например:
Cl2 0 + H2O ↔ HCl -1 + HOCl +1
Галиды металлов, как правило, хорошо растворяются в воде и некоторых органических растворителях, но хлориды, бромиды и йодид Ag + и [Hg2 2+ ] нерастворимы (отметим, что AgF и Hg2F2, наоборот, хорошо растворяются в воде). Водородные соединения (НЭ) — газы, водные растворы которых известны, как сильные кислоты: α для 0,1 н. растворов HCl, HBr, HI (составляет соответственно 92,6; 93,5; 95%. Известны кислородные соединения галогенов: Э2O, ЭO2 (оксид Э2O3 не существует), ЭО3 (Э2О5 не существует) и Э2О7; они представляют собой ангидриды кислот НОЭ , НЭО2, НЭО3, НЭО4 (Э — галоген). Оксиды ClO2 и ClO3 в водных растворах диспропорционирует по схемам:
Kислоты НОЭ — слабые, НЭО2 — неустойчивые, НЭО3, НЭО4 представляют собой сильные кислоты. Их соли используют в качестве окислителей, причем, окислительные свойства возрастают в ряду от НОЭ до НОЭ4. Хлориды, бромиды и йодиды входят как лиганды в состав комплексных соединений, но координационное число металлов в большинстве случаев не превышает 4 и 6.
Задача 1. При электролизе раствора NaCl на аноде выделилось 2,24 л хлора. Какие продукты и в каком количестве образовались на катоде и в растворе?
Решение. Схема электролиза водного раствора NaCl:
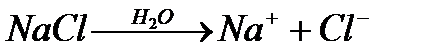
На аноде: 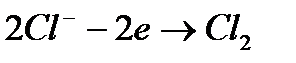
На катоде: 
Согласно суммарным уравнением, при образовании 1 моля Cl2 (22,4 л) на катоде выделяется 1 моль Н2 (22,4 л), а в растворе образуется 2 моля NaOH (то есть, 40·2 = 80 г). По условиям задачи выделилось 2,24 л Cl2, что составляет 2,24: 22,4 = 0,1 моль. Итак, объем Н2 равен 2,24 л, а масса NaOH – 8 г.
Задача 2. В трех стаканах без этикеток находятся растворы KCl, KBr, KI . Предложите, каким образом можно определить каждую из солей.
Решение. Реагентом на галогениды является раствор AgNO3, при добавлении которого выпадают осадки: AgCl (белый), AgBr (бледно-желтый), AgI (желтый). При этом AgCl хорошо растворим в аммиаке с образованием комплексного соединения [Ag(NH3)2]Cl, а AgBr и AgI нерастворимы в аммиаке. Кроме того, отделить KBr и KI от KCl можно с помощью окислителей (хлорная вода, KMnO4):
2Br — + Сl2 = Br2 + 2Cl — (желтый цвет);
2I — + Cl2 = I2 + 2Cl — (коричнево-бурый цвет).
Свободный йод обнаруживают крахмалом, который окрашивается в синий цвет. Соли Cu 2+ с ионом I — образуют соли закиси меди с выделением свободного йода (Cl — и Br — не дают аналогичной реакции):
Соли Рb 2+ образуют с солями I — желтый осадок PbI2 (осадки PbCl2 и PbBr2 белого цвета).
Задача 3. Сравните рН 0,1 н растворов HCl и HF.
Решение. Соляная кислота — сильная кислота. Поэтому рН = -lgCHCl = -lg10 -1 = 1.
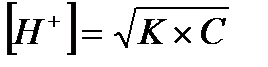

Плавиковая кислота HF — слабая (KHF = 6,6·10 -4 ; рК = 3,18). В таком случае
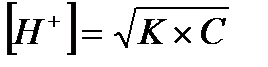
Получение хлора, брома, йода (выполняется в вытяжном шкафу!)
а) В три пробирки насыпают небольшое количество порошков MnO2, KMnO4, K2Cr2O7 и добавляют около 1 мл концентрированной соляной кислоты HCl (ρ = 1,19 г/см 3 ). При необходимости слегка подогревают. Образование хлора наблюдают на фоне белой бумаги. Написать уравнения соответствующих реакций и подсчитать Э.Д.С.
б) одну пробирку насыпают небольшое количество кристаллического KBr, а во вторую — KI, добавляют в каждую из них на кончике шпателя порошка MnO2, перемешивают и добавляют несколько капель концентрированной H2SO4, слегка подогревают. Наблюдают выделение газообразные брома и йода, отмечают их цвет. Написать уравнения соответствующих реакций.
Опыт 2. Свойства галогенов
а) В растворов KI, KBr добавляют 1-2 мл хлорной воды. Наблюдают образование I2 и Br2 по изменению окраски растворов.
б) К растворов KCl и KI добавляют бромную воду. Записывают наблюдения, составляют уравнения реакций и дают объяснения отличий реакций, посчитав Э.Д.С.
в) В две пробирки помещают небольшое количество кристаллического йода. В первую пробирку добавляют приблизительно 2 мл воды, а во вторую столько же спирта. Отмечают различную растворимость I2. В пробирку с водой и I2 добавляют несколько капель раствора КI наблюдают растворение кристаллического йода. Дать объяснение, записав в последнем случае уравнение реакции образования комплексного соединения.
Опыт 3. Свойства галогенидов
а) В четыре пробирки наливают отдельно по 1-2 мл растворов F — , Cl — , Br — , I — и добавляют 3-4 капли раствора AgNO3. Отмечают, в каком случае произошла реакция. Осадки проверяют на растворимость в избытке концентрированного раствора NH3. По таблице находят произведение растворимости галогенов серебра.
б) К растворам соли Pb 2+ в четырех пробирках добавляют по каплям растворы солей
F — , Cl — , Br — , I — . Отмечают, в каких случаях образуется осадок. Подогревают пробирки до кипения и вновь охлаждают. Записывают наблюдения, находят по таблице ПР галогенидов свинца.
в) Проводят аналогичные опыты с раствором CaCl2.
Опыт 4. Восстановительные свойства галогенидов
а) В три пробирки наливают отдельно по 1-2 мл раствора KMnO4, добавляют разбавленной серной кислоты и далее — в первую пробирку приливают примерно 1 мл раствора КCl, во вторую — KBr, в третью — КI. Отмечают, где произошла реакция. Повторяют опыт, заменив KMnO4 на K2Cr2O7. Записывают уравнения реакций. Подсчитывают Э.Д.С. и делают выводы.
б) К раствору CuSO4 добавляют избыток раствора КI. Наблюдают образование белого осадка йодида меди (1+) и выделения йода. Записывают уравнение окислительно-восстановительной реакции.
Опыт 5. Окислительные свойства хлоратов, броматов, йодатов
В три пробирки наливают по 1-2 мл соответственно растворов KClO3, KBrO3, KIO3, добавляют разбавленную серную кислоту и раствор KBr. Записывают наблюдения. Повторяют опыт, заменив раствор KBr на КI. Составляют уравнения реакций и подсчитывают Э.Д.С.
Опыт 6. Образование ацидокомплексов
а) К раствору соли Hg 2+ добавляют по каплям раствор КI. Наблюдают выпадение красноватого осадка, который далее растворяется в избытке КI.
б) Отбирают в пробирку небольшое количество хлорида меди (2+) кристаллогидрата и добавляют примерно 1 мл концентрированной соляной кислоты. Наблюдают образование зеленого раствора комплексного соединения меди (2+). Добавляют некоторое количество Н2О до перехода зеленого цвета раствора в голубой. По таблице находят константу нестойкости комплексного иона, делают вывод.
в) К раствору соли Fe 3+ добавляют 2-3 капли раствора роданида калия KSCN. Наблюдают образование комплексного соединения железа (3+) темно-красного цвета. Добавляют к нему несколько кристаллов фторида калия или натрия, перемешивают до обесцвечивания раствора за счет образования более устойчивого комплексного иона [FeF6] 3- . Записывают уравнения соответствующих реакций.
Свойства неметаллов VIА группы (O, S, Se, Te)
Электронная формула элементов VIА группы — ns²np 4 , то есть, они относятся к семейству р-электронных аналогов. Как и для элементов VII группы, первый представитель — кислород 8О — не имеет вакантных d-орбиталей, в отличие от элементов 16S, 34Se и 52Te, и поэтому по свойствам резко отличается от остальных.
Как и фтор, кислород — сильный окислитель; он образует соединения почти со всеми элементами (кроме He, Ne, Ar). По электроотрицательности кислород уступает только фтору. В большинстве соединений степень окисления кислорода равна -2. Но формальная степень окисления может быть и другой: -1 (в пероксидах, озонидах), а также +1, +2 и +4 в соединениях со связью O-O (Н.С Ахметов «Общая и неорганическая химия. — М.: Высш. шк., 2001-743с.) H2O -2 ; Н2О2 -1 ; KO 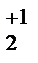
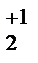
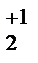
Следует обратить внимание на кислотно-основные свойства оксидов (основные, кислотные, амфотерные), их растворимость в воде, кислотах, щелочах. В степени окисления -1 (перекиси) кислород может проявлять свойства как окислителя (а), так и восстановителя (б):
а) 2KI -1 + Na2O 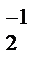

б) 2КMn +7 O4 + 5H2O 

Сильным окислителем является озон, который окисляет даже ртуть (меркурий) и серебро (аргентум):
Элементы сера, селен и теллур, как и кислород, имеют 6 валентных электронов, но отличаются от него наличием вакантной d-орбитали и, как следствие, проявлением парной степени окисления: -2, +2, +4, +6, что можно объяснить участием в образованные химических связей двух неспаренных электронов, а также одной или двух электронных пар. Сера (сульфур) — типичный неметаллический элемент; по электроотрицательности (2,5) она уступает только галогенам, кислороду и азоту.
Все три элемента — S, Se, Te — существуют в различных модификациях, которые отличаются не только структурой, но прежде всего, физическими и химическими свойствами. С металлами они реагируют при различных температурах, образуя сульфиды, селениды и теллуриды. Для серы характерно образование гомоцепочек -S (-S)n-, например, полисульфиды натрия: Na2S + (n-1) S = Na2Sn. В природе распространенным является минерал пирит FeS2, который представляет собой персульфид Fe(II). Полисульфиды и, прежде всего, персульфиды, как и перекиси, проявляют восстановительные и окислительные свойства и также диспропорционируют:
Водородные соединения (H2Э, H2Э2) — газы, а в растворе — слабые кислоты. Наиболее устойчивыми кислородсодержащими соединениями являются ЭО2 и ЭО3 — ангидриды кислот Н2ЭО3 (слабые) и Н2ЭО4 (сильные) (Э = S, Se, Te).
Стоит обратить внимание на окислительно-восстановительные свойства элементов в степени окисления +4 (окислительно-восстановительная двойственность) и +6 (сильные окислители), а также различия во взаимодействии с металлами серной (сульфатной) кислоты различной концентрации. На практике часто используется серосодержащие кислоты и их соли необычного, на первый взгляд, состава:
H2SО5 (НООSO2OH) — пероксосерная (пероксосульфатная) кислота (кислота Каро);
H2SхО6 (х = 2 
Как восстановитель, часто используется тиосульфат (гипосульфит) натрия, Na2S2O3, который имеет структуру:
Задача 1. Навеску технической соли BaCl2·2H2O 0,5965г обрабатывали избытком серной кислоты. Масса осадка бария сульфата после прокаливания составляла 0,4646г. Определите содержание чистого кристаллогидрата BaCl2·2H2O в технической соли.
Решение: Анализ соли бария проводили согласно уравнению:
Таким образом, 233,40 г BaSO4 соответствуют 244,30 г BaСl2·2H2O
Содержание чистого BaСl2·2H2O в технической соли составляет:
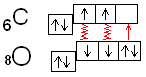
Задача 2. Определите [H + ] в 0.025 М растворе H2S.
Решение: Раствор H2S в воде представляет собой слабую кислоту, для которой К1 = 1·10 -7 , а К2 = 1,2∙10 -18 .
Практически все ионы Н + образуются за счет диссоциации кислоты по первой стадии:
а уравнение константы диссоциации имеет вид:
Если обозначить [H + ] = [HS — ] = x, то получим К = 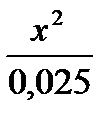
Отсюда х = [H + ] = 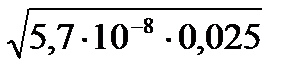
Задача 3. Относительная электроотрицательность (χ) кислорода 3,5, а углерода 2,5. Несмотря на это, распределение зарядов в молекуле угарного газа таков: δ- СО +δ . Как объяснить такое распределение зарядов с точки зрения метода валентных связей (ВС)? Решение: Распределение электронной плотности при образованные молекулы СО можно показать графически:
В молекуле СО два связи образуются по ковалентному механизму, а один — по донорно-акцепторному (дативному) механизму. В последнем случае донором электронной пары является кислород, акцептором — атом углерода. Итак, распределение электронной плотности такой:
Видео:Электролиз. 10 класс.Скачать

Электролиз
Видео:Электролиз кислоты с медным анодом / electrolysis of acid with copper anodeСкачать

Электролиз
Химические реакции, сопровождающиеся переносом электронов (окислительно-восстановительные реакции) делятся на два типа: реакции, протекающие самопроизвольно и реакции, протекающие при прохождении тока через раствор или расплав электролита.
Раствор или расплав электролита помещают в специальную емкость — электролитическую ванну .
Электрический ток — это упорядоченное движение заряженных частиц — ионов, электронов и др. под действием внешнего электрического поля. Электрическое поле в растворе или расплаве электролита создают электроды .
Электроды — это, как правило, стержни из материала, проводящего электрический ток. Их помещают в раствор или расплав электролита, и подключают к электрической цепи с источником питания.
При этом отрицательно заряженный электрод катод — притягивает положительно заряженные ионы — катионы . Положительно заряженный электрод ( анод ) притягивает отрицательно заряженные частицы ( анионы ). Катод выступает в качестве восстановителя, а анод — в качестве окислителя.
Различают электролиз с активными и инертными электродами. Активные (растворимые) электроды подвергаются химическим превращениям в процессе электролиза. Обычно их изготавливают из меди, никеля и других металлов. Инертные (нерастворимые) электроды химическим превращениям не подвергаются. Их изготавливают из неактивных металлов, например, платины , или графита .
Видео:Часть 3-2. Электролиз водных растворов. Примеры решений уравнений (подробно).Скачать

Электролиз растворов
Различают электролиз раствора или расплава химического вещества. В растворе присутствует дополнительное химическое вещество — вода, которая может принимать участие в окислительно-восстановительных реакциях.
Катодные процессы
В растворе солей катод притягивает катионы металлов. Катионы металлов могут выступать в качестве окислителей. Окислительные способности ионов металлов различаются. Для оценки окислительно-восстановительных способностей металлов применяют электро-химический ряд напряжений :
Каждый металл характеризуется значением электрохимического потен-циала. Чем меньше потенциал , тем больше восстановительные свойства металла и тем меньше окислительные свойства соответствующего иона этого металла. Разным ионам соответствуют разные значения этого потенциала. Электрохимический потенциал — относительная величина. Электрохимический потенциал водорода принят равным нулю.
Также около катода находятся молекулы воды Н2О. В составе воды есть окислитель — ион H + .
При электролизе растворов солей на катоде наблюдаются следующие закономерности:
1. Если металл в соли — активный ( до Al 3+ включительно в ряду напряжений ), то вместо металла на катоде восстанавливается (разряжается) водород , т.к. потенциал водорода намного больше. Протекает процесс восстановления молекулярного водорода из воды, при этом образуются ионы OH — , среда возле катода — щелочная:
2H2O +2ē → H2 + 2OH —
Например , при электролизе раствора хлорида натрия на катоде будет вос-станавливаться только водород из воды.
2. Если металл в соли – средней активности (между Al 3+ и Н + ) , то на катоде восстанавливается (разряжается) и металл , и водород , так как потенциал таких металлов сравним с потенциалом водорода:
Me n+ + nē → Me 0
2 H + 2O +2ē → H2 0 + 2OH —
Например , при электролизе раствора сульфата железа (II) на катоде будет восстанавливаться (разряжаться) и железо, и водород:
Fe 2+ + 2ē → Fe 0
2 H + 2O +2ē → H2 0 + 2OH —
3. Если металл в соли — неактивный (после водорода в ряду стандартных электрохимических металлов) , то ион такого металла является более сильным окислителем, чем ион водорода, и на катоде восстанавливается только металл:
Me n+ + nē → Me 0
Например, при электролизе раствора сульфата меди (II) на катоде будет восстанавливаться медь:
Cu 2+ + 2ē → Cu 0
4. Если на катод попадают катионы водорода H + , то они и восстанавливаются до молекулярного водорода:
2H + + 2ē → H2 0
Анодные процессы
Положительно заряженный анод притягивает анионы и молекулы воды. Анод – окислитель. В качестве восстановителей выступаю либо анионы кислотных остаток, либо молекулы воды (за счет кислорода в степени окисления -2: H 2 O -2 ).
При электролизе растворов солей на аноде наблюдаются следующие закономерности:
1. Если на анод попадает бескислородный кислотный остаток , то он окисляется до свободного состояния (до степени окисления 0):
неМе n- – nē = неМе 0
Например : при электролизе раствора хлорида натрия на аноде окисляют-ся хлорид-ионы:
2Cl — – 2ē = Cl2 0
Действительно, если вспомнить Периодический закон: при увеличении электроотрицательности неметалла его восстановительные свойства уменьшаются. А кислород – второй по величине электроотрицательности элемент. Таким образом, проще окислить практически любой неметалл, а не кислород. Правда, есть одно исключение . Наверное, вы уже догадались. Конечно же, это фтор. Ведь электроотрицательность фтора больше, чем у кислорода. Таким образом, при электролизе растворов фторидов окисляться будут именно молекулы воды, а не фторид-ионы :
2H2 O -2 – 4ē → O2 0 + 4H +
2. Если на анод попадает кислородсодержащий кислотный остаток, либо фторид-ион , то окислению подвергается вода с выделением молекулярно-го кислорода:
2H2 O -2 – 4ē → O2 0 + 4H +
3. Если на анод попадает гидроксид-ион, то он окисляется и происходит выделение молекулярного кислорода:
4 O -2 H – – 4ē → O2 0 + 2H2O
4. При электролизе растворов солей карбоновых кислот окислению под-вергается атом углерода карбоксильной группы, выделяется углекислый газ и соответствующий алкан.
Например , при электролизе растворов ацетатов выделяется углекислый газ и этан:
2 CH3 C +3 OO – –2ē → 2 C +4 O2+ CH3-CH3
Суммарные процессы электролиза
Рассмотрим электролиз растворов различных солей.
Например , электролиз раствора сульфата меди. На катоде восстанавливаются ионы меди:
Катод (–): Cu 2+ + 2ē → Cu 0
На аноде окисляются молекулы воды:
Анод (+): 2H2 O -2 – 4ē → O2 + 4H +
Сульфат-ионы в процессе не участвуют. Мы их запишем в итоговом уравнении с ионами водорода в виде серной кислоты:
2 Cu 2+ SO4 + 2H2 O -2 → 2 Cu 0 + 2H2SO4 + O2 0
Электролиз раствора хлорида натрия выглядит так:
На катоде восстанавливается водород:
Катод (–): 2 H + 2O +2ē → H2 0 + 2OH –
На аноде окисляются хлорид-ионы:
Анод (+): 2 Cl – – 2ē → Cl2 0
Ионы натрия в процессе электролиза не участвуют. Мы записываем их с гидроксид-анионами в суммарном уравнении электролиза раствора хлорида натрия :
2 H + 2O +2Na Cl – → H2 0 + 2NaOH + Cl2 0
Следующий пример : электролиз водного раствора карбоната калия.
На катоде восстанавливается водород из воды:
Катод (–): 2 H + 2O +2ē → H2 0 + 2OH –
На аноде окисляются молекулы воды до молекулярного кислорода:
Анод (+): 2H2 O -2 – 4ē → O2 0 + 4H +
Таким образом, при электролизе раствора карбоната калия ионы калия и карбонат-ионы в процессе не участвуют. Происходит электролиз воды:
2 H2 + O -2 → 2 H2 0 + O2 0
Еще один пример : электролиз водного раствора хлорида меди (II).
На катоде восстанавливается медь:
Катод (–): Cu 2+ + 2ē → Cu 0
На аноде окисляются хлорид-ионы до молекулярного хлора:
Анод (+): 2 Cl – – 2ē → Cl2 0
Таким образом, при электролизе раствора карбоната калия происходит электролиз воды:
Cu 2+ Cl2 – → Cu 0 + Cl2 0
Еще несколько примеров: электролиз раствора гидроксида натрия.
На катоде восстанавливается водород из воды:
Катод (–): 2 H + 2O +2ē → H2 0 + 2OH –
На аноде окисляются гидроксид-ионы до молекулярного кислорода:
Анод (+): 4 O -2 H – – 4ē → O2 0 + 2H2O
Таким образом, при электролизе раствора гидроксида натрия происходит разложение воды, катионы натрия в процессе не участвуют:
2 H2 + O -2 → 2 H2 0 + O2 0
Видео:Серная кислота из медного купоросаСкачать

Электролиз расплавов
При электролизе расплава на аноде окисляются анионы кислотных остатков, а на катоде восстанавливаются катионы металлов. Молекул воды в системе нет.
Например: электролиз расплава хлорида натрия. На катоде восстанавли-ваются катионы натрия:
Катод (–): Na + + ē → Na 0
На аноде окисляются анионы хлора:
Анод (+): 2 Cl – – 2ē → Cl2 0
Суммарное уравнение электролиза расплава хлорида натрия:
2 Na + Cl – → 2 Na 0 + Cl2 0
Еще один пример: электролиз расплава гидроксида натрия. На катоде восстанавливаются катионы натрия:
Катод (–): Na + + ē → Na 0
На аноде окисляются гидроксид-ионы:
Анод (+): 4 OH – – 4ē → O2 0 + 2H2O
Суммарное уравнение электролиза расплава гидроксида натрия:
4 Na + OH – → 4 Na 0 + O2 0 + 2H2O
Многие металлы получают в промышленности электролизом расплавов.
Например , алюминий получают электролизом раствора оксида алюминия в расплаве криолита. Криолит – Na3[AlF6] плавится при более низкой температуре (1100 о С), чем оксид алюминия (2050 о С). А оксид алюминия отлично растворяется в расплавленном криолите.
В растворе криолите оксид алюминия диссоциирует на ионы:
На катоде восстанавливаются катионы алюминия:
Катод (–): Al 3+ + 3ē → Al 0
На аноде окисляются алюминат-ионы:
Анод (+): 4Al O 3 3 – – 12ē → 2Al2O3 + 3 O2 0
Общее уравнение электролиза раствора оксида алюминия в расплаве криолита:
2 Al 2 О 3 = 4 Al 0 + 3 О 2 0
В промышленности при электролизе оксида алюминия в качестве электродов используют графитовые стержни. При этом электроды частично окисляются (сгорают) в выделяющемся кислороде:
C 0 + О2 0 = C +4 O2 -2
Видео:ЭлектролизСкачать

Электролиз с растворимыми электродами
Если материал электродов выполнен из того же металла, который присут-ствует в растворе в виде соли, или из более активного металла, то на аноде разряжаются не молекулы воды или анионы, а окисляются частицы самого металла в составе электрода.
Например , рассмотрим электролиз раствора сульфата меди (II) с медными электродами.
На катоде разряжаются ионы меди из раствора:
Катод (–): Cu 2+ + 2ē → Cu 0
На аноде окисляются частицы меди из электрода :
Анод (+): Cu 0 – 2ē → Cu 2+
📽️ Видео
Электролиз: как понять и научиться писать реакции электролиза? | Химия ЕГЭ 2022 | УмскулСкачать

Азотная кислота и металлы за 13 минут | ХИМИЯ ЕГЭ | СОТКАСкачать

Электролиз растворов. 1 часть. 10 класс.Скачать

Закон ФарадеяСкачать

При электролизе раствора серной кислоты на аноде выделилось 16,8 л (н.у.) газообразного вещества.Скачать

РАСТВОРЯЕМ МЕТАЛЛЫ ЭЛЕКТРИЧЕСТВОМ! Электролиз с растворимым анодом.Скачать

Растворитель ЗОЛОТА = Белизна + Уксусная кислота 70Скачать

Электролиз растворов. 2 часть. 10 класс.Скачать

Серная кислота и металлы за 10 минут | ХИМИЯ ЕГЭ | СОТКАСкачать

Электролиз. Часть 1. Процесс электролиза, основные закономерности.Скачать

Как писать уравнения электролиза? | Химия ЕГЭ 2022 | УмскулСкачать

Гальванические элементы. 1 часть. 10 класс.Скачать

Взаимодействие серной кислоты с металламиСкачать