Марганцевокислый калий (перманганат калия) KMnO4 представляет собой соль марганцевой кислоты HMnO4. Плотность KMnO4 составляет 2,703 г/см 3 , растворимость KMnO4 в воде при 20 °С—6,4 г на 100 г H2O, а при 60 °С 22,2 г. Перманганат калия KMnO4 является сильным окислителем. При смешении его с концентрированной H2SO4 (а также с глицерином и некоторыми другими веществами) может произойти взрыв. KMnO4 — термически неустойчивая соль, при нагревании >200 °С разлагается по схеме
Результаты новых исследований термической диссоциации KMnO4 в токе кислорода показали, что процесс протекает в две стадии:
с тепловыми эффектами при 225 и 660 °С.
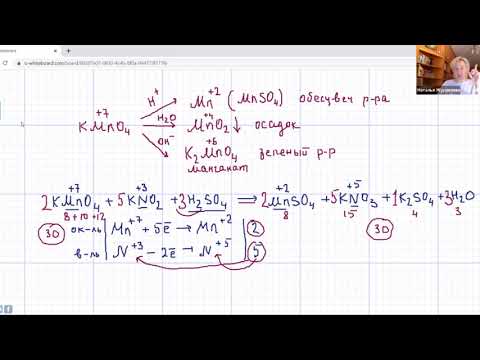
В кислых средах KMnO4 Mn (VII) восстанавливается до Mn (II), например, MnSO4. Перманганат калия (KMnO4) как открытая термодинамическая система проанализирована А. А. Кабановым. Промышленное производство KMnO4 основано на электролитическом окислении K2MnO4[Mn (VI)] до KMnO4 [Mn (VII)]. На первой стадии технологического процесса получают К2MnO4 путем нагревания смеси пиролюзита с 50 %-ным раствором едкого калия (KOH) до 200—250 °С. Химическое взаимодействие KOH с MnO2 с участием кислорода воздуха описывается реакцией
Сплав содержит 20—30 % H2MnO4. Затем перманганат калия K2MnO4, в котором марганец содержится в виде MnО4 2- , выщелачивают с получением раствора. На следующей стадии анион MnО4 2- окисляют до MnO2. Этот процесс описывается схемой
Образующийся на катоде KOH центрифугированием отделяют от KMnO4, упаривают и возвращают в оборотный цикл. Состав электролита в начале (А) и в конце (Б) электролиза характеризуется следующими данными, г/л:
Синтезированный продукт KMnO4 подвергают последовательно обработке (растворению при 85 °С, кристаллизации, центрифугированию, вакуум-сушке, измельчению и рассеву) для получения товарного кристаллического марганца чистого калия KMnO4. Общая характеристика электролизера и процесса приведена ниже по В. В. Стендеру. В стальной кожух электролизера (цилиндр диаметром 2 м и высотой 1 м с коническим дном) помещается несколько концентрических рядов анодов (никелевые и (или) железные листы). Просвет между рядами анодов составляет 100 мм. В этих просветах располагаются концентрическими рядами катоды (железные стержни диаметром 20—25 мм). При конструировании электролизера учитывают возможность восстановления KMnO4 на катоде, если плотность тока будет недостаточно большой по сравнению с плотностью тока на аноде. Число катодных стержней подбирают таким, чтобы плотность тока на катоде была в десять раз выше, чем на аноде. Это исключает возможность восстановления марганца на катоде щелочью по реакции
Плотность тока на аноде составляет 60—70 А/м 2 , на катоде 700 А/м 2 . Токовая нагрузка на ванну 1200—1400 А, напряжение на ванне в начале процесса 2,7 В, в конце 8 В. Температура электролиза составляет 60—70 °С. Удельный расход электроэнергии достигает 0,7—1,0 кВт • ч на 1 кг KMnO4. Продолжительность одного цикла электролиза составляет 48 ч. Кристаллы KMnO4 имеют темно-фиолетовый, а растворы в воде — красно-фиолетовый цвет.
- Применение KMnO4
- Электролиз
- Электролиз
- Электролиз растворов
- Катодные процессы
- Анодные процессы
- Суммарные процессы электролиза
- Электролиз расплавов
- Электролиз с растворимыми электродами
- Электролиз растворов и расплавов солей и окислительно-восстановительные реакции (стр. 3 )
- Так как электролиз ведут без диафрагмы, то имеет место процесс нейтрализации Н+ + ОН — = H2O. Тогда в окончательном виде получим:
- Так как нитрит калия в водном растворе подвергается гидролизу по первой ступени, создается щелочная среда, процесс окисления на аноде необходимо записать следующим образом:
- С учетом этого составим электродные процессы:
- В случае щелочной среды имеем:
- Процесс электролиза иногда упрощенно записывают без учета восстановления воды на катоде, так как количество электричество, расходуемое при этом незначительно:
- 📺 Видео
Видео:Электролиз. 10 класс.Скачать

Применение KMnO4
В аналитической химии стандартные растворы KMnO4 применяют для количественных объемных определений металлов (титриметрического анализа). Титрование восстановителей (Fe (II), Mn (II), Mo (III), Ti (III), O2 – и др.) стандартным раствором KMnO4 проводится в кислой среде. Реакция титрования в этом случае протекает по схеме
MnO4 – + 8H + + 5e → Mn 2+ + 4H2O.
Вторую группу веществ составляют сульфиты, сульфиды, тиосульфаты и др., которые окисляются легче в нейтральной или щелочной среде. Реакция описывается схемой
В химическом производстве перманганаты применяют как окислители. Перманганат калия KMnO4 обладает сильным дезинфицирующим свойством, что определяет его широкое использование в медицине.
Видео:Реакция этилена с раствором перманганата калияСкачать

Электролиз
Видео:Как получают перманганат калия? Можно ли электролизом?Скачать

Электролиз
Химические реакции, сопровождающиеся переносом электронов (окислительно-восстановительные реакции) делятся на два типа: реакции, протекающие самопроизвольно и реакции, протекающие при прохождении тока через раствор или расплав электролита.
Раствор или расплав электролита помещают в специальную емкость — электролитическую ванну .
Электрический ток — это упорядоченное движение заряженных частиц — ионов, электронов и др. под действием внешнего электрического поля. Электрическое поле в растворе или расплаве электролита создают электроды .
Электроды — это, как правило, стержни из материала, проводящего электрический ток. Их помещают в раствор или расплав электролита, и подключают к электрической цепи с источником питания.
При этом отрицательно заряженный электрод катод — притягивает положительно заряженные ионы — катионы . Положительно заряженный электрод ( анод ) притягивает отрицательно заряженные частицы ( анионы ). Катод выступает в качестве восстановителя, а анод — в качестве окислителя.
Различают электролиз с активными и инертными электродами. Активные (растворимые) электроды подвергаются химическим превращениям в процессе электролиза. Обычно их изготавливают из меди, никеля и других металлов. Инертные (нерастворимые) электроды химическим превращениям не подвергаются. Их изготавливают из неактивных металлов, например, платины , или графита .
Видео:Электролиз растворов. 2 часть. 10 класс.Скачать

Электролиз растворов
Различают электролиз раствора или расплава химического вещества. В растворе присутствует дополнительное химическое вещество — вода, которая может принимать участие в окислительно-восстановительных реакциях.
Катодные процессы
В растворе солей катод притягивает катионы металлов. Катионы металлов могут выступать в качестве окислителей. Окислительные способности ионов металлов различаются. Для оценки окислительно-восстановительных способностей металлов применяют электро-химический ряд напряжений :
Каждый металл характеризуется значением электрохимического потен-циала. Чем меньше потенциал , тем больше восстановительные свойства металла и тем меньше окислительные свойства соответствующего иона этого металла. Разным ионам соответствуют разные значения этого потенциала. Электрохимический потенциал — относительная величина. Электрохимический потенциал водорода принят равным нулю.
Также около катода находятся молекулы воды Н2О. В составе воды есть окислитель — ион H + .
При электролизе растворов солей на катоде наблюдаются следующие закономерности:
1. Если металл в соли — активный ( до Al 3+ включительно в ряду напряжений ), то вместо металла на катоде восстанавливается (разряжается) водород , т.к. потенциал водорода намного больше. Протекает процесс восстановления молекулярного водорода из воды, при этом образуются ионы OH — , среда возле катода — щелочная:
2H2O +2ē → H2 + 2OH —
Например , при электролизе раствора хлорида натрия на катоде будет вос-станавливаться только водород из воды.
2. Если металл в соли – средней активности (между Al 3+ и Н + ) , то на катоде восстанавливается (разряжается) и металл , и водород , так как потенциал таких металлов сравним с потенциалом водорода:
Me n+ + nē → Me 0
2 H + 2O +2ē → H2 0 + 2OH —
Например , при электролизе раствора сульфата железа (II) на катоде будет восстанавливаться (разряжаться) и железо, и водород:
Fe 2+ + 2ē → Fe 0
2 H + 2O +2ē → H2 0 + 2OH —
3. Если металл в соли — неактивный (после водорода в ряду стандартных электрохимических металлов) , то ион такого металла является более сильным окислителем, чем ион водорода, и на катоде восстанавливается только металл:
Me n+ + nē → Me 0
Например, при электролизе раствора сульфата меди (II) на катоде будет восстанавливаться медь:
Cu 2+ + 2ē → Cu 0
4. Если на катод попадают катионы водорода H + , то они и восстанавливаются до молекулярного водорода:
2H + + 2ē → H2 0
Анодные процессы
Положительно заряженный анод притягивает анионы и молекулы воды. Анод – окислитель. В качестве восстановителей выступаю либо анионы кислотных остаток, либо молекулы воды (за счет кислорода в степени окисления -2: H 2 O -2 ).
При электролизе растворов солей на аноде наблюдаются следующие закономерности:
1. Если на анод попадает бескислородный кислотный остаток , то он окисляется до свободного состояния (до степени окисления 0):
неМе n- – nē = неМе 0
Например : при электролизе раствора хлорида натрия на аноде окисляют-ся хлорид-ионы:
2Cl — – 2ē = Cl2 0
Действительно, если вспомнить Периодический закон: при увеличении электроотрицательности неметалла его восстановительные свойства уменьшаются. А кислород – второй по величине электроотрицательности элемент. Таким образом, проще окислить практически любой неметалл, а не кислород. Правда, есть одно исключение . Наверное, вы уже догадались. Конечно же, это фтор. Ведь электроотрицательность фтора больше, чем у кислорода. Таким образом, при электролизе растворов фторидов окисляться будут именно молекулы воды, а не фторид-ионы :
2H2 O -2 – 4ē → O2 0 + 4H +
2. Если на анод попадает кислородсодержащий кислотный остаток, либо фторид-ион , то окислению подвергается вода с выделением молекулярно-го кислорода:
2H2 O -2 – 4ē → O2 0 + 4H +
3. Если на анод попадает гидроксид-ион, то он окисляется и происходит выделение молекулярного кислорода:
4 O -2 H – – 4ē → O2 0 + 2H2O
4. При электролизе растворов солей карбоновых кислот окислению под-вергается атом углерода карбоксильной группы, выделяется углекислый газ и соответствующий алкан.
Например , при электролизе растворов ацетатов выделяется углекислый газ и этан:
2 CH3 C +3 OO – –2ē → 2 C +4 O2+ CH3-CH3
Суммарные процессы электролиза
Рассмотрим электролиз растворов различных солей.
Например , электролиз раствора сульфата меди. На катоде восстанавливаются ионы меди:
Катод (–): Cu 2+ + 2ē → Cu 0
На аноде окисляются молекулы воды:
Анод (+): 2H2 O -2 – 4ē → O2 + 4H +
Сульфат-ионы в процессе не участвуют. Мы их запишем в итоговом уравнении с ионами водорода в виде серной кислоты:
2 Cu 2+ SO4 + 2H2 O -2 → 2 Cu 0 + 2H2SO4 + O2 0
Электролиз раствора хлорида натрия выглядит так:
На катоде восстанавливается водород:
Катод (–): 2 H + 2O +2ē → H2 0 + 2OH –
На аноде окисляются хлорид-ионы:
Анод (+): 2 Cl – – 2ē → Cl2 0
Ионы натрия в процессе электролиза не участвуют. Мы записываем их с гидроксид-анионами в суммарном уравнении электролиза раствора хлорида натрия :
2 H + 2O +2Na Cl – → H2 0 + 2NaOH + Cl2 0
Следующий пример : электролиз водного раствора карбоната калия.
На катоде восстанавливается водород из воды:
Катод (–): 2 H + 2O +2ē → H2 0 + 2OH –
На аноде окисляются молекулы воды до молекулярного кислорода:
Анод (+): 2H2 O -2 – 4ē → O2 0 + 4H +
Таким образом, при электролизе раствора карбоната калия ионы калия и карбонат-ионы в процессе не участвуют. Происходит электролиз воды:
2 H2 + O -2 → 2 H2 0 + O2 0
Еще один пример : электролиз водного раствора хлорида меди (II).
На катоде восстанавливается медь:
Катод (–): Cu 2+ + 2ē → Cu 0
На аноде окисляются хлорид-ионы до молекулярного хлора:
Анод (+): 2 Cl – – 2ē → Cl2 0
Таким образом, при электролизе раствора карбоната калия происходит электролиз воды:
Cu 2+ Cl2 – → Cu 0 + Cl2 0
Еще несколько примеров: электролиз раствора гидроксида натрия.
На катоде восстанавливается водород из воды:
Катод (–): 2 H + 2O +2ē → H2 0 + 2OH –
На аноде окисляются гидроксид-ионы до молекулярного кислорода:
Анод (+): 4 O -2 H – – 4ē → O2 0 + 2H2O
Таким образом, при электролизе раствора гидроксида натрия происходит разложение воды, катионы натрия в процессе не участвуют:
2 H2 + O -2 → 2 H2 0 + O2 0
Видео:Часть 3-2. Электролиз водных растворов. Примеры решений уравнений (подробно).Скачать

Электролиз расплавов
При электролизе расплава на аноде окисляются анионы кислотных остатков, а на катоде восстанавливаются катионы металлов. Молекул воды в системе нет.
Например: электролиз расплава хлорида натрия. На катоде восстанавли-ваются катионы натрия:
Катод (–): Na + + ē → Na 0
На аноде окисляются анионы хлора:
Анод (+): 2 Cl – – 2ē → Cl2 0
Суммарное уравнение электролиза расплава хлорида натрия:
2 Na + Cl – → 2 Na 0 + Cl2 0
Еще один пример: электролиз расплава гидроксида натрия. На катоде восстанавливаются катионы натрия:
Катод (–): Na + + ē → Na 0
На аноде окисляются гидроксид-ионы:
Анод (+): 4 OH – – 4ē → O2 0 + 2H2O
Суммарное уравнение электролиза расплава гидроксида натрия:
4 Na + OH – → 4 Na 0 + O2 0 + 2H2O
Многие металлы получают в промышленности электролизом расплавов.
Например , алюминий получают электролизом раствора оксида алюминия в расплаве криолита. Криолит – Na3[AlF6] плавится при более низкой температуре (1100 о С), чем оксид алюминия (2050 о С). А оксид алюминия отлично растворяется в расплавленном криолите.
В растворе криолите оксид алюминия диссоциирует на ионы:
На катоде восстанавливаются катионы алюминия:
Катод (–): Al 3+ + 3ē → Al 0
На аноде окисляются алюминат-ионы:
Анод (+): 4Al O 3 3 – – 12ē → 2Al2O3 + 3 O2 0
Общее уравнение электролиза раствора оксида алюминия в расплаве криолита:
2 Al 2 О 3 = 4 Al 0 + 3 О 2 0
В промышленности при электролизе оксида алюминия в качестве электродов используют графитовые стержни. При этом электроды частично окисляются (сгорают) в выделяющемся кислороде:
C 0 + О2 0 = C +4 O2 -2
Видео:Опыты по химии. Электролиз раствора йодида калияСкачать

Электролиз с растворимыми электродами
Если материал электродов выполнен из того же металла, который присут-ствует в растворе в виде соли, или из более активного металла, то на аноде разряжаются не молекулы воды или анионы, а окисляются частицы самого металла в составе электрода.
Например , рассмотрим электролиз раствора сульфата меди (II) с медными электродами.
На катоде разряжаются ионы меди из раствора:
Катод (–): Cu 2+ + 2ē → Cu 0
На аноде окисляются частицы меди из электрода :
Анод (+): Cu 0 – 2ē → Cu 2+
Видео:ЭлектролизСкачать

Электролиз растворов и расплавов солей и окислительно-восстановительные реакции (стр. 3 )
 | Из за большого объема этот материал размещен на нескольких страницах: 1 2 3 4 5 6 7 8 |
Электролиз растворов нитрита и сульфита натрия на инертных
электродах без диафрагмы.
В нитрит — и сульфит-ионах атомные частицы N+3 и S+4 занимают промежуточные степени окисления. Поэтому при прохождении постоянного электрического тока через водные растворы нитрита и сульфита натрия можно ожидать окисления на аноде нитрит — и сульфит-ионов и восстановление на катоде молекул воды.
КNO2 (р) = К+ + NO2- , H2O ↔ ОН — + H+
К2SO3 = 2К+ + SO32-, H2O ↔ ОН — + H+

NO2- + 3H2O = H2 + NO3- + 2Н+ + 2ОН —
Так как электролиз ведут без диафрагмы, то имеет место процесс нейтрализации Н+ + ОН — = H2O. Тогда в окончательном виде получим:
КNO2 + H2O = H2 + КNO3
Возможен и другой механизм анодного окисления:
1) вода окисляется по схеме
2H2O − 4ē = О2 + 4Н+
2) затем протекает процесс окисления NO2- кислородом:
Так как нитрит калия в водном растворе подвергается гидролизу по первой ступени, создается щелочная среда, процесс окисления на аноде необходимо записать следующим образом:
NO2- + 2ОН — − 2ē = NO3- + H2O
(недостаток кислорода в левой части восполняют за счет ОН- — ионов, а недостаток водорода в правой части — за счет молекул воды).
С учетом этого составим электродные процессы:

NO2- + H2O = H2 + NO3-
В окончательном молекулярном виде получим то же, что и при рН =7:
КNO2 + H2O = H2 + КNO3
Процесс окисления на аноде при рН > 7 можно представить и так:
1) ОН — — ионы окисляются с образованием кислорода:
4ОН — − 4ē = О2 + 2H2O
2) затем нитрит-ионы окисляются кислородом:
Аналогичным образом можно записать электролиз раствора К2SO3:
катод: 2H2O + 2ē = H2 + 2ОН — 1
К2SO3 + H2O = H2 + К2SO4
Возможный процесс окисления на аноде при рН = 7 можно представить и так:
1) окисление воды:
2H2O − 4ē = О2 + 4Н+
2) сульфит-ионы окисляются кислородом:
2SO32- + О2 = 2SO42-
 В случае щелочной среды имеем:
В случае щелочной среды имеем:
катод: 2H2O + 2ē = H2 + 2ОН — 1
В общем виде: SO32- + H2O = H2 + SO42-
К2SO3 + H2O = H2 + К2SO4
Возможные процессы окисления на аноде при рН > 7:
1) 4ОН — − 4ē = О2 + 2H2O
2) 2SO32- + О2 = 2SO42-

анод: MnO42- − 1ē = MnO4- 2
2K2MnO4 + 2H2O = 2KMnO4 + H2↑ + 2КОН
Электролиз водного раствора гидроксида натрия на инертных
электродах с диафрагмой
На катоде восстанавливаются молекулы воды, а на аноде окисляются гидроксид-ионы:


Вывод. Путем электролиза растворов щелочей можно получать как газообразный водород, так и кислород, электролиз без диафрагмы проводить опасно, из-за возможности образования «гремучей» смеси.
Серная кислота сильна только по первой стадии диссоциации:
По второй стадии диссоциации она считается кислотой средней силы:
В результате этого на электродах идут следующие процессы:

анод: 2HSO4- −2ē = H2S2O8 1
 |
В общем виде: 2HSO4- + 2Н+ = H2↑ + H2S2O8
2H2SO4 = H2↑ + H2S2O8
Электролиз по такой схеме возможен при больших плотностях тока.
1) КHSO4 = К+ + HSO4-

анод: 2HSO4- -2ē = H2S2O8 1
 |
2HSO4- + 2H2O = H2↑ + H2S2O8 + 2OH — или
2КHSO4 + 2H2O = H2↑ + H2S2O8 + 2КOH
3) H2S2O8 + 2КOH = К2S2O8↓ + 2H2O
2КHSO4 = К2S2O8↓ + H2↑
Электролиз по такой схеме возможен при больших плотностях тока.
Электролиз водного раствора соли Cr2(SO4)3 на инертных электродах
Cr2(SO4)3 = 2Сr3+ + 3SO42-

2H2O + 2ē = H2↑ + 2ОН — 4 при рН =7

В общем виде: 2Cr2(SO4)3(p) + 10H2O → 4Cr + 5O2↑ + 4H2↑ + 6H2SO4
Видео:Электролиз растворов. 1 часть. 10 класс.Скачать

Процесс электролиза иногда упрощенно записывают без учета восстановления воды на катоде, так как количество электричество, расходуемое при этом незначительно:
2Cr2(SO4)3(p) + 6H2O → 4Cr + 3O2↑ + 6H2SO4
Если учесть гидролиз соли Cr2(SO4)3 , то на катоде вместо восстановления воды необходимо записывать процесс восстановления ионов водорода, при этом окончательная реакция электролиза не будет отличаться от написанного.
Получение ферратов анодным окислением железа в щелочном

катод: 2H2O + 2ē = H2↑ + 2ОН — 3

В растворе: Fe+6 + 4ОН — = FeО42- + 4Н+
Суммарные электродные процессы:


В окончательном виде: Feo + 2H2O + 2ОН — = FeО42- + 3H2↑
Feo + 2H2O + 2КОН = К2FeО4 малиновый + 3H2↑
Марганец можно получить электролизом раствора MnSO4:
2MnSO4(р) + 2H2O = 2Mn↓катод + O2↑ анод + 2H2SO4
Хром можно получить электролизом раствора Cr2(SO4)3
2Cr2(SO4)3(p) + 6H2O → 4Cr + 3O2↑ + 6H2SO4


2H+ + 2HSO4- = H2↑ + H2S2O6(O2) ,
2) затем идет реакция:
H2S2O6(O2) + 2NH4+ = (NH4)2S2O6(O2)↓ + 2H+,
3) далее проводят гидролиз:
(NH4)2S2O6(O2) + 2H2O = 2NH4HSO4 + H2O2
II. Электролиз расплавов солей
Необходимо помнить, что при плавлении солей и щелочей происходит их электролитическая диссоциация. Если теперь через такой расплав электролита пропустить постоянный электрический ток, катионы перемещаются к катоду и восстанавливаются, а анионы окисляются на аноде.
На катоде катионы металлов восстанавливаются по схеме:
Окисление кислородсодержащих анионов на аноде протекает сложнее, чем бескислородных:
4ОН — − 4ē = О2 + 2Н2О, 2SO42- −4ē = 2SO3 + O2o,
2CO32- −4ē = 2CO2 + O2o, 2NO3- −2ē = 2NO2 + O2o
2SO32- −4ē = 2SO2 + O2o, 2PO43- −4ē = 2PO3- + O2o
Электролизом расплавов соответствующих солей или их гидроксидов получают металлы: щелочные и щелочноземельные, магний, медь, алюминий и др.
Электрохимический способ получения фтора в расплавах:
1) HF + KF, при 70-100 оС;
2) HF в расплаве KH2F3 , при 80-120 оС
3) HF в расплаве KHF2 , при 240-300 оС
Электролизу подвергается во всех случаях HF:
1) в расплаве происходит электролитическая диссоциация и
3HFрасплав ↔ H2F+ + HF2- (автопротолиз) (1)
2) электродные процессы:


2H2F+ + 2HF2- = F2о + H2о + 4HFо
2HF(расплав) = H2 + F2
Электролиз расплава гиидроксида натрия
NaOH(расплав) = Na+ + ОН —


📺 Видео
Электролиз. Часть 1. Процесс электролиза, основные закономерности.Скачать

Получение кислорода из перманганата калияСкачать

Опыты по химии. Получение кислорода из перманганата калияСкачать

Взаимодействие ацетилена с раствором перманганата калияСкачать

Электролиз раствора иодида калияСкачать

ОВР с перманганатом калия.Скачать
Окисление органических соединений перманганатом калияСкачать

Видеоопыты. Органика. 05 Взаимодействие этилена с раствором перманганата калияСкачать

ХИМИЯ 11 класс : Электролиз растворовСкачать

Получение ХЛОРА. Реакция СОЛЯНОЙ КИСЛОТЫ и ПЕРМАНГАНАТА КАЛИЯ. Химические опыты. Chemical experimentСкачать

Электролиз растворов: получение кадмия, никеля, хлора, йода и других. [ChemistryToday]Скачать
![Электролиз растворов: получение кадмия, никеля, хлора, йода и других. [ChemistryToday]](https://i.ytimg.com/vi/CRgMweu9_nE/0.jpg)
Получение перманганата калияСкачать






 В случае щелочной среды имеем:
В случае щелочной среды имеем: