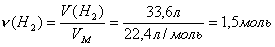Электролиз (греч. elektron — янтарь + lysis — разложение) — химическая реакция, происходящая при прохождении постоянного тока через электролит. Это разложение веществ на их составные части под действием электрического тока.
Процесс электролиза заключается в перемещении катионов (положительно заряженных ионов) к катоду (заряжен отрицательно), и отрицательно заряженных ионов (анионов) к аноду (заряжен положительно).
Итак, анионы и катионы устремляются соответственно к аноду и катоду. Здесь и происходит химическая реакция. Чтобы успешно решать задания по этой теме и писать реакции, необходимо разделять процессы на катоде и аноде. Именно так и будет построена эта статья.
Катод
К катоду притягиваются катионы — положительно заряженные ионы: Na + , K + , Cu 2+ , Fe 3+ , Ag + и т.д.
Чтобы установить, какая реакция идет на катоде, прежде всего, нужно определиться с активностью металла: его положением в электрохимическом ряду напряжений металлов.
Если на катоде появился активный металл (Li, Na, K) то вместо него восстанавливаются молекулы воды, из которых выделяется водород. Если металл средней активности (Cr, Fe, Cd) — на катоде выделяется и водород, и сам металл. Малоактивные металлы выделяются на катоде в чистом виде (Cu, Ag).
Замечу, что границей между металлами активными и средней активности в ряду напряжений считается алюминий. При электролизе на катоде металлы до алюминия (включительно!) не восстанавливаются, вместо них восстанавливаются молекулы воды — выделяется водород.
В случае, если на катод поступают ионы водорода — H + (например при электролизе кислот HCl, H2SO4) восстанавливается водород из молекул кислоты: 2H + — 2e = H2
К аноду притягиваются анионы — отрицательно заряженные ионы: SO4 2- , PO4 3- , Cl — , Br — , I — , F — , S 2- , CH3COO — .
При электролизе кислородсодержащих анионов: SO4 2- , PO4 3- — на аноде окисляются не анионы, а молекулы воды, из которых выделяется кислород.
Бескислородные анионы окисляются и выделяют соответствующие галогены. Сульфид-ион при оксилении окислении серу. Исключением является фтор — если он попадает анод, то разряжается молекула воды и выделяется кислород. Фтор — самый электроотрицательный элемент, поэтому и является исключением.
Анионы органических кислот окисляются особым образом: радикал, примыкающий к карбоксильной группе, удваивается, а сама карбоксильная группа (COO) превращается в углекислый газ — CO2.
Примеры решения
В процессе тренировки вам могут попадаться металлы, которые пропущены в ряду активности. На этапе обучения вы можете пользоваться расширенным рядом активности металлов.
Теперь вы точно будете знать, что выделяется на катоде 😉
Итак, потренируемся. Выясним, что образуется на катоде и аноде при электролизе растворов AgCl, Cu(NO3)2, AlBr3, NaF, FeI2, CH3COOLi.
Иногда в заданиях требуется записать реакцию электролиза. Сообщаю: если вы понимаете, что образуется на катоде, а что на аноде, то написать реакцию не составляет никакого труда. Возьмем, например, электролиз NaCl и запишем реакцию:
NaCl + H2O → H2 + Cl2 + NaOH (обычно в продуктах оставляют именно запись «NaOH», не подвергая его дальнейшему электролизу)
Натрий — активный металл, поэтому на катоде выделяется водород. Анион не содержит кислорода, выделяется галоген — хлор. Мы пишем уравнение, так что не можем заставить натрий испариться бесследно 🙂 Натрий вступает в реакцию с водой, образуется NaOH.
Запишем реакцию электролиза для CuSO4:
Медь относится к малоактивным металлам, поэтому сама в чистом виде выделяется на катоде. Анион кислородсодержащий, поэтому в реакции выделяется кислород. Сульфат-ион никуда не исчезает, он соединяется с водородом воды и превращается в серую кислоту.
Электролиз расплавов
Все, что мы обсуждали до этого момента, касалось электролиза растворов, где растворителем является вода.
Перед промышленной химией стоит важная задача — получить металлы (вещества) в чистом виде. Малоактивные металлы (Ag, Cu) можно легко получать методом электролиза растворов.
Но как быть с активными металлами: Na, K, Li? Ведь при электролизе их растворов они не выделяются на катоде в чистом виде, вместо них восстанавливаются молекулы воды и выделяется водород. Тут нам как раз пригодятся расплавы, которые не содержат воды.
В безводных расплавах реакции записываются еще проще: вещества распадаются на составные части:
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Видео:Электролиз. Часть 1. Процесс электролиза, основные закономерности.Скачать

Электролиз
Видео:Все об электролизе и задании 20 за 20 минут | Химия ЕГЭ 2023 | УмскулСкачать

Электролиз
Химические реакции, сопровождающиеся переносом электронов (окислительно-восстановительные реакции) делятся на два типа: реакции, протекающие самопроизвольно и реакции, протекающие при прохождении тока через раствор или расплав электролита.
Раствор или расплав электролита помещают в специальную емкость — электролитическую ванну .
Электрический ток — это упорядоченное движение заряженных частиц — ионов, электронов и др. под действием внешнего электрического поля. Электрическое поле в растворе или расплаве электролита создают электроды .
Электроды — это, как правило, стержни из материала, проводящего электрический ток. Их помещают в раствор или расплав электролита, и подключают к электрической цепи с источником питания.
При этом отрицательно заряженный электрод катод — притягивает положительно заряженные ионы — катионы . Положительно заряженный электрод ( анод ) притягивает отрицательно заряженные частицы ( анионы ). Катод выступает в качестве восстановителя, а анод — в качестве окислителя.
Различают электролиз с активными и инертными электродами. Активные (растворимые) электроды подвергаются химическим превращениям в процессе электролиза. Обычно их изготавливают из меди, никеля и других металлов. Инертные (нерастворимые) электроды химическим превращениям не подвергаются. Их изготавливают из неактивных металлов, например, платины , или графита .
Видео:Электролиз. 10 класс.Скачать

Электролиз растворов
Различают электролиз раствора или расплава химического вещества. В растворе присутствует дополнительное химическое вещество — вода, которая может принимать участие в окислительно-восстановительных реакциях.
Катодные процессы
В растворе солей катод притягивает катионы металлов. Катионы металлов могут выступать в качестве окислителей. Окислительные способности ионов металлов различаются. Для оценки окислительно-восстановительных способностей металлов применяют электро-химический ряд напряжений :
Каждый металл характеризуется значением электрохимического потен-циала. Чем меньше потенциал , тем больше восстановительные свойства металла и тем меньше окислительные свойства соответствующего иона этого металла. Разным ионам соответствуют разные значения этого потенциала. Электрохимический потенциал — относительная величина. Электрохимический потенциал водорода принят равным нулю.
Также около катода находятся молекулы воды Н2О. В составе воды есть окислитель — ион H + .
При электролизе растворов солей на катоде наблюдаются следующие закономерности:
1. Если металл в соли — активный ( до Al 3+ включительно в ряду напряжений ), то вместо металла на катоде восстанавливается (разряжается) водород , т.к. потенциал водорода намного больше. Протекает процесс восстановления молекулярного водорода из воды, при этом образуются ионы OH — , среда возле катода — щелочная:
2H2O +2ē → H2 + 2OH —
Например , при электролизе раствора хлорида натрия на катоде будет вос-станавливаться только водород из воды.
2. Если металл в соли – средней активности (между Al 3+ и Н + ) , то на катоде восстанавливается (разряжается) и металл , и водород , так как потенциал таких металлов сравним с потенциалом водорода:
Me n+ + nē → Me 0
2 H + 2O +2ē → H2 0 + 2OH —
Например , при электролизе раствора сульфата железа (II) на катоде будет восстанавливаться (разряжаться) и железо, и водород:
Fe 2+ + 2ē → Fe 0
2 H + 2O +2ē → H2 0 + 2OH —
3. Если металл в соли — неактивный (после водорода в ряду стандартных электрохимических металлов) , то ион такого металла является более сильным окислителем, чем ион водорода, и на катоде восстанавливается только металл:
Me n+ + nē → Me 0
Например, при электролизе раствора сульфата меди (II) на катоде будет восстанавливаться медь:
Cu 2+ + 2ē → Cu 0
4. Если на катод попадают катионы водорода H + , то они и восстанавливаются до молекулярного водорода:
2H + + 2ē → H2 0
Анодные процессы
Положительно заряженный анод притягивает анионы и молекулы воды. Анод – окислитель. В качестве восстановителей выступаю либо анионы кислотных остаток, либо молекулы воды (за счет кислорода в степени окисления -2: H 2 O -2 ).
При электролизе растворов солей на аноде наблюдаются следующие закономерности:
1. Если на анод попадает бескислородный кислотный остаток , то он окисляется до свободного состояния (до степени окисления 0):
неМе n- – nē = неМе 0
Например : при электролизе раствора хлорида натрия на аноде окисляют-ся хлорид-ионы:
2Cl — – 2ē = Cl2 0
Действительно, если вспомнить Периодический закон: при увеличении электроотрицательности неметалла его восстановительные свойства уменьшаются. А кислород – второй по величине электроотрицательности элемент. Таким образом, проще окислить практически любой неметалл, а не кислород. Правда, есть одно исключение . Наверное, вы уже догадались. Конечно же, это фтор. Ведь электроотрицательность фтора больше, чем у кислорода. Таким образом, при электролизе растворов фторидов окисляться будут именно молекулы воды, а не фторид-ионы :
2H2 O -2 – 4ē → O2 0 + 4H +
2. Если на анод попадает кислородсодержащий кислотный остаток, либо фторид-ион , то окислению подвергается вода с выделением молекулярно-го кислорода:
2H2 O -2 – 4ē → O2 0 + 4H +
3. Если на анод попадает гидроксид-ион, то он окисляется и происходит выделение молекулярного кислорода:
4 O -2 H – – 4ē → O2 0 + 2H2O
4. При электролизе растворов солей карбоновых кислот окислению под-вергается атом углерода карбоксильной группы, выделяется углекислый газ и соответствующий алкан.
Например , при электролизе растворов ацетатов выделяется углекислый газ и этан:
2 CH3 C +3 OO – –2ē → 2 C +4 O2+ CH3-CH3
Суммарные процессы электролиза
Рассмотрим электролиз растворов различных солей.
Например , электролиз раствора сульфата меди. На катоде восстанавливаются ионы меди:
Катод (–): Cu 2+ + 2ē → Cu 0
На аноде окисляются молекулы воды:
Анод (+): 2H2 O -2 – 4ē → O2 + 4H +
Сульфат-ионы в процессе не участвуют. Мы их запишем в итоговом уравнении с ионами водорода в виде серной кислоты:
2 Cu 2+ SO4 + 2H2 O -2 → 2 Cu 0 + 2H2SO4 + O2 0
Электролиз раствора хлорида натрия выглядит так:
На катоде восстанавливается водород:
Катод (–): 2 H + 2O +2ē → H2 0 + 2OH –
На аноде окисляются хлорид-ионы:
Анод (+): 2 Cl – – 2ē → Cl2 0
Ионы натрия в процессе электролиза не участвуют. Мы записываем их с гидроксид-анионами в суммарном уравнении электролиза раствора хлорида натрия :
2 H + 2O +2Na Cl – → H2 0 + 2NaOH + Cl2 0
Следующий пример : электролиз водного раствора карбоната калия.
На катоде восстанавливается водород из воды:
Катод (–): 2 H + 2O +2ē → H2 0 + 2OH –
На аноде окисляются молекулы воды до молекулярного кислорода:
Анод (+): 2H2 O -2 – 4ē → O2 0 + 4H +
Таким образом, при электролизе раствора карбоната калия ионы калия и карбонат-ионы в процессе не участвуют. Происходит электролиз воды:
2 H2 + O -2 → 2 H2 0 + O2 0
Еще один пример : электролиз водного раствора хлорида меди (II).
На катоде восстанавливается медь:
Катод (–): Cu 2+ + 2ē → Cu 0
На аноде окисляются хлорид-ионы до молекулярного хлора:
Анод (+): 2 Cl – – 2ē → Cl2 0
Таким образом, при электролизе раствора карбоната калия происходит электролиз воды:
Cu 2+ Cl2 – → Cu 0 + Cl2 0
Еще несколько примеров: электролиз раствора гидроксида натрия.
На катоде восстанавливается водород из воды:
Катод (–): 2 H + 2O +2ē → H2 0 + 2OH –
На аноде окисляются гидроксид-ионы до молекулярного кислорода:
Анод (+): 4 O -2 H – – 4ē → O2 0 + 2H2O
Таким образом, при электролизе раствора гидроксида натрия происходит разложение воды, катионы натрия в процессе не участвуют:
2 H2 + O -2 → 2 H2 0 + O2 0
Видео:ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Электролиз расплавов
При электролизе расплава на аноде окисляются анионы кислотных остатков, а на катоде восстанавливаются катионы металлов. Молекул воды в системе нет.
Например: электролиз расплава хлорида натрия. На катоде восстанавли-ваются катионы натрия:
Катод (–): Na + + ē → Na 0
На аноде окисляются анионы хлора:
Анод (+): 2 Cl – – 2ē → Cl2 0
Суммарное уравнение электролиза расплава хлорида натрия:
2 Na + Cl – → 2 Na 0 + Cl2 0
Еще один пример: электролиз расплава гидроксида натрия. На катоде восстанавливаются катионы натрия:
Катод (–): Na + + ē → Na 0
На аноде окисляются гидроксид-ионы:
Анод (+): 4 OH – – 4ē → O2 0 + 2H2O
Суммарное уравнение электролиза расплава гидроксида натрия:
4 Na + OH – → 4 Na 0 + O2 0 + 2H2O
Многие металлы получают в промышленности электролизом расплавов.
Например , алюминий получают электролизом раствора оксида алюминия в расплаве криолита. Криолит – Na3[AlF6] плавится при более низкой температуре (1100 о С), чем оксид алюминия (2050 о С). А оксид алюминия отлично растворяется в расплавленном криолите.
В растворе криолите оксид алюминия диссоциирует на ионы:
На катоде восстанавливаются катионы алюминия:
Катод (–): Al 3+ + 3ē → Al 0
На аноде окисляются алюминат-ионы:
Анод (+): 4Al O 3 3 – – 12ē → 2Al2O3 + 3 O2 0
Общее уравнение электролиза раствора оксида алюминия в расплаве криолита:
2 Al 2 О 3 = 4 Al 0 + 3 О 2 0
В промышленности при электролизе оксида алюминия в качестве электродов используют графитовые стержни. При этом электроды частично окисляются (сгорают) в выделяющемся кислороде:
C 0 + О2 0 = C +4 O2 -2
Видео:Электролиз. Часть 7. Электролиз с растворимым анодомСкачать

Электролиз с растворимыми электродами
Если материал электродов выполнен из того же металла, который присут-ствует в растворе в виде соли, или из более активного металла, то на аноде разряжаются не молекулы воды или анионы, а окисляются частицы самого металла в составе электрода.
Например , рассмотрим электролиз раствора сульфата меди (II) с медными электродами.
На катоде разряжаются ионы меди из раствора:
Катод (–): Cu 2+ + 2ē → Cu 0
На аноде окисляются частицы меди из электрода :
Анод (+): Cu 0 – 2ē → Cu 2+
Видео:Электролиз. Как составлять уравнения электролиза водных растворов солей.Скачать

Электролиз раствора нитрата алюминия уравнение
Одним из способов получения металлов является электролиз. Активные металлы встречаются в природе только в виде химических соединений. Как выделить из этих соединений в свободном состоянии?
Растворы и расплавы электролитов проводят электрический ток. Однако при пропускании тока через раствор электролита могут происходить химические реакции. Рассмотрим, что будет происходить, если в раствор или расплав электролита поместить две металлические пластинки, каждая из которых соединена с одним из полюсов источника тока. Эти пластинки называются электродами. Электрический ток представляет собой движущийся поток электронов. В результате того, что электроны в цепи движутся от одного электрода к другому, на одном из электродов возникает избыток электронов. Электроны имеют отрицательный заряд, поэтому этот электрод заряжается отрицательно. Его называют катодом. На другом электроде создается недостаток электронов, и он заряжается положительно. Этот электрод называют анодом. Электролит в растворе или расплаве диссоциирует на положительно заряженные ионы — катионы и отрицательно заряженные ионы — анионы. Катионы притягиваются к отрицательно заряженному электроду — катоду. Анионы притягиваются к положительно заряженному электроду — аноду. На поверхности электродов может происходить взаимодействие между ионами и электронами.
Электролизом называются процессы, происходящие при пропускании через растворы или расплавы электролитов электрического тока.
Процессы, происходящие при электролизе растворов и расплавов электролитов, достаточно сильно отличаются. Рассмотрим подробно оба этих случая.
В качестве примера рассмотрим электролиз расплава хлорида натрия. В расплаве хлорид натрия диссоциирует на ионы Na +
и Cl — : NaCl = Na + + Cl —
Катионы натрия перемещаются к поверхности отрицательно заряженного электрода — катода. На поверхности катода имеется избыток электронов. Поэтому происходит передача электронов от поверхности электрода к ионам натрия. При этом ионы Na + превращаются в атомы натрия, то есть происходит восстановление катионов Na + . Уравнение процесса:
Хлорид-ионы Cl — перемещаются к поверхности положительно заряженного электрода — анода. На поверхности анода создан недостаток электронов и происходит передача электронов от анионов Cl — к поверхности электрода. При этом отрицательно заряженные ионы Cl — превращаются в атомы хлора, которые сразу же соединяются в молекулы хлора С l 2 :
2С l — -2е — = Cl 2
Хлорид-ионы теряют электроны, то есть происходит их окисление.
Запишем вместе уравнения процессов, происходящих на катоде и аноде
2 С l — -2 е — = Cl2
В процессе восстановления катионов натрия участвует один электрон, а в процессе окисления ионов хлора — 2 электрона. Однако должен соблюдаться закон сохранения электрического заряда, то есть общий заряд всех частиц в растворе должен быть постоянным Следовательно, число электронов, участвующих в восстановлении катионов натрия, должно быть равно числу электронов, участвующих в окислении хлорид-ионов Поэтому первое уравнение умножим на 2:
2С l — -2е — = Cl 2 1
Сложим вместе оба уравнения и получим общее уравнение реакции.
2 Na + + 2С l — = 2 Na + Cl 2 (ионное уравнение реакции), или
2 NaCl = 2 Na + Cl 2 (молекулярное уравнение реакции)
Итак, на рассмотренном примере мы видим, что электролиз является окислительно-восстановительной реакцией. На катоде происходит восстановление положительно заряженных ионов — катионов, на аноде окисление отрицательно заряженных ионов – анионов. Запомнить, какой процесс где происходит, можно с помощью «правила Т»:
каТод — каТион – воссТановление.
Пример 2. Электролиз расплава гидроксида натрия.
Гидроксида натрия в растворе диссоциирует на катионы и гидроксид-ионы .
Катод (-) Na + + OH — à Анод (+)
На поверхности катода происходит восстановление катионов натрия, при этом образуются атомы натрия:
катод (-) Na + +e à Na
На поверхности анода окисляются гидрокисд-ионы, при этом выделяется кислород и образуются молекулы воды:
анод (+) 4 OH — – 4 e à 2 H 2 O + O 2
Запишем вместе уравнения процессов, происходящих на катоде и аноде:
катод (-) Na + + e à Na
анод (+) 4 OH — – 4 e à 2 H 2 O + O 2
Число электронов, участвующих в реакции восстановления катионов натрия и в реакции окисления гидроксид-ионов, должно быть одинаковым. Поэтому умножим первое уравнение на 4:
катод (-) Na + + e à Na 4
анод (+) 4 OH — – 4 e à 2 H 2 O + O 2 1
Сложим вместе оба уравнения и получим уравнение реакции электролиза:
4 NaOH à 4 Na + 2 H 2 O + O 2
Пример 3. Рассмотрим электролиз расплава Al 2 O 3
При помощи этой реакции получают алюминий из боксита – природного соединения, в котором содержится много оксида алюминия. Температура плавления оксида алюминия очень высокая (более 2000º С), поэтому к нему добавляют специальные добавки, понижающие температуру плавления до 800-900º С. В расплаве оксид алюминия диссоциирует на ионы Al 3+ и O 2- . H а катоде восстанавливаются катионы Al 3+ , превращаясь в атомы алюминия:
На аноде окисляются анионы O 2- , превращаясь в атомы кислорода. Атомы кислорода сразу же соединяются в молекулы О2:
2 O 2- – 4 e à O 2
Число электронов, участвующих в процессах восстановления катионов алюминия и окисления ионов кислорода, должно быть равно, поэтому умножим первое уравнение на 4, а второе на 3:
Al 3+ +3 e à Al 0 4
2 O 2- – 4 e à O 2 3
Сложим оба уравнения и получим общее уравнение электролиза:
4 Al 3+ + 6 O 2- à 4 Al 0 +3 O 2 0 (ионное уравнение реакции)
В случае пропускания электрического тока через водный раствор электролита дело осложняется тем, что в растворе присутствуют молекулы воды, которые также могут взаимодействовать с электронами. Вспомним, что в молекуле воды атомы водорода и кислорода связаны полярной ковалентной связью. Электроотрицательность кислорода больше, чем электроотрицательность водорода, поэтому общие электронные пары смещены к атому кислорода. На атоме кислорода возникает частичный отрицательный заряд, его обозначают δ-, а на атомах водорода -частичный положительный заряд, его обозначают δ+.
Благодаря такому смещению зарядов молекула воды имеет положительный и отрицательный «полюса». Поэтому молекулы воды могут положительно заряженным полюсом притягиваться к отрицательно заряженному электроду — катоду, а отрицательным полюсом — к положительно заряженному электроду — аноду. На катоде может происходить восстановление молекул воды, при этом выделяется водород:
На аноде может происходить окисление молекул воды с выделением кислорода:
Поэтому на катоде могут восстанавливаться либо катионы электролита, либо молекулы воды. Эти два процесса как бы конкурируют между собой. Какой процесс в действительности происходит на катоде, зависит от природы металла. Будут ли на катоде восстанавливаться катионы металла или молекулы воды, зависит от положения металла в ряду напряжений металлов.
Li K Na Ca Mg Al ¦¦ Zn Fe Ni Sn Pb (H2) ¦¦ Cu Hg Ag Au
Если металл находится в ряду напряжений правее водорода, на катоде восстанавливаются катионы металла и выделяется свободный металл. Если металл находится в ряду напряжений левее алюминия, на катоде восстанавливаются молекулы воды и выделяется водород. Наконец, в случае катионов металлов от цинка до свинца может происходить либо выделение металла, либо выделение водорода, а иногда одновременно выделяются и водород, и металл. Вообще это довольно сложный случай, многое зависит от условий реакции: концентрации раствора, сипы электрического тока и других.
На аноде также может происходить один из двух процессов — либо окисление анионов электролита, либо окисление молекул воды. Какой именно процесс будет протекать на самом деле, зависит от природы аниона. При электролизе солей бескислородных кислот или самих кислот на аноде окисляются анионы. Единственным исключением является фторид-ион F — . В случае кислородсодержащих кислот на аноде окисляются молекулы воды и выделяется кислород.
Пример 1. Давайте рассмотрим электролиз водного раствора хлорида натрия.
В водного растворе хлорида натрия будут находиться катионы натрия Na + , анионы хлора Cl — и молекулы воды.
2 NaCl à 2 Na + + 2 Cl —
2Н2О à 2 H + + 2 OH —
катод (-) 2 Na + ; 2 H + ; 2Н + + 2е à Н 0 2
анод (+) 2 Cl — ; 2 OH — ; 2 Cl — – 2е à 2 Cl 0
Химическая активность анионов в ряду уменьшается.
Пример 2. А если в состав соли входит SO 4 2- ? Рассмотрим электролиз раствора сульфата никеля ( II ). Сульфата никеля ( II ) диссоциирует на ионы Ni 2+ и SO 4 2- :
Катионы никеля находятся между ионами металлов Al 3+ и Pb 2+ , занимающих в ряду напряжения среднее положение, процесс восстановления на катоде происходит по обеим схемам:
катод (-) Ni 2+ ; H + ; Ni 2+ + 2е à Ni 0
Анионы кислородсодержащих кислот не окисляются на аноде ( ряд активности анионов), происходит окисление молекул воды:
анод (+) SO4 2- ; OH — ; 2H2O – 4 е à O2 + 4H +
Запишем вместе уравнения процессов, происходящих на катоде и аноде:
катод (-) Ni 2+ ; H + ; Ni 2+ + 2е à Ni 0
анод (+) SO4 2- ; OH — ; 2H2O – 4 е à O2 + 4H +
В процессах восстановления участвуют 4 электрона и в процессе окисления тоже участвуют 4 электрона. Сложим вместе эти уравнения и получим общее уравнение реакции:
Ni 2+ +2 H 2 О + 2 H 2 О à Ni 0 + H 2 + 2ОН — + O 2 + 4 H +
В правой части уравнения находятся одновременно ионы Н + и OH — , которые соединяются с образованием молекул воды:
Н + + OH — à H 2 О
Поэтому в правой части уравнения вместо 4 ионов Н + и 2 ионов OH — запишем 2 молекулы воды и 2 иона Н + :
Ni 2+ +2 H 2 О + 2 H 2 О à Ni 0 + H 2 +2 H 2 О + O 2 + 2 H +
Сократим по две молекулы воды в обеих частях уравнения:
Ni 2+ +2 H 2 О à Ni 0 + H 2 + O 2 + 2 H +
Это краткое ионное уравнение. Чтобы получить полное ионное уравнение, нужно добавить в обе части по сульфат-иону SO 4 2- , образовавшиеся при диссоциации сульфата никеля ( II ) и не участвовавшие в реакции:
Таким образом, у нас при электролизе раствора сульфата никеля ( II ) на катоде выделяется водород и никель, а на аноде – кислород.
Пример 3. Написать уравнения процессов, происходящих при электролизе водного раствора сульфата натрия с инертным анодом.
Стандартный электродный потенциал системы Na + + e = Na 0 значительно отрицательнее потенциала водного электрода в нейтральной водной среде (-0,41 В).Поэтому на катоде будет происходить электрохимическое восстановление воды, сопровождающееся выделением водорода
2Н2О à 2 H + + 2 OH —
а ионы Na + , приходящие к катоду, будут накапливаться в прилегающей к нему части раствора (катодное пространство).
На аноде будет происходить электрохимическое окисление воды, приводящее к выделению кислорода
2 H 2 O – 4е à O 2 + 4 H +
поскольку отвечающий этой системе стандартный электродный потенциал (1,23 В) значительно ниже, чем стандартный электродный потенциал (2,01 В), характеризующий систему
Ионы SO 4 2- , движущиеся при электролизе к аноду, будут накапливаться в анодном пространстве.
Умножая уравнение катодного процесса на два, и складывая его с уравнением анодного процесса, получаем суммарное уравнение процесса электролиза:
6 H 2 O = 2 H 2 + 4 OH — + O 2 + 4 H +
Приняв во внимание, что одновременно происходит накопление ионов в катодном пространстве и ионов в анодном пространстве, суммарное уравнение процесса можно записать в следующей форме:
Таким образом, одновременно с выделением водорода и кислорода образуется гидроксид натрия (в катодном пространстве) и серная кислота (в анодном пространстве).
Пример 4. Электролиз раствора сульфата меди ( II ) CuSO 4 .
Катод (-) 2+ + SO4 2- à анод (+)
катод (-) Cu 2+ + 2e à Cu 0 2
анод (+) 2H2O – 4 е à O2 + 4H + 1
В растворе остаются ионы Н + и SO 4 2- , т. к. накапливается серная кислота.
Пример 5. Электролиз раствора хлорида меди ( II ) CuCl 2 .
Катод (-) 2+ + 2Cl — à анод (+)
катод (-) Cu 2+ + 2e à Cu 0
анод (+) 2Cl — – 2e à Cl 0 2
В обоих уравнениях участвуют по два электрона.
Cu 2+ + 2e à Cu 0 1
2Cl — -– 2e à Cl2 1
Cu 2+ + 2 Cl — à Cu 0 + Cl 2 (ионное уравнение)
CuCl 2 à Cu + Cl 2 (молекулярное уравнение)
Пример 6. Электролиз раствора нитрата серебра AgNO 3 .
Катод (-) + + NO3 — à Анод (+)
катод (-) Ag + + e à Ag 0
Ag + + e à Ag 0 4
4 Ag + + 2 H 2 O à 4 Ag 0 + 4 H + + O 2 (ионное уравнение)
4 Ag + + 2 H 2 O à 4 Ag 0 + 4 H + + O 2 + 4 NO 3 — (полное ионное уравнение)
4 AgNO 3 + 2 H 2 O à 4 Ag 0 + 4 HNO 3 + O 2 (молекулярное уравнение)
Пример 7. Электролиз раствора соляной кислоты HCl .
Катод (-) H + + Cl — à анод (+)
катод (-) 2 H + + 2 e à H 2
анод (+) 2 Cl — – 2 e à Cl 2
2 H + + 2 Cl — à H 2 + Cl 2 (ионное уравнение)
2 HCl à H 2 + Cl 2 (молекулярное уравнение)
Пример 8. Электролиз раствора серной кислоты H 2 SO 4 .
Катод (-) + + SO4 2- à анод (+)
катод (-) 2H+ + 2e à H2
Пример 9. Электролиз раствора гидроксида калия KOH .
Катод (-) K + + OH — à анод (+)
Катионы калия не будут восстанавливаться на катоде, так как калий находится в ряду напряжения металлов левее алюминия, вместо этого будет происходить восстановление молекул воды:
катод (-) 2H2O + 2e à H2 +2OH — 2
анод (+) 4OH — — 4e à 2H2O +O2 1
Пример 10. Электролиз раствора нитрата калия KNO 3 .
катод (-) 2H2O + 2e à H2 + 2OH- 2
анод (+) 2H2O – 4 е à O2 + 4H+ 1
При пропускании электрического тока через растворы кислородосодержащих кислот, щелочей и солей кислородсодержащих кислот с металлами, находящимися в ряду напряжения металлов, левее алюминия, практически происходит электролиз воды. При этом на катоде выделяется водород, а на аноде кислород.
Выводы. При определении продуктов электролиза водных растворов электролитов можно в простейших случаях руководствоваться следующими соображениями:
1. Ионы металлов с малой алгебраической величиной стандартного потенциала – от Li + до Al 3+ включительно – обладают весьма слабой тенденцией к обратному присоединению электронов, уступая в этом отношении ионам H + (см. Ряд активности катионов). При электролизе водных растворов соединений, содержащих эти катионы, функцию окислителя на катоде выполняют ионы H + , восстанавливаясь при этом по схеме:
2 H 2 O + 2 е à H 2 + 2OH —
2. Катионы металлов с положительными значениями стандартных потенциалов ( Cu 2+ , Ag + , Hg 2+ и др.) обладают большой тенденцией к присоединению электронов по сравнению с ионами. При электролизе водных растворов их солей функцию окислителя на катоде выделяют эти катионы, восстанавливаясь при этом до металла по схеме, например:
Cu 2+ +2 e à Cu 0
3. При электролизе водных растворов солей металлов Zn , Fe , Cd , Ni и др., занимающих в ряду напряжения среднее положение между перечисленными группами, процесс восстановления на катоде происходит по обеим схемам. Масса, выделившегося металла не соответствует в этих случаях количеству протекшего электрического тока, часть которого расходуется на образование водорода.
4. В водных растворах электролитов функцию восстановителей по отношению к аноду-окислитею могут одноатомные анионы ( Cl — , Br — , J — ), кислородосодержащие анионы ( NO 3 — , SO 4 2- , PO 4 3- и другие), а также гидроксильные ионы воды. Более сильными восстановительными свойствами из них обладают галогенид ионы, за исключением F . Ионы OH занимают промежуточное положение между ними и многоатомными анионами. Поэтому при электролизе водных растворов HCl , HBr , HJ или их солеей на аноде происходит окисление галогенид-ионов по схеме:
2 X — -2 e à X 2 0
При электролизе водных растворов сульфатов, нитратов, фосфатов и т.п. функцию восстановителя выполняют ионы , окисляясь при этом по схеме:
4 HOH – 4 e à 2 H 2 O + O 2 + 4 H +
З а дача 1. При электролизе раствора сульфата меди на катоде выделилось 48 г меди. Найдите объем газа, выделившегося на аноде, и массу серной кислоты, образовавшейся в растворе.
Сульфат меди в растворе диссоциирует ни ионы Си 2+ и S 04 2 ‘.
Запишем уравнения процессов, происходящих на катоде и аноде. На катоде восстанавливаются катионы Си , на аноде происходит электролиз воды:
2H20-4e- = 4H + + 02 
Общее уравнение электролиза:
2Cu2+ + 2H2O = 2Cu + 4H+ + O2 (краткоеионное уравнение)
Добавим в обе части уравнения по 2 сульфат-иона, которые образуются при диссоциации сульфата меди, получим полное ионное уравнение:
2Си2+ + 2S042″ + 2Н20 = 2Cu + 4Н+ + 2SO4 2′ + О2
Перепишем уравнение в молекулярном виде:
2CuSO4 + 2H2O = 2Cu + 2H2SO4 + О2
Газ, выделяющийся на аноде — кислород. В растворе образуется серная кислота.
Молярная масса меди равна 64 г/моль, вычислим количество вещества меди:
По уравнению реакции при выделении на катоде 2 моль меди ла аноде выделяется 1 моль кислорода. На катоде выделилось 0,75 моль меди, пусть на аноде выделилось х моль кислорода. Составим пропорцию:
На аноде выделилось 0,375 моль кислорода,
Вычислим объем выделившегося кислорода:
V(O2) = v(O2)«VM = 0,375 моль«22,4 л/моль = 8,4 л
По уравнению реакции при выделении на катоде 2 моль меди в растворе образуется 2 моль серной кислоты, значит, если на катоде выделилось 0,75 моль меди, то в растворе образовалось 0,75 моль серной кислоты, v(H2SO4) = 0,75 моль. Вычислим молярную массу серной кислоты:
M(H2SO4) = 2-1+32+16-4 = 98 г/моль.
Вычислим массу серной кислоты:
m(H2S04) = v(H2S04>M(H2S04) = = 0,75 моль«98 г/моль = 73,5 г.
Ответ: на аноде выделилось 8,4 л кислорода; в растворе образовалось 73,5 г серной кислоты
Задача 2. Найдите объем газов, выделившихся на катоде и аноде, при электролизе водного раствора, содержащего 111,75 г хлорида калия. Какое вещество образовалось в растворе? Найдите его массу.
Хлорид калия в растворе диссоциирует на ионы К+ и Сl:
Ионы калия не восстанавливаются на катоде, вместо этого происходит восстановление молекул воды. На аноде окисляются хлорид-ионы и выделяется хлор:
2Н2О + 2е’ = Н2 + 20Н- |1
Общее уравнение электролиза:
2СГl+ 2Н2О = Н2 + 2ОН» + С12 (краткое ионное уравнение) В растворе присутствуют также ионы К+, образовавшиеся при диссоциации хлорида калия и не участвующие в реакции:
2К+ + 2Сl + 2Н20 = Н2 + 2К+ + 2ОН’ + С12
Перепишем уравнение в молекулярном виде:
2КС1 + 2Н2О = Н2 + С12 + 2КОН
На катоде выделяется водород, на аноде хлор, в растворе образуется гидроксид калия.
В растворе содержалось 111,75 г хлорида калия.
Вычислим молярную массу хлорида калия:
М(КС1) = 39+35,5 = 74,5 г/моль
Вычислим количество вещества хлорида калия:

По уравнению реакции при электролизе 2 моль хлорида калия выделяется 1 моль хлора. Пусть при электролизе 1,5 моль хлорида калия выделяется х моль хлора. Составим пропорцию:


Выделится 0,75 моль хлора, v(C!2) = 0,75 моль. По уравнению реакции при выделении 1 моль хлора на аноде на катоде выделяется 1 моль водорода. Следовательно, если на аноде выделится 0,75 моль хлора, то на катоде выделится 0,75 моль водорода, v(H2) = 0,75 моль.
Вычислим объем хлора, выделившегося на аноде:
V(C12) = v(Cl2)-VM = 0,75 моль«22,4 л/моль = 16,8 л.
Объем водорода равен объему хлора:
По уравнению реакции при электролизе 2 моль хлорида калия образуется 2 моль гидроксида калия, значит, при электролизе 0,75 моль хлорида калия образуется 0,75 моль гидроксида калия. Вычислим молярную массу гидроксида калия:
М(КОН) = 39+16+1 — 56 г/моль.
Вычислим массу гидроксида калия:
m(KOH) = v(KOH>M(KOH) = 0,75 моль-56 г/моль = 42 г.
Ответ: на катоде выделилось 16,8 л водорода, на аноде выделилось 16,8 л хлора, в растворе образовалось 42 г гидроксида калия.
Задача 3. При электролизе раствора 19 г хлорида двухвалентного металла на аноде выделилось 8,96 л хлора. Определите, хлорид какого металла подвергли электролизу. Вычислите объем водорода, выделившегося на катоде.
Обозначим неизвестный металл М, формула его хлорида МС12. На аноде окисляются хлорид-ионы и выделяется хлор. В условии сказано, что на катоде выделяется водород, следовательно, происходит восстановление молекул воды:
2Н20 + 2е- = Н2 + 2ОH |1
Общее уравнение электролиза:
2Сl + 2Н2О = Н2 + 2ОН» + С12 (краткое ионное уравнение)
В растворе присутствуют также ионы М2+, которые при реакции не изменяются. Запишем полное ионное уравнение реакции:
2СГ + М2+ + 2Н2О = Н2 + М2+ + 2ОН- + С12
Перепишем уравнение реакции в молекулярном виде:
МС12 + 2Н2О — Н2 + М(ОН)2 + С12
Найдем количество вещества выделившегося на аноде хлора:
По уравнению реакции при электролизе 1 моль хлорида неизвестного металла выделяется 1 моль хлора. Если выделилось 0,4 моль хлора, то электролизу подвергли 0,4 моль хлорида металла. Вычислим молярную массу хлорида металла:
Молярная масса хлорида неизвестного металла 95 г/моль. На два атома хлора приходится 35,5»2 = 71 г/моль. Следовательно, молярная масса металла равна 95-71 = 24 г/моль. Этой молярной массе соответствует магний.
По уравнению реакции на 1 моль выделившегося на аноде хлора приходится 1 моль выделившегося на катоде водорода. В нашем случае на аноде выделилось 0,4 моль хлора, значит, на катоде выделилось 0,4 моль водорода. Вычислим объем водорода:
V(H2) = v(H2>VM = 0,4 моль«22,4 л/моль = 8,96 л.
Ответ: электролизу подвергли раствор хлорида магния; на катоде выделилось 8,96 л водорода.
*3адача 4. При электролизе 200 г раствора сульфата калия с концентрацией 15% на аноде выделилось 14,56 л кислорода. Вычислите концентрацию раствора по окончании электролиза.
В растворе сульфата калия и на катоде, и на аноде реагируют молекулы воды:
2Н20 + 2е’ = Н2 + 20Н- |2
2Н2О — 4е’ = 4Н+ + О2 ! 1
Сложим вместе оба уравнения:
6Н2О = 2Н2 + 4ОН» + 4Н+ + О2, или
6Н2О = 2Н2 + 4Н2О + О2, или
Фактически при электролизе раствора сульфата калия происходит электролиз воды.
Концентрация растворенного вещества в растворе определяется по формуле:
С=m(растворенного вещества) 
Чтобы найти концентрацию раствора сульфата калия по окончании электролиза, необходимо знать массу сульфата калия и массу раствора. Масса сульфата калия при реакции не изменяется. Вычислим массу сульфата калия в исходном растворе. Обозначим концентрацию исходного раствора Сь
m(K2S04) = C2 (K2S04 ) 

Масса раствора во время электролиза изменяется, так как часть воды превращается в водород и кислород. Вычислим количество вещества выделившегося кислорода:

По уравнению реакции из 2 моль воды образуется 1 моль кислорода. Пусть 0,65 моль кислорода выделяется при разложении х моль воды. Составим пропорцию:
Разложилось 1,3 моль воды, v(H2O) = 1,3 моль.
Вычислим молярную массу воды:
М(Н2О) =1-2+16=18 г/моль.
Вычислим массу разложившейся воды:
m(H2O) = v(H2O>M(H2O) = 1,3 моль* 18 г/моль = 23,4 г.
Масса раствора сульфата калия уменьшилась на 23,4 г и стала равна 200-23,4 = 176,6 г. Вычислим теперь концентрацию раствора сульфата калия по окончании электролиза:
С2 (K2 SO4 )=m(K2 SO4 ) 

Ответ: концентрация раствора по окончании электролиза равна 17%.
*3адача 5. 188,3 г смеси хлоридов натрия и калия растворили в воде и пропустили через полученный раствор электрический ток. При электролизе на катоде выделилось 33,6 л водорода. Вычислите состав смеси в процентах по массе.
После растворения смеси хлоридов калия и натрия в воде в растворе содержатся ионы К+, Na+ и Сl-. Ни ионы калия, ни ионы натрия не восстанавливаются на катоде, восстанавливаются молекулы воды. На аноде окисляются хлорид-ионы и выделяется хлор:
2Н2О + 2е’ = Н2 + 2ОН» ] 1
Общее уравнение электролиза:
2СГ + 2Н2О = Н2 + 2ОН» + С12 (краткое ионное уравнение)
Полные ионные уравнения реакций электролиза хлорида натрия и хлорида калия.
2К+ + 2Cl 

2Na+ + 2С1 

Перепишем уравнения в молекулярном виде:
2КС1 + 2Н20 = Н2 + С12 + 2КОН
2NaCl + 2Н2О = Н2 + С12 + 2NaOH
Обозначим количество вещества хлорида калия, содержащегося в смеси, х моль, а количество вещества хлорида натрия у моль. По уравнению реакции при электролизе 2 моль хлорида натрия или калия выделяется 1 моль водорода. Поэтому при электролизе х моль хлорида калия образуется х/2 или 0,5х моль водорода, а при электролизе у моль хлорида натрия 0,5у моль водорода. Найдем количество вещества водорода, выделившегося при электролизе смеси:
Составим уравнение: 0,5х + 0,5у =1,5
Вычислим молярные массы хлоридов калия и натрия:
М(КС1) = 39+35,5 = 74,5 г/моль
M(NaCl) = 23+35,5 = 58,5 г/моль
Масса х моль хлорида калия равна:
m(KCl) = v(KCl)-M(KCl) = х моль-74,5 г/моль = 74,5х г.
Масса у моль хлорида натрия равна:
m(KCl) = v(KCl)-M(KCl) = у моль-74,5 г/моль = 58,5у г.
Масса смеси равна 188,3 г, составим второе уравнение:
74,5х + 58,5у= 188,3
Итак, решаем систему из двух уравнений с двумя неизвестными:
Из первого уравнения выразим х:
Подставим это значение х во второе уравнение, получим:
74,5-(3-у) + 58,5у= 188,3
223,5-74,5у + 58,5у= 188,3
Найдем теперь значение х:
В смеси содержится 0,8 моль хлорида калия и 2,2 моль хлорида натрия.
Вычислим массу хлорида калия и хлорида натрия:
m(KCl) = v(KCl) 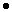
m(KCl) = v(KCl) 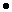
Вычислим массовую долю хлорида калия в смеси:
w(KCl)=m(KCl) 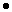
Вычислим массовую долю хлорида натрия:
w(NaCl) = 100% — w(KCl) = 68,35%
Ответ: в смеси содержится 31,65% хлорида калия и 68,35% хлорида натрия.
📺 Видео
Как писать уравнения электролиза? | Химия ЕГЭ 2022 | УмскулСкачать

Задание ЕГЭ №20. Электролиз расплавов и растворов.Скачать

Электролиз раствора сульфата меди(II)Скачать

уравнения электролизаСкачать

ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

Электролиз. Часть 2. Уравнения электролиза расплавов и растворов.Скачать

91. Электролиз. Задачи (часть 2)Скачать

Электролиз | ХИМИЯ ЕГЭ | Лия МенделееваСкачать

Электролиз: как понять и научиться писать реакции электролиза? | Химия ЕГЭ 2022 | УмскулСкачать

Электролиз | ХИМИЯ ЕГЭ | Лия МенделееваСкачать

ЕГЭ. Химия. #Урок5. Электролиз в заданиях ЕГЭСкачать

Электролиз растворов солей | Таисия Фламель | ЕГЭ Химия. ВебиумСкачать

Электролиз расплавов и растворов солей, щелочей, кислотСкачать

Выделение металлов - электролиз растворов сульфата меди (II) CuSO4 и нитрата железа (III) Fe(NO3)3Скачать