- Электролиз
- Электролиз растворов
- Катодные процессы
- Анодные процессы
- Суммарные процессы электролиза
- Электролиз расплавов
- Электролиз с растворимыми электродами
- Правила составления уравнений электронно-ионного баланса электролиза расплавов и растворов электролитов
- Правила составления окислительно-восстановительных реакций
- Электролиз растворов электролитов с инертными электродами
- Процессы, протекающие на катоде:
- Процессы, протекающие на аноде:
- Примеры:
- 🌟 Видео
Видео:Химия 8 класс Взаимодействие карбоната натрия и соляной кислотыСкачать

Электролиз
Химические реакции, сопровождающиеся переносом электронов (окислительно-восстановительные реакции) делятся на два типа: реакции, протекающие самопроизвольно и реакции, протекающие при прохождении тока через раствор или расплав электролита.
Раствор или расплав электролита помещают в специальную емкость — электролитическую ванну .
Электрический ток — это упорядоченное движение заряженных частиц — ионов, электронов и др. под действием внешнего электрического поля. Электрическое поле в растворе или расплаве электролита создают электроды .
Электроды — это, как правило, стержни из материала, проводящего электрический ток. Их помещают в раствор или расплав электролита, и подключают к электрической цепи с источником питания.
При этом отрицательно заряженный электрод катод — притягивает положительно заряженные ионы — катионы . Положительно заряженный электрод ( анод ) притягивает отрицательно заряженные частицы ( анионы ). Катод выступает в качестве восстановителя, а анод — в качестве окислителя.
Различают электролиз с активными и инертными электродами. Активные (растворимые) электроды подвергаются химическим превращениям в процессе электролиза. Обычно их изготавливают из меди, никеля и других металлов. Инертные (нерастворимые) электроды химическим превращениям не подвергаются. Их изготавливают из неактивных металлов, например, платины , или графита .
Видео:Все об электролизе и задании 20 за 20 минут | Химия ЕГЭ 2023 | УмскулСкачать

Электролиз растворов
Различают электролиз раствора или расплава химического вещества. В растворе присутствует дополнительное химическое вещество — вода, которая может принимать участие в окислительно-восстановительных реакциях.
Катодные процессы
В растворе солей катод притягивает катионы металлов. Катионы металлов могут выступать в качестве окислителей. Окислительные способности ионов металлов различаются. Для оценки окислительно-восстановительных способностей металлов применяют электро-химический ряд напряжений :
Каждый металл характеризуется значением электрохимического потен-циала. Чем меньше потенциал , тем больше восстановительные свойства металла и тем меньше окислительные свойства соответствующего иона этого металла. Разным ионам соответствуют разные значения этого потенциала. Электрохимический потенциал — относительная величина. Электрохимический потенциал водорода принят равным нулю.
Также около катода находятся молекулы воды Н2О. В составе воды есть окислитель — ион H + .
При электролизе растворов солей на катоде наблюдаются следующие закономерности:
1. Если металл в соли — активный ( до Al 3+ включительно в ряду напряжений ), то вместо металла на катоде восстанавливается (разряжается) водород , т.к. потенциал водорода намного больше. Протекает процесс восстановления молекулярного водорода из воды, при этом образуются ионы OH — , среда возле катода — щелочная:
2H2O +2ē → H2 + 2OH —
Например , при электролизе раствора хлорида натрия на катоде будет вос-станавливаться только водород из воды.
2. Если металл в соли – средней активности (между Al 3+ и Н + ) , то на катоде восстанавливается (разряжается) и металл , и водород , так как потенциал таких металлов сравним с потенциалом водорода:
Me n+ + nē → Me 0
2 H + 2O +2ē → H2 0 + 2OH —
Например , при электролизе раствора сульфата железа (II) на катоде будет восстанавливаться (разряжаться) и железо, и водород:
Fe 2+ + 2ē → Fe 0
2 H + 2O +2ē → H2 0 + 2OH —
3. Если металл в соли — неактивный (после водорода в ряду стандартных электрохимических металлов) , то ион такого металла является более сильным окислителем, чем ион водорода, и на катоде восстанавливается только металл:
Me n+ + nē → Me 0
Например, при электролизе раствора сульфата меди (II) на катоде будет восстанавливаться медь:
Cu 2+ + 2ē → Cu 0
4. Если на катод попадают катионы водорода H + , то они и восстанавливаются до молекулярного водорода:
2H + + 2ē → H2 0
Анодные процессы
Положительно заряженный анод притягивает анионы и молекулы воды. Анод – окислитель. В качестве восстановителей выступаю либо анионы кислотных остаток, либо молекулы воды (за счет кислорода в степени окисления -2: H 2 O -2 ).
При электролизе растворов солей на аноде наблюдаются следующие закономерности:
1. Если на анод попадает бескислородный кислотный остаток , то он окисляется до свободного состояния (до степени окисления 0):
неМе n- – nē = неМе 0
Например : при электролизе раствора хлорида натрия на аноде окисляют-ся хлорид-ионы:
2Cl — – 2ē = Cl2 0
Действительно, если вспомнить Периодический закон: при увеличении электроотрицательности неметалла его восстановительные свойства уменьшаются. А кислород – второй по величине электроотрицательности элемент. Таким образом, проще окислить практически любой неметалл, а не кислород. Правда, есть одно исключение . Наверное, вы уже догадались. Конечно же, это фтор. Ведь электроотрицательность фтора больше, чем у кислорода. Таким образом, при электролизе растворов фторидов окисляться будут именно молекулы воды, а не фторид-ионы :
2H2 O -2 – 4ē → O2 0 + 4H +
2. Если на анод попадает кислородсодержащий кислотный остаток, либо фторид-ион , то окислению подвергается вода с выделением молекулярно-го кислорода:
2H2 O -2 – 4ē → O2 0 + 4H +
3. Если на анод попадает гидроксид-ион, то он окисляется и происходит выделение молекулярного кислорода:
4 O -2 H – – 4ē → O2 0 + 2H2O
4. При электролизе растворов солей карбоновых кислот окислению под-вергается атом углерода карбоксильной группы, выделяется углекислый газ и соответствующий алкан.
Например , при электролизе растворов ацетатов выделяется углекислый газ и этан:
2 CH3 C +3 OO – –2ē → 2 C +4 O2+ CH3-CH3
Суммарные процессы электролиза
Рассмотрим электролиз растворов различных солей.
Например , электролиз раствора сульфата меди. На катоде восстанавливаются ионы меди:
Катод (–): Cu 2+ + 2ē → Cu 0
На аноде окисляются молекулы воды:
Анод (+): 2H2 O -2 – 4ē → O2 + 4H +
Сульфат-ионы в процессе не участвуют. Мы их запишем в итоговом уравнении с ионами водорода в виде серной кислоты:
2 Cu 2+ SO4 + 2H2 O -2 → 2 Cu 0 + 2H2SO4 + O2 0
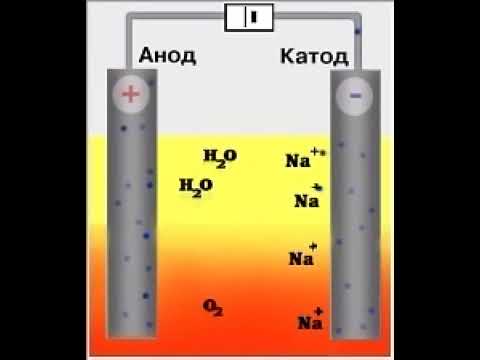
Электролиз раствора хлорида натрия выглядит так:
На катоде восстанавливается водород:
Катод (–): 2 H + 2O +2ē → H2 0 + 2OH –
На аноде окисляются хлорид-ионы:
Анод (+): 2 Cl – – 2ē → Cl2 0
Ионы натрия в процессе электролиза не участвуют. Мы записываем их с гидроксид-анионами в суммарном уравнении электролиза раствора хлорида натрия :
2 H + 2O +2Na Cl – → H2 0 + 2NaOH + Cl2 0
Следующий пример : электролиз водного раствора карбоната калия.
На катоде восстанавливается водород из воды:
Катод (–): 2 H + 2O +2ē → H2 0 + 2OH –
На аноде окисляются молекулы воды до молекулярного кислорода:
Анод (+): 2H2 O -2 – 4ē → O2 0 + 4H +
Таким образом, при электролизе раствора карбоната калия ионы калия и карбонат-ионы в процессе не участвуют. Происходит электролиз воды:
2 H2 + O -2 → 2 H2 0 + O2 0
Еще один пример : электролиз водного раствора хлорида меди (II).
На катоде восстанавливается медь:
Катод (–): Cu 2+ + 2ē → Cu 0
На аноде окисляются хлорид-ионы до молекулярного хлора:
Анод (+): 2 Cl – – 2ē → Cl2 0
Таким образом, при электролизе раствора карбоната калия происходит электролиз воды:
Cu 2+ Cl2 – → Cu 0 + Cl2 0
Еще несколько примеров: электролиз раствора гидроксида натрия.
На катоде восстанавливается водород из воды:
Катод (–): 2 H + 2O +2ē → H2 0 + 2OH –
На аноде окисляются гидроксид-ионы до молекулярного кислорода:
Анод (+): 4 O -2 H – – 4ē → O2 0 + 2H2O
Таким образом, при электролизе раствора гидроксида натрия происходит разложение воды, катионы натрия в процессе не участвуют:
2 H2 + O -2 → 2 H2 0 + O2 0
Видео:Электролиз. 10 класс.Скачать

Электролиз расплавов
При электролизе расплава на аноде окисляются анионы кислотных остатков, а на катоде восстанавливаются катионы металлов. Молекул воды в системе нет.
Например: электролиз расплава хлорида натрия. На катоде восстанавли-ваются катионы натрия:
Катод (–): Na + + ē → Na 0
На аноде окисляются анионы хлора:
Анод (+): 2 Cl – – 2ē → Cl2 0
Суммарное уравнение электролиза расплава хлорида натрия:
2 Na + Cl – → 2 Na 0 + Cl2 0
Еще один пример: электролиз расплава гидроксида натрия. На катоде восстанавливаются катионы натрия:
Катод (–): Na + + ē → Na 0
На аноде окисляются гидроксид-ионы:
Анод (+): 4 OH – – 4ē → O2 0 + 2H2O
Суммарное уравнение электролиза расплава гидроксида натрия:
4 Na + OH – → 4 Na 0 + O2 0 + 2H2O
Многие металлы получают в промышленности электролизом расплавов.
Например , алюминий получают электролизом раствора оксида алюминия в расплаве криолита. Криолит – Na3[AlF6] плавится при более низкой температуре (1100 о С), чем оксид алюминия (2050 о С). А оксид алюминия отлично растворяется в расплавленном криолите.
В растворе криолите оксид алюминия диссоциирует на ионы:
На катоде восстанавливаются катионы алюминия:
Катод (–): Al 3+ + 3ē → Al 0
На аноде окисляются алюминат-ионы:
Анод (+): 4Al O 3 3 – – 12ē → 2Al2O3 + 3 O2 0
Общее уравнение электролиза раствора оксида алюминия в расплаве криолита:
2 Al 2 О 3 = 4 Al 0 + 3 О 2 0
В промышленности при электролизе оксида алюминия в качестве электродов используют графитовые стержни. При этом электроды частично окисляются (сгорают) в выделяющемся кислороде:
C 0 + О2 0 = C +4 O2 -2
Видео:Карбонат натрия из пищевой содыСкачать

Электролиз с растворимыми электродами
Если материал электродов выполнен из того же металла, который присут-ствует в растворе в виде соли, или из более активного металла, то на аноде разряжаются не молекулы воды или анионы, а окисляются частицы самого металла в составе электрода.
Например , рассмотрим электролиз раствора сульфата меди (II) с медными электродами.
На катоде разряжаются ионы меди из раствора:
Катод (–): Cu 2+ + 2ē → Cu 0
На аноде окисляются частицы меди из электрода :
Анод (+): Cu 0 – 2ē → Cu 2+
Видео:Распознавание растворов хлорида натрия, карбоната натрия и сульфата натрияСкачать

Правила составления уравнений электронно-ионного баланса электролиза расплавов и растворов электролитов
Правила составления уравнений электронно-ионного баланса
электролиза расплавов и растворов электролитов.
I. Электролиз Р А С П Л А В О В.
На катоде НЕЗАВИСИМО от места расположения
металла в ряду активностей металлов ( в ряду напряжений )
ВСЕГДА восстанавливаются катионы металла:
n — заряд иона металла
На аноде рассматривают процессы окисления анионов
( ионов кислотных остатков ) и гидроксид ионов ( ОН — ).
( F -, Cl — , Br — , I — , S 2- ),
то происходит его
окисление до простого
(где Г-галоген: F, Cl, Br, I )
SO4 2- или СO3 2- ),
до молекул кислорода.
При этом образуется
стабильный в условиях
2 CO3e Þ 2 CO2 + O2
Гидроксид ионы ( ОН — ),
кислорода и воды:
4 ОН — — 4 е Þ O2 + 2 H2O
Если электролизу подвергается расплав оксида металла,
на аноде образуется кислород:
Оксид алюминия сначала диссоциирует в расплаве:
Al2O3 Þ Al 3+ + AlO3 3-
на аноде: 2 AlO3e Þ Al2O3 + 1,5 O2
II. Электролиз Р А С Т В О Р О В.
На катоде рассматривают процессы восстановления катионов металлов, ионов водорода и молекул воды. Для определения катодного процесса необходимо знать активность металла в водном растворе. Эту активность определяют по ряду активностей металлов в водных растворах ( ряд напряжений металлов ):
Li Rb K Ba Sr Ca Na Mg Al
Mn Zn Cr Fe Cd Co Ni Sn Pb
H2 Sb Bi Cu Hg Ag Pd Pt Au
Металл стоит в ряду
Металл стоит в ряду
МЕЖДУ алюминием и водородом.
Металл стоит в ряду
На катоде металл не
водород из воды:
2 H2O + 2 e Þ H2 + 2 OH —
На катоде происходят
восстановление металла и
n — заряд иона металла
2 H2O + 2 e Þ H2 + 2 OH —
происходит только процесс восстановления
n — заряд иона металла
На аноде рассматривают процессы окисления анионов
( ионов кислотных остатков ), гидроксид ионов ( ОН — ) и молекул воды.
Если анод из активного
металла (Сu, Ni, Fe),
то происходит только
( Cl — , Br — , I — , S 2- ),
то происходит его
окисление до простого
(где Г-галоген: Cl, Br, J )
( SO3 2- , SO4 2-, NO3 — ,
СO3 2- , PO4 3-, SiO3 2- и
кислорода из воды
до молекул кислорода:
2 H2O — 4 e Þ O2 + 4 H +
Если электролизу подвергается раствор щёлочи, то окислению подвергаются
атомы кислорода до молекул кислорода:
4 ОН — — 4 е Þ O2 + 2 H2O
Примеры составления уравнений электролиза.
I. Электролиз Р А С П Л А В О В.
Пример 1. Электролиз расплава хлорида меди (II).

 |  |
Катод ( ¾ ) : Cu 2+ + 2 e Þ Cu • 1
Катионы металла ( Cu 2+ )
при электролизе расплава
на катоде всегда
до простого вещества:
Анод ( + ) : 2 Cl — — 2 e Þ Cl2 • 1
кислоты ( Cl — ) при электролизе
расплава на аноде всегда окисляются
до простого вещества:
Cуммарное ионное уравнение электродных реакций:
Cu 2+ + 2 Сl — Þ Cu + Cl2
Над знаком Þ запишите
слово электролиз и знак
Cуммарное молекулярное уравнение
CuСl2 Þ Cu + Cl2
на катоде на аноде
Над знаком Þ запишите
слово электролиз и знак
Пример 2. Электролиз расплава сульфата калия.

 |  |
Катод ( ¾ ) : K+ + e Þ K • 2
Катионы металла ( K+ )
при электролизе расплава
на катоде всегда
до простого вещества:
Анод ( + ) : SO4e Þ SO2 + O2 • 1
кислоты ( SO4 2-) при электролизе
расплава на аноде всегда окисляются до кислорода и оксида неметалла:
Cуммарное ионное уравнение электродных реакций:

2 K+ + SO4 2- Þ 2 K + SO2 + О2
на катоде на аноде
Над знаком Þ запишите
слово электролиз и знак
Cуммарное молекулярное уравнение

K2SO4 Þ 2 K + SO2 + О2
на катоде на аноде
Над знаком Þ запишите
слово электролиз и знак
Пример 3. Электролиз расплава гидроксида натрия.

 |  |
Катод ( ¾ ) : Na+ + e Þ Na • 4
Катионы металла ( Na + )
при электролизе расплава
на катоде всегда
до простого вещества:
Анод ( + ) : 4 OH — — 4 e Þ 2 H2O + O2 • 1
Гидроксид ионы ( OH — )
при электролизе расплава
на аноде всегда окисляются до
кислорода и воды:
Cуммарное ионное уравнение

4 Na+ + 4 OH — Þ 4 Na + 2 H2O + О2
на катоде на аноде
Над знаком Þ запишите
слово электролиз и знак
Cуммарное молекулярное уравнение

4 NaOH Þ 4 Na + 2 H2O + О2
на катоде на аноде
Над знаком Þ запишите
слово электролиз и знак
Электролиз растворов с инертными электродами.
Инертные электроды — электроды, которые при электролизе служат лишь передатчиками электронов. Материал таких электродов не участвует в электродных процессах (например: Pt, Ir, C (графит)).
Пример 1. Электролиз раствора иодида натрия.

Ряд напряжений металлов:
Li Rb K Ba Sr Ca Na Mg Al
Mn Zn Cr Fe Cd Co Ni Sn Pb
H2 Sb Bi Cu Hg Ag Pd Pt Au
Катод ( ¾ ) : 2 H2O + 2 e Þ H2 + 2 OH — • 1
Натрий — стоит в ряду напряжений
левее алюминия, поэтому,
натрий при электролизе раствора
на катоде не восстанавливается,
а восстанавливается водород
Анод ( + ) : 2 I — — 2 e Þ I2 • 1
кислоты ( J — ) при электролизе
раствора на аноде всегда окисляются
до простого вещества:
Cуммарное ионное уравнение электродных реакций:

2 H2O + 2 I — Þ H2 + 2 OH — + I2
на катоде на аноде
Над знаком Þ запишите
Cуммарное молекулярное уравнение

2 NaI + 2 H2O Þ H2 + 2 NaOH + I2
на катоде на аноде
Над знаком Þ запишите
Пример 2. Электролиз раствора бромида железа (III).

Ряд напряжений металлов.
Li Rb K Ba Sr Ca Na Mg Al
Mn Zn Cr Fe Cd Co Ni Sn Pb
H2 Sb Bi Cu Hg Ag Pd Pt Au
Катод ( ¾ ) : Fe 3+ + 3 e Þ Fe
2 H2O + 2 e Þ H2 + 2 OH-
Железо — стоит в ряду напряжений
между алюминием и водородом,
поэтому, при электролизе раствора
на катоде железо восстанавливается,
вместе с водородом из молекул воды:
Анод ( + ) : 2 Br — — 2 e Þ Br2
кислоты ( Br — ) при электролизе
раствора на аноде всегда окисляются
до простого вещества:
На катоде происходят 2 реакции восстановления, поэтому, необходимо составить 2 суммарных уравнения электролиза. Для этого реакцию на аноде суммируют с каждой катодной реакцией.
Первая пара полуреакций:
Вторая пара полуреакций:


Катод (-): Fe 3+ + 3 e Þ Fe •2
Анод ( + ) : 2 Br — — 2 e Þ Br2 •3
Катод (-): 2 H2O + 2 e Þ H2 + 2 OH — •1
Анод ( + ): 2 Br — — 2 e Þ Br2 •1
Первое суммарное ионное
Второе суммарное ионное

2 Fe 3+ + 6 Br — Þ 2 Fe + 3 Br2
на катоде на аноде
Над знаком Þ запишите слово электролиз.
2 H2O + 2 Br — Þ H2 + 2 OH — + Br2
на катоде на аноде
Над знаком Þ запишите слово электролиз.
Cуммарное молекулярное уравнение
Cуммарное молекулярное уравнение

2 FeBr3 Þ 2 Fe + 3 Br2
на катоде на аноде
6 H2O+2 FeBr3 Þ 3 H2 +2 Fe(OH)3 ¯ + 3 Br2
на катоде на аноде
Пример 3. Электролиз раствора хлорида меди (II).

Ряд напряжений металлов.
Li Rb K Ba Sr Ca Na Mg Al
Mn Zn Cr Fe Cd Co Ni Sn Pb
H2 Sb Bi Cu Hg Ag Pd Pt Au
Катод ( ¾ ) : Cu 2+ + 2 e Þ Cu • 1
Медь ( Cu )- стоит в ряду напряжений
поэтому, при электролизе раствора
на катоде восстанавливаются
только атомы меди:
Анод ( + ) : 2 Cl — — 2 e Þ Cl2 • 1
кислоты ( Cl — ) при электролизе
раствора на аноде всегда окисляются
до простого вещества:
Cуммарное ионное уравнение электродных реакций:
Сu 2+ + 2 Cl — Þ Cu + Cl2
на катоде на аноде
Над знаком Þ запишите
Cуммарное молекулярное уравнение
СuCl2 Þ Cu + Cl2
на катоде на аноде
Над знаком Þ запишите
Пример 4. Электролиз раствора карбоната калия.

Ряд напряжений металлов.
Li Rb K Ba Sr Ca Na Mg Al
Mn Zn Cr Fe Cd Co Ni Sn Pb
H2 Sb Bi Cu Hg Ag Pd Pt Au
Катод ( ¾ ) : 2 H2O + 2 e Þ H2 + 2 OH — • 2
Калий ( K ) — стоит в ряду напряжений
левее алюминия, поэтому,
калий при электролизе раствора
на катоде не восстанавливается,
а восстанавливается водород
из молекул воды:
Анод ( + ) : 2 H2O — 4 e Þ O2 + 4 H+ • 1
кислоты ( CO3 2- ) при электролизе
раствора на аноде не окисляются,
а окисляются атомы кислорода
из молекул воды:
Cуммарное ионное уравнение электродных реакций:


4 H2O + 2 H2O Þ 2 H2 + 4 OH — + O2 + 4 H+
на катоде на аноде
6 H2O Þ 2 H2 + 4 OH — + O2 + 4 H+
на катоде на аноде
Над знаком Þ запишите
Cуммарное молекулярное уравнение электродных реакций:


6 H2O + 2 K2CO3 Þ 2 H2 + 4 KOH + O2 + 2 H2СО3
на катоде на аноде
6 H2O + 2 K2CO3 Þ 2 H2 + 4 KOH + O2 + 2 H2О + 2 CO2
электролиз на катоде на аноде
4 H2O + 2 K2CO3 Þ 2 H2 + 4 KOH + O2 + 2 CO2
на катоде на аноде
Над знаком Þ запишите
Пример 5. Электролиз раствора сульфата цинка.

Ряд напряжений металлов.
Li Rb K Ba Sr Ca Na Mg Al
Mn Zn Cr Fe Cd Co Ni Sn Pb
H2 Sb Bi Cu Hg Ag Pd Pt Au
Катод ( ¾ ) : Zn 2+ + 2 e Þ Zn
2 H2O + 2 e Þ H2 + 2 OH-
Цинк ( Zn )- стоит в ряду напряжений
между алюминием и водородом,
поэтому, при электролизе раствора
на катоде железо восстанавливается,
вместе с водородом из молекул воды:
Анод ( + ) : 2 H2O — 4 e Þ O2 + 4 H+
кислоты ( SO4 2- ) при электролизе
раствора на аноде не окисляются,
а окисляются атомы кислорода
из молекул воды:
На катоде происходят 2 реакции восстановления, поэтому, необходимо составить 2 суммарных уравнения электролиза. Для этого реакцию на аноде суммируют с каждой катодной реакцией.
Первая пара полуреакций:
Вторая пара полуреакций:


Катод (-): Zn 2+ + 2 e Þ Zn • 2
Анод ( + ) : 2 H2O — 4 e Þ O2 + 4 H+ • 1
Катод (-): 2 H2O + 2 e Þ H2 + 2 OH — • 2
Анод ( + ): 2 H2O — 4 e Þ O2 + 4 H+ • 1
Первое суммарное ионное
Второе суммарное ионное
2 Zn 2+ + 2 H2O Þ 2 Zn + O2 + 4 H+
на катоде на аноде
Над знаком Þ запишите слово электролиз.
4 H2O + 2 H2O Þ 2 H2 + 4 OH — + O2 + 4 H+
6 H2O Þ 2 H2 + 4 OH — + O2 + 4 H+
на катоде на аноде
Над знаком Þ запишите слово электролиз.
Cуммарное молекулярное уравнение
Cуммарное молекулярное уравнение
2 ZnSO4 + 2 H2O Þ 2 Zn + O2 + 2 H2SO4
на катоде на аноде
6 H2O + 4 ZnSO4 Þ 2 H2 + 2 Zn(OH)2 + O2+ 2 H2SO4
на катоде на аноде
Пример 6. Электролиз раствора нитрата серебра.

Ряд напряжений металлов.
Li Rb K Ba Sr Ca Na Mg Al
Mn Zn Cr Fe Cd Co Ni Sn Pb
H2 Sb Bi Cu Hg Ag Pd Pt Au
Катод ( ¾ ) : Ag+ + e Þ Ag • 4
Серебро ( Ag )- стоит в ряду
напряжений правее водорода,
поэтому, при электролизе раствора
на катоде восстанавливаются
только атомы меди:
Анод ( + ) : 2 H2O — 4 e Þ O2 + 4 H+ • 1
кислоты ( NO3 — ) при электролизе
раствора на аноде не окисляются,
а окисляются атомы кислорода
из молекул воды:
Cуммарное ионное уравнение электродных реакций:

4 Ag + + 2 H2O Þ 4 Ag + O2 + 4 H+
на катоде на аноде
Над знаком Þ запишите
Cуммарное молекулярное уравнение

4 AgNO3 + 2 H2O Þ 4 Ag + O2 + 4 HNO3
на катоде на аноде
Над знаком Þ запишите
Пример 7. Электролиз раствора соляной кислоты.

Ряд напряжений металлов.
Li Rb K Ba Sr Ca Na Mg Al
Mn Zn Cr Fe Cd Co Ni Sn Pb
H2 Sb Bi Cu Hg Ag Pd Pt Au


Катод ( ¾ ) : 2 H + + 2 e Þ H2 • 1
Ионы водорода ( H+ )
при электролизе раствора
на катоде восстанавливаются
до молекул водорода
Анод ( + ) : 2 Cl — — 2 e Þ Cl2 • 1
кислоты ( Cl — ) при электролизе
раствора на аноде всегда окисляются
до простого вещества:
Cуммарное ионное уравнение электродных реакций:
2 H + + 2 Cl — Þ H2 + Cl2
на катоде на аноде
Над знаком Þ запишите
Cуммарное молекулярное уравнение
2 HCl Þ H2 + Cl2
на катоде на аноде
Над знаком Þ запишите
Пример 8. Электролиз раствора серной кислоты.

Ряд напряжений металлов.
Li Rb K Ba Sr Ca Na Mg Al
Mn Zn Cr Fe Cd Co Ni Sn Pb
H2 Sb Bi Cu Hg Ag Pd Pt Au


Катод ( ¾ ) : 2 H + + 2 e Þ H2 • 2
Ионы водорода ( H+ )
при электролизе раствора
на катоде восстанавливаются
до молекул водорода
Анод ( + ) : 2 H2O — 4 e Þ O2 + 4 H+ • 1
кислоты ( SO4 2- ) при электролизе
раствора на аноде не окисляются,
а окисляются атомы кислорода
из молекул воды:
Cуммарное ионное уравнение электродных реакций:
4 H + + 2 H2O Þ 2 H2 + O2 + 4 H+
на катоде на аноде
Над знаком Þ запишите
В этом уравнении в левой и правой частях есть одинаковых частицы
( H + ), поэтому, в левой и правой
частях уравнения сократите эти
Cуммарное молекулярное уравнение

2 H2SO4 + 2 H2O Þ 2 H2 + O2 + 2 H2SO4
на катоде на аноде
2 H2O Þ 2 H2 + O2
на катоде на аноде
Над знаком Þ запишите
Пример 9. Электролиз раствора гидроксида калия.

Ряд напряжений металлов.
Li Rb K Ba Sr Ca Na Mg Al
Mn Zn Cr Fe Cd Co Ni Sn Pb
H2 Sb Bi Cu Hg Ag Pd Pt Au


Катод ( ¾ ) : 2 H2O + 2 e Þ H2 + 2 OH — • 2
Калий ( K )- стоит в ряду напряжений
левее алюминия, поэтому,
калий при электролизе раствора
на катоде не восстанавливается,
а восстанавливается водород
из молекул воды:
Анод ( + ) : 4 OH — — 4 e Þ 2 H2O + O2 • 1
Гидроксид ионы ( OH — )
при электролизе раствора
на аноде всегда окисляются до
кислорода и воды:
Cуммарное ионное уравнение электродных реакций:


4 H2O + 4 OH — Þ 2 H2 + 4 OH — + 2 H2O + O2
cокращаем на 2 молекулы воды
Над знаком Þ запишите
В этом уравнении в левой и правой частях есть одинаковых частицы
( OH — и H2O ), поэтому, в левой и правой частях уравнения
сократите эти частицы.
Cуммарное молекулярное уравнение
После сокращения имеем:
2 H2O Þ 2 H2 + O2
на катоде на аноде
Над знаком Þ запишите
Материал для дополнительного изучения.
II. Электролиз Р А С Т В О Р О В
C использованием растворимого анода.
При электролизе раствора электролита ( соли, щёлочи или кислоты ) с растворимым анодом ( например медным ( Cu ), никелевым ( Ni ), железным ( Fe ) ) не происходят процессы окисления анионов кислотного остатка, гидроксид-ионов (ОН — ) и молекул воды, а происходит разрушение анода ( окисление ) по реакции: _
n — заряд иона металла
Если анод из меди ( Сu ):
Если анод из меди ( Ni ):
Если анод из меди ( Fe ):
Пример 1. Электролиз раствора иодида натрия на медных электродах.

Ряд напряжений металлов.
Li Rb K Ba Sr Ca Na Mg Al
Mn Zn Cr Fe Cd Co Ni Sn Pb
H2 Sb Bi Cu Hg Ag Pd Pt Au


Катод ( ¾ ) : 2 H2O + 2 e Þ H2 + 2 OH — • 1
Натрий (Na )- стоит в ряду напряжений
левее алюминия, поэтому,
натрий при электролизе раствора
на катоде не восстанавливается,
а восстанавливается водород
из молекул воды:
Анод ( + ) : Cu — 2 e Þ Cu 2+ • 1
Независимо от того, каким анионом
всегда окисляется растворимый анод.
Cуммарное ионное уравнение электродных реакций:
2 H2O + Cu Þ H2 + 2 OH — + Cu 2+
на катоде на аноде
Над знаком Þ запишите

2 H2O + Cu + 2 NaJ Þ H2 + 2 NaOH + CuJ2
на катоде на аноде
Над знаком Þ запишите
Задания для самостоятельного решения.
Задание 1: Составьте уравнения электронного баланса процессов протекающих на электродах при электролизе расплавов. Напишите уравнения реакций электролиза.
1) хлорид кальция
2) бромид натрия
3) сульфат калия
4) карбонат натрия
5) гидроксид калия
6) хлорид железа (III)
7) сульфат натрия
8) карбонат калия
9) гидроксид натрия
Задание 2: Составьте уравнения электронного баланса процессов протекающих на электродах при электролизе растворов. Напишите уравнения реакций электролиза.
Видео:Часть 3-1. Электролиз расплава. Решаем примеры уравнений (подробно).Скачать

Правила составления окислительно-восстановительных реакций
Видео:Электролиз растворов. 1 часть. 10 класс.Скачать

Электролиз растворов электролитов с инертными электродами
Напомним, что на катоде протекают процессы восстановления, на аноде — процессы окисления.
Процессы, протекающие на катоде:
В растворе имеются несколько видов положительно заряженных частиц, способных восстанавливаться на катоде:
1) Катионы металла восстанавливаются до простого вещества, если металл находится в ряду напряжений правее алюминия (не включая сам Al). Например:
Zn 2+ +2e → Zn 0 .
2) В случае раствора соли или щелочи: катионы водорода восстанавливаются до простого вещества, если металл находится в ряду напряжений металлов до H2:
2H2O + 2e → H2 0 + 2OH – .
Например, в случае электролиза растворов NaNO3 или KOH.
3) В случае электролиза раствора кислоты: катионы водорода восстанавливаются до простого вещества:
2H + +2e → H2.
Например, в случае электролиза раствора H2SO4.
Процессы, протекающие на аноде:
На аноде легко окисляются кислотные остатки не содержащие кислород. Например, галогенид-ионы (кроме F – ), сульфид-анионы, гидроксид-анионы и молекулы воды:
1) Галогенид-анионы окисляются до простых веществ:
2Cl – – 2e → Cl2.
2) В случае электролиза раствора щелочи в гидроксид-анионах кислород окисляется до простого вещества. Водород уже имеет степень окисления +1 и не может быть окислен дальше. Также будет выделение воды — почему? Потому что больше ничего написать и не получится: 1) H + написать не можем, так как OH – и H + не могут стоять по разные стороны одного уравнения; 2) H2 написать также не можем, так как это был бы процесс восстановления водорода (2H + +2e → H2), а на аноде протекают только процессы окисления.
4OH – – 4e → O2 + 2H2O.
3) Если в растворе есть анионы фтора или любые кислородсодержащие анионы, то окислению будет подвергаться вода с подкислением прианодного пространства согласно следующему уравнению:
2H2O – 4e → O2 + 4H + .
Такая реакция идет в случае электролиза растворов кислородсодержащих солей или кислородсодержащих кислот. В случае электролиза раствора щелочи окисляться будут гидроксид-анионы согласно правилу 2) выше.
4) В случае электролиза раствора соли органической кислоты на аноде всегда происходит выделение CO2 и удвоение остатка углеродной цепи:
2R-COO – – 2e → R-R + 2CO2.
Видео:Опыты по химии. Электролиз раствора сульфата натрияСкачать

Примеры:
1. Раствор NaCl
Расписываем диссоциацию на ионы:
NaCl → Na + + Cl –
Металл Na стоит в ряду напряжений до алюминия, следовательно, восстанавливаться на катоде не будет (катионы остаются в растворе). Согласно правилу выше, на катоде восстанавливается водород. Хлорид-анионы будут окисляться на аноде до простого вещества:
К: 2Na + (в растворе)
2H2O + 2e → H2 0 + 2OH –
А: 2Cl – – 2e → Cl2
Коэффициент 2 перед Na + появился из-за наличия аналогичного коэффициента перед хлорид-ионами, так как в соли NaCl их соотношение 1:1.
Проверяем, что количество принимаемых и отдаваемых электронов одинаковое, и суммируем левые и правые части катодных и анодных процессов:
2Na + + 2Cl – + 2H2O → H2 0 + 2Na + + 2OH – + Cl2. Соединяем катионы и анионы:
2NaCl + 2H2O → H2 0 + 2NaOH + Cl2.
2. Раствор Na2SO4
Расписываем диссоциацию на ионы:
Na2SO4 → 2Na + + SO4 2–
Натрий стоит в ряду напряжений до алюминия, следовательно, восстанавливаться на катоде не будет (катионы остаются в растворе). Согласно правилу выше, на катоде восстанавливается только водород. Сульфат-анионы содержат кислород, поэтому окисляться не будут, также оставаясь в растворе. Согласно правилу выше, в этом случае окисляются молекулы воды:
К: 2H2O + 2e → H2 0 + 2OH –
А: 2H2O – 4e → O2 0 + 4H + .
Уравниваем число принимаемых и отдаваемых электронов на катоде и аноде. Для этого необходимо умножить все коэффициенты катодного процесса на 2:
К: 4H2O + 4e → 2H2 0 + 4OH –
А: 2H2O – 4e → O2 0 + 4H + .
Складываем левые и правые части катодных и анодных процессов:
6H2O → 2H2 0 + 4OH – + 4H + + O2 0 .
4OH- и 4H+ соединяем в 4 молекулы H2O:
6H2O → 2H2 0 + 4H2O + O2 0 .
Сокращаем молекулы воды, находящиеся по обе стороны уравнения, т.е. вычитаем из каждой части уравнения 4H2O и получаем итоговое уравнение гидролиза:
2H2O → 2H2 0 + O2 0 .
Таким образом, гидролиз растворов кислородсодержащих солей активных металлов (до Al включительно) сводится к гидролизу воды, так как ни катионы металлов, ни анионы кислотных остатков не принимают участие в окислительно-восстановительных процессах, протекающих на электродах.
3. Раствор CuCl2
Расписываем диссоциацию на ионы:
CuCl2 → Cu 2+ + 2Cl –
Медь находится в ряду напряжений металлов после водорода, следовательно, только она будет восстанавливаться на катоде. На аноде будут окисляться только хлорид-анионы.
К: Cu 2+ + 2e → Cu 0
A: 2Cl – – 2e → Cl2
Записываем суммарное уравнение:
CuCl2 → Cu 0 + Cl2.
4. Раствор CuSO4
Расписываем диссоциацию на ионы:
CuSO4 → Cu 2+ + SO4 2–
Медь находится в ряду напряжений металлов после водорода, следовательно, только она будет восстанавливаться на катоде. На аноде будут окисляться молекулы воды, так как кислородсодержащие кислотные остатки в растворах на аноде не окисляются.
К: Cu 2+ + 2e → Cu 0
A: SO4 2– (в растворе)
2H2O – 4e → O2 + 4H + .
Уравниваем количество электронов на катоде и аноде. Для это умножим все коэффициенты катодного уравнения на 2. Количество сульфат-ионов также необходимо удвоить, так как в сульфате меди соотношение Cu 2+ и SO4 2– 1:1.
К: 2Cu 2+ + 4e → 2Cu 0
A: 2SO4 2– (в растворе)
2H2O – 4e → O2 + 4H + .
Записываем суммарное уравнение:
2Cu 2+ + 2SO4 2– + 2H2O → 2Cu 0 + O2 + 4H + + 2SO4 2– .
Соединив катионы и анионы, получаем итоговое уравнение электролиза:
2CuSO4 + 2H2O → 2Cu 0 + O2 + 2H2SO4.
5. Раствор NiCl2
Расписываем диссоциацию на ионы:
NiCl2 → Ni 2+ + 2Cl –
Никель находится в ряду напряжений металлов после алюминия и до водорода, следовательно, на катоде будут восстанавливаться и металл, и водород. На аноде будут окисляться только хлорид-анионы.
К: Ni 2+ + 2e → Ni 0
2H2O + 2e → H2 0 + 2OH –
A: 2Cl – – 2e → Cl2
Уравниваем количество электронов, принимаемых и отдаваемых на катоде и аноде. Для этого умножаем все коэффициенты анодного уравнения на 2:
К: Ni 2+ + 2e → Ni 0
2H2O + 2e → H2 0 + 2OH –
Ni 2+ (в растворе)
A: 4Cl – – 4e → 2Cl2
Замечаем, что согласно формуле NiCl2, соотношение атомов никеля и хлора 1:2, следовательно, в раствор необходимо добавить Ni 2+ для получения общего количества 2NiCl2. Также это необходимо сделать, так как в растворе должны присутствовать противоионы для гидроксид-анионов.
Складываем левые и правые части катодных и анодных процессов:
Ni 2+ + Ni 2+ + 4Cl – + 2H2O → Ni 0 + H2 0 + 2OH – + Ni 2+ + 2Cl2.
Соединяем катионы и анионы для получения итогового уравнения электролиза:
2NiCl2 + 2H2O → Ni 0 + H2 0 + Ni(OH)2 + 2Cl2.
6. Раствор NiSO4
Расписываем диссоциацию на ионы:
NiSO4 → Ni 2+ + SO4 2–
Никель находится в ряду напряжений металлов после алюминия и до водорода, следовательно, на катоде будут восстанавливаться и металл, и водород. На аноде будут окисляться молекулы воды, так как кислородсодержащие кислотные остатки в растворах на аноде не окисляются.
К: Ni 2+ + 2e → Ni 0
2H2O + 2e → H2 0 + 2OH –
A: SO4 2– (в растворе)
2H2O – 4e → O2 + 4H + .
Проверяем, что количество принятых и отданных электронов совпадает. Также замечаем, что в растворе есть гидроксид-ионы, но в записи электродных процессов для них нет противоионов. Следовательно, нужно добавить в раствор Ni 2+ . Так как удвоилось количество ионов никеля, необходимо удвоить и количество сульфат-ионов:
К: Ni 2+ + 2e → Ni 0
2H2O + 2e → H2 0 + 2OH –
Ni 2+ (в растворе)
A: 2SO4 2– (в растворе)
2H2O – 4e → O2 + 4H + .
Складываем левые и правые части катодных и анодных процессов:
Ni 2+ + Ni 2+ + 2SO4 2– + 2H2O + 2H2O → Ni 0 + Ni 2+ + 2OH – + H2 0 + O2 0 + 2SO4 2– + 4H + .
Соединяем катионы и анионы и записываем итоговое уравнение электролиза:
2NiSO4 + 4H2O → Ni 0 + Ni(OH)2 + H2 0 + O2 0 + 2H2SO4.
В других источниках литературы также говорится об альтернативном протекании электролиза кислородсодержащих солей металлов средней активности. Разница состоит в том, что после сложения левых и правых частей процессов электролиза необходимо соединить H + и OH – с образованием двух молекул воды. Оставшиеся 2H + расходуются на образование серной кислоты. В этом случае не нужно прибавлять дополнительные ионы никеля и сульфат-ионы:
Ni 2+ + SO4 2– + 2H2O + 2H2O → Ni 0 + 2OH – + H2 0 + O2 0 + SO4 2– + 4H + .
Ni 2+ + SO4 2– + 4H2O → Ni 0 + H2 0 + O2 0 + SO4 2– + 2H + + 2H2O.
NiSO4 + 2H2O → Ni 0 + H2 0 + O2 0 + H2SO4.
7. Раствор CH3COONa
Расписываем диссоциацию на ионы:
CH3COONa → CH3COO – + Na +
Натрий стоит в ряду напряжений до алюминия, следовательно, восстанавливаться на катоде не будет (катионы остаются в растворе). Согласно правилу выше, на катоде восстанавливается только водород. На аноде будет происходит окисление ацетат-ионов с образованием углекислого газа и удвоением остатка углеродной цепи:
К: 2Na + (в растворе)
2H2O + 2e → H2 0 + 2OH –
А: 2CH3COO – – 2e → CH3-CH3 + CO2
Так как количества электронов в процессах окисления и восстановления совпадают, составляем суммарное уравнение:
2Na + + 2CH3COO – + 2H2O → 2Na + + 2OH – + H2 0 + CH3-CH3 + CO2
Соединяем катионы и анионы:
2CH3COONa + 2H2O → 2NaOH + H2 0 + CH3-CH3 + CO2.
8. Раствор H2SO4
Расписываем диссоциацию на ионы:
H2SO4 → 2H + + SO4 2–
Из катионов в растворе присутствуют только катионы H+, они и будут восстанавливаться до простого вещества. На аноде будет протекать окисление воды, так как кислород содержащие кислотные остатки в растворах на аноде не окисляются.
К: 2H + +2e → H2
A: 2H2O – 4e → O2 + 4H +
Уравниваем число электронов. Для этого удваиваем каждый коэффициент в уравнении катодного процесса:
К: 4H + +4e → 2H2
A: 2H2O – 4e → O2 + 4H +
Суммируем левые и правые части уравнений:
4H + + 2H2O → 2H2 + O2 + 4H +
Катионы H + находятся в обеих частях реакции, следовательно, их нужно сократить. Получаем, что в случае растворов кислот, электролизу подвергаются только молекулы H2O:
2H2O → 2H2 + O2.
9. Раствор NaOH
Расписываем диссоциацию на ионы:
NaOH → Na + + OH –
Натрий стоит в ряду напряжений до алюминия, следовательно, восстанавливаться на катоде не будет (катионы остаются в растворе). Согласно правилу, на катоде восстанавливается только водород. На аноде будут окисляться гидроксид-анионы с образованием кислорода и воды:
К: Na+ (в растворе)
2H2O + 2e → H2 0 + 2OH –
А: 4OH – – 4e → O2 + 2H2O
Уравниваем число электронов, принимаемых и отдаваемых на электродах:
К: Na + (в растворе)
4H2O + 4e → 2H2 0 + 4OH –
А: 4OH – – 4e → O2 + 2H2O
Суммируем левые и правые части процессов:
4H2O + 4OH – → 2H2 0 + 4OH – + O2 0 + 2H2O
Сокращая 2H2O и ионы OH – , получаем итоговое уравнение электролиза:
2H2O → 2H2 + O2.
Вывод:
При электролизе растворов 1) кислородсодержащих кислот;
2) щелочей;
3) солей активных металлов и кислородсодержащих кислот
на электродах протекает электролиз воды:
2H2O → 2H2 + O2.
🌟 Видео
Гидролиз солей. 9 класс.Скачать

Химия / 9 класс / ЭлектролизСкачать

Электролиз. Часть 2. Уравнения электролиза расплавов и растворов.Скачать

Как писать уравнения электролиза? | Химия ЕГЭ 2022 | УмскулСкачать

Электролиз растворов: получение кадмия, никеля, хлора, йода и других. [ChemistryToday]Скачать
![Электролиз растворов: получение кадмия, никеля, хлора, йода и других. [ChemistryToday]](https://i.ytimg.com/vi/CRgMweu9_nE/0.jpg)
Электролиз водного раствора хлорида натрияСкачать

Самый *ПРОСТОЙ* способ ПОЛУЧИТЬ ГИДРОКСИД КАЛИЯСкачать

Взаимодействие водных растворов хлорида алюминия и карбоната натрия AlCl3 + Na2CO3 + H2OСкачать

Электролиз. Часть 1. Процесс электролиза, основные закономерности.Скачать

Получение карбоната натрия - аналитического реагента. [ChemistryToday]Скачать
![Получение карбоната натрия - аналитического реагента. [ChemistryToday]](https://i.ytimg.com/vi/s_A2ri4V8YQ/0.jpg)
Электролиз расплава гидроксида натрияСкачать
Задачи №34 с электролизом. ЕГЭ по химииСкачать


























