Электролиз по Кольбе – это электролиз растворов солей карбоновых кислот. В ходе реакции образуются соответствующие алканы.
Например, рассмотрим электролиз водного раствора ацетата натрия CH3COONa. В водном растворе ацетат натрия практически полностью диссоциирует:
CH3COONa → CH3COO – + Na +
При этом на катод притягиваются катионы натрия Na + и молекулы воды H2O. Восстанавливаться на катоде будут молекулы воды, т.к. окислительные свойства ионов водорода превышают окислительные свойства катионов щелочных металлов:
K(-): 2H2O + 2e = H2 + 2OH –
На аноде окисляются ацетат-ионы, а именно, атом углерода карбоксильной группы. При этом от карбоксильной группы остаются метильные радикалы, которые образуют газообразный этан.
A(+): 2CH3COO – — 2e = 2CO2 + CH3–CH3
Суммарное уравнение электролиза водного раствора ацетата натрия:
В общем виде получается:
2R–COONa + 2H2O → H2 + 2NaOH + 2CO2 + R–R
То есть при электролизе раствора пропионата натрия образуется бутан:
Видео:Все об электролизе и задании 20 за 20 минут | Химия ЕГЭ 2023 | УмскулСкачать

Электролиз
Электролиз (греч. elektron — янтарь + lysis — разложение) — химическая реакция, происходящая при прохождении постоянного тока через электролит. Это разложение веществ на их составные части под действием электрического тока.
Процесс электролиза заключается в перемещении катионов (положительно заряженных ионов) к катоду (заряжен отрицательно), и отрицательно заряженных ионов (анионов) к аноду (заряжен положительно).
Итак, анионы и катионы устремляются соответственно к аноду и катоду. Здесь и происходит химическая реакция. Чтобы успешно решать задания по этой теме и писать реакции, необходимо разделять процессы на катоде и аноде. Именно так и будет построена эта статья.
Катод
К катоду притягиваются катионы — положительно заряженные ионы: Na + , K + , Cu 2+ , Fe 3+ , Ag + и т.д.
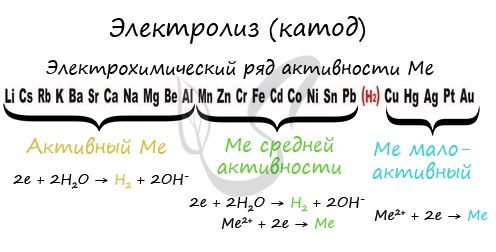
Чтобы установить, какая реакция идет на катоде, прежде всего, нужно определиться с активностью металла: его положением в электрохимическом ряду напряжений металлов.
Если на катоде появился активный металл (Li, Na, K) то вместо него восстанавливаются молекулы воды, из которых выделяется водород. Если металл средней активности (Cr, Fe, Cd) — на катоде выделяется и водород, и сам металл. Малоактивные металлы выделяются на катоде в чистом виде (Cu, Ag).
Замечу, что границей между металлами активными и средней активности в ряду напряжений считается алюминий. При электролизе на катоде металлы до алюминия (включительно!) не восстанавливаются, вместо них восстанавливаются молекулы воды — выделяется водород.
В случае, если на катод поступают ионы водорода — H + (например при электролизе кислот HCl, H2SO4) восстанавливается водород из молекул кислоты: 2H + — 2e = H2
К аноду притягиваются анионы — отрицательно заряженные ионы: SO4 2- , PO4 3- , Cl — , Br — , I — , F — , S 2- , CH3COO — .
При электролизе кислородсодержащих анионов: SO4 2- , PO4 3- — на аноде окисляются не анионы, а молекулы воды, из которых выделяется кислород.
Бескислородные анионы окисляются и выделяют соответствующие галогены. Сульфид-ион при оксилении окислении серу. Исключением является фтор — если он попадает анод, то разряжается молекула воды и выделяется кислород. Фтор — самый электроотрицательный элемент, поэтому и является исключением.
Анионы органических кислот окисляются особым образом: радикал, примыкающий к карбоксильной группе, удваивается, а сама карбоксильная группа (COO) превращается в углекислый газ — CO2.
Примеры решения
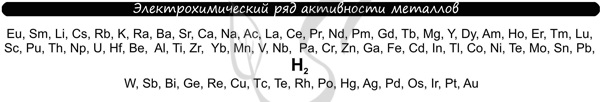
В процессе тренировки вам могут попадаться металлы, которые пропущены в ряду активности. На этапе обучения вы можете пользоваться расширенным рядом активности металлов.
Теперь вы точно будете знать, что выделяется на катоде 😉
Итак, потренируемся. Выясним, что образуется на катоде и аноде при электролизе растворов AgCl, Cu(NO3)2, AlBr3, NaF, FeI2, CH3COOLi.
Иногда в заданиях требуется записать реакцию электролиза. Сообщаю: если вы понимаете, что образуется на катоде, а что на аноде, то написать реакцию не составляет никакого труда. Возьмем, например, электролиз NaCl и запишем реакцию:
NaCl + H2O → H2 + Cl2 + NaOH (обычно в продуктах оставляют именно запись «NaOH», не подвергая его дальнейшему электролизу)
Натрий — активный металл, поэтому на катоде выделяется водород. Анион не содержит кислорода, выделяется галоген — хлор. Мы пишем уравнение, так что не можем заставить натрий испариться бесследно 🙂 Натрий вступает в реакцию с водой, образуется NaOH.
Запишем реакцию электролиза для CuSO4:
Медь относится к малоактивным металлам, поэтому сама в чистом виде выделяется на катоде. Анион кислородсодержащий, поэтому в реакции выделяется кислород. Сульфат-ион никуда не исчезает, он соединяется с водородом воды и превращается в серую кислоту.
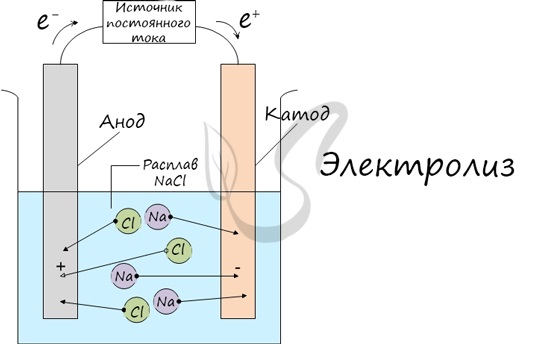
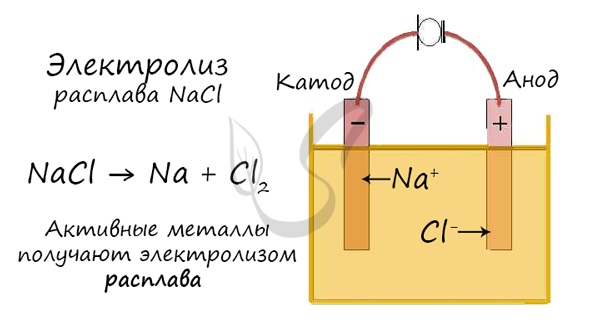
Электролиз расплавов
Все, что мы обсуждали до этого момента, касалось электролиза растворов, где растворителем является вода.
Перед промышленной химией стоит важная задача — получить металлы (вещества) в чистом виде. Малоактивные металлы (Ag, Cu) можно легко получать методом электролиза растворов.
Но как быть с активными металлами: Na, K, Li? Ведь при электролизе их растворов они не выделяются на катоде в чистом виде, вместо них восстанавливаются молекулы воды и выделяется водород. Тут нам как раз пригодятся расплавы, которые не содержат воды.
В безводных расплавах реакции записываются еще проще: вещества распадаются на составные части:
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Видео:Опыты по химии. Электролиз раствора сульфата натрияСкачать

Способ получения пероксимуравьиной кислоты и ее солей
Владельцы патента RU 2299878:
Настоящее изобретение относится к способу получения пероксимуравьиной кислоты и ее солей. Сущность предложенного способа заключается в том, что проводят электролиз 0,5-2,0 М водного раствора муравьиной кислоты или ее солей щелочных металлов в диафрагменном электролизере на диоксидно-свинцовом аноде при плотностях тока 0,05-0,5 А/см 2 в присутствии роданида аммония при его концентрации 1,0-1,5 г/л. Технический результат — исключение использования сильных взрывоопасных окислителей, высокая селективность процесса синтеза, возможность непрерывного осуществления процесса и получение конечного продукта высокой чистоты. 4 табл.
Изобретение относится к области технологии получения органических перекисных соединений, которые могут быть использованы для отбеливания целлюлозы, крахмала, очистки масел, как антисептик в медицине, в сельском хозяйстве, как инициатор в реакциях полимеризации и конденсации, в органическом синтезе при гидроксилировании жирных кислот и олефинов, а также в производстве окиси пропилена, глицидола и других эпоксисоединений (реакция Прилежаева).
Известен способ получения надмуравьиной кислоты из муравьиной кислоты с использованием концентрированных растворов перекиси водорода (в чистом виде муравьиная кислота не получена) [1].
Сущность препаративного синтеза надмуравьиной кислоты химическим методом заключается в том, что стехиометрическую смесь 85%-ной кислоты и 90%-ной перекиси водорода сливают в стеклянную колбу (вначале вливают перекись водорода, а затем муравьиную кислоту), встряхивают и оставляют на 12-16 часов при температуре не выше 10°С. Повышения концентрации надмуравьиной кислоты добиваются декантацией полученного раствора при низких температурах.
Недостаток химического способа получения растворов надмуравьиной кислоты в том, что:
— синтез протекает в несколько стадий;
— используются агрессивные окислители;
— применяется сложное технологическое оборудование для предотвращения взрывов и для поддержания низких температур.
Наиболее близким по технической сущности способом получения пероксимуравьиной кислоты является способ получения пероксиуксусной кислоты [2], сущность которого состоит в том, что проводят электролиз водных растворов ацетата щелочного металла или аммония в анодном отделении диафрагменного электролизера в присутствии 0,5-2,0 г/л добавки роданида щелочного металла или аммония при плотности тока 0,05-1,0 А/см 2 с последующим концентрированном образующегося водного раствора пероксикислоты выпариванием или вакуумной перегонкой.
Недостатком синтеза пероксиуксусной кислоты является ее электрохимическое получение из водных растворов солей уксусной кислоты в диафрагменном электролизере с использованием катионитовой мембраны при длительном электролизе. Электросинтез надуксусной кислоты непосредственно из уксусной не представляется возможным ввиду незначительной электропроводности последней.
Задачей настоящего изобретения является разработка способа электрохимического синтеза пероксимуравьиной кислоты и ее солей электролизом водных растворов муравьиной кислоты и ее солей щелочных металлов.
Техническим результатом данного изобретения являются селективность процесса синтеза и получение высокой чистоты конечных продуктов — пероксимуравьиной кислоты и ее солей. Электрохимический метод синтеза в отличие от химического протекает в одну стадию и может осуществляться непрерывно.
Сущностью предложенного способа получения пероксимуравьиной кислоты и ее солей является то, что проводят электролиз 0,5-2,0М водного раствора муравьиной кислоты и ее солей щелочных металлов в диафрагменном электролизере на диоксидно-свинцовом аноде при плотностях тока 0,05-0,5 А/см 2 в присутствии роданида аммония при его концентрации 1,0-1,5 г/л.
Предложенный метод синтеза заключается в том, что надмуравьиную кислоту получают как из водных растворов формиатов, так и непосредственно из муравьиной кислоты, т.к. последняя обладает достаточной электропроводностью для проведения электролиза при небольших напряжениях на электролизере (следует отметить, что электросинтез надуксусной кислоты осуществляют только из водных растворов ее солей [2]). Пероксиформиаты щелочных металлов можно синтезировать из водных растворов соответствующих формиатов.
Электролиз муравьиной кислоты и ее солей также как электролиз и других карбоновых кислот и их солей протекает по реакции синтеза Кольбе.
Однако в отличие от всех остальных карбоновых кислот (в том числе и угольная) и их солей в молекуле муравьиной кислоты и ее солей имеется водородный радикал. Это отличие и приводит к тому, что реакция синтеза Кольбе протекает по следующей схеме:
Как известно из литературы [3], НСООН на электродах из платиновых металлов еще при низких анодных потенциалах подвергается каталитическому распаду. Чтобы исключить каталитический распад, необходимо использовать диоксидно-свинцовый электрод. На аноде из диоксида свинца в присутствии известных ингибирующих кислородную реакцию добавок (F — , Cl — , SCN — ) реакция Кольбе в растворах муравьиной кислоты или ее солей протекает с участием молекул воды по следующей схеме:
с образованием пероксиформиат-ионов.
Однако электролизу водных растворов муравьиной кислоты и ее солей должно предшествовать модифицирование диоксидно-свинцового анода при низких потенциалах в присутствии поверхностно-активных добавок (CSN — , F — , Cl — ). На аноде с модифицированной поверхностью потенциал разряда молекул воды и выделения кислорода смещается в область высоких анодных потенциалов, где происходит окисление формиат-ионов до пероксиформиат-ионов по уравнению реакции (2).
В анодное отделение электролизера с катионитовой мембраной, разделяющей анодную и катодную части, заливают 60 мл водного раствора роданистого аммония из расчета 1,0 г/л. Анодом служит диоксидно-свинцовый электрод с геометрической поверхностью 4 см 2 . В катодное отделение заливают столько же по объему 0,1М раствора серной или соляной кислоты. В качестве материала катода использовали платину (Sгеом.=5 см 2 ) или пирографит с поверхностью 20 см 2 . После предварительной поляризации анода в исходном растворе плотностью тока 0,01 мА/см 2 к анолиту добавляют 3,2 мл 86%-ного водного раствора муравьиной кислоты. Затем плотность тока повышают до 0,05 А/см 2 и электролиз ведут в течение 3-х часов. Температура анолита в процессе электросинтеза поддерживается в пределах 10-20°С. При более высоких температурах выход конечного продукта падает из-за его постепенного разложения. Результаты электросинтеза надмуравьиной кислоты в зависимости от исходной концентрации НСООН представлены в табл.1.
Данные электросинтеза надмуравьиной кислоты в растворах муравьиной кислоты в зависимости от плотности тока и концентрации роданида аммония приведены в табл.3 и 4 соответственно.
Концентрирование полученных растворов пероксимуравьиной кислоты проводится выше описанным методом, как и в случае химического получения пероксимуравьиной кислоты.
Идентификацию конечного продукта осуществляли следующими качественными реакциями на перекисную группу:
1. Полученный раствор НСОООН взбалтывают, подкисляя несколькими каплями разбавленной серной кислоты с этиловым эфиром и несколькими каплями раствора бихромата калия; при этом эфирный слой окрашивается в темно-синий цвет от надхромовой кислоты, образовавшейся под влиянием пероксимуравьиной кислоты, растворившейся в эфире и придавшей ему указанную окраску. Хотя соли хромовых кислот являются окислителями, но при действии перекисей они способны окисляться в еще более богатую кислородом надхромовую кислоту Н2Cr2О8 по схеме:
Данная реакция позволяет обнаружить перекисное соединение при концентрации 0,001%.
2. Реакция с йодистым калием в присутствии винной кислоты. К 2 мл 5%-ной винной кислоты добавляют 2 капли 5%-ного раствора FeSO4 и (NH4)2SO4. После смешения с раствором пероксимуравьиной кислоты добавляют 5-6 капель едкого натра; при этом появляется фиолетовое окрашивание. Сульфат железа добавляют для ускорения реакции [4].
При идентификации пероксимуравьиной кислоты также применялся метод ИК — спектроскопии. Для сравнительного исследования были синтезированы соли натрия пероксимуравьиной кислоты химическим и электрохимическим методами. Установлено, что в спектре пероксиформиата натрия полосы поглощения, связанные с -O-O- группой, проявляются в области 1550-1450 см -1 (широкая полоса), и отчетливые полосы в областях 2760 см -1 и 2830 см -1 , которые отсутствуют в спектрах формиата натрия. Спектрометрическое определение проводили на спектрометре Infralum — FT-801 в диапазоне волн 500-4000 см -1 . Аподизация — треугольная, частота — 8 скан/сек. Образцы для снятия спектров готовились растиранием продуктов электролиза — солей пероксимуравьиной кислоты с бромистым калием и прессованием в микротаблетки в пресс-форме. Химически пероксиформиат натрия получали из пероксимуравьиной кислоты, синтезируемой методом, описанным в [1].
Количественное определение содержания активного кислорода в полученной пероксимуравьиной кислоте определяли методом йодометрического титрования.
Метод йодометрии основан на реакции:
Выделившийся йод оттитровывали 0,1н. раствором тиосульфата натрия. Индикатором служит раствор крахмала, дающий с йодом характерное синее окрашивание. Исследуемые растворы также сравнивали с приготовленными стандартными растворами на сходимость результатов, определяемых вышеописанным методом.
В анодное отделение электролизера с анионитовой мембраной, разделяющей анодную и катодную части, заливают 60 мл водного раствора роданистого аммония из расчета 1,3 г/л. В качестве анода использовали диоксидно-свинцовый электрод с поверхностью 4 см 2 . В катодное отделение заливают столько же по объему 0,1М раствора гидроксида натрия или калия. Катодом служит пластина из нержавеющей стали поверхностью 20 см 2 . После предварительной поляризации анода в растворе роданида аммония в течение 15-20 мин в анолите растворяли 4,08 г формиата натрия для получения 1,0 М раствора. Электролиз ведут при плотности тока 0,05 А/см 2 в течение 3-х часов. Температура анолита в процессе электросинтеза поддерживается в пределах 10-20°С. Установлено, что повышение температуры на электролизере отрицательно влияет на выход конечного продукта.
Как видно из табл.1 и 2, в растворах муравьиной кислоты и формиатов щелочных металлов с повышением концентрации исходного электролита более 2,0 М выход по току уменьшается.
Проводится аналогично примеру 2. Электролизу подвергались растворы солей муравьиной кислоты при различных значениях плотности тока. Результаты электролиза представлены в табл.3, по которым видно, что максимальные выходы по веществу и по току получаются при плотностях анодного тока 0,05-0,5 А/см 2 .
Проводится аналогично примеру 2. Электролизу подвергаются растворы НСООН и ее солей при различных концентрациях роданида аммония. Без добавки CSN — -ионов выход пероксимуравьиной кислоты и ее солей незначителен (табл.1 и 2). Из результатов опытов, представленных в табл.4, видно, что максимальные выходы по веществу и по току надмуравьиной кислоты с концентрациями добавки роданида аммония лежат в пределах 1,0-1,5 г/л, а для солей надмуравьиной кислоты — 0,5-2 г/л. При концентрациях NH4SCN>2 г/л выход по току падает и конечный продукт загрязняется роданидсодержащими соединениями.
Синтезируемые в водных растворах пероксимуравьиная кислота и ее соли по физическим и химическим свойствам идентичны соответствующим соединениям, получаемым известными химическими методами.
Приведенный метод электросинтеза пероксимуравьиной кислоты и ее солей перед традиционными химическими методами синтеза пероксимуравьиной кислоты имеет ряд преимуществ:
— исключает использование сильных окислителей (пероксид водорода, перманганат калия, надсерная кислота и т.д.);
— обладает селективностью для данного процесса синтеза и может регулироваться поддержанием тока или потенциала;
— осуществить процесс непрерывно;
— получение конечного продукта высокой чистоты, с которым и связано замедление его распада при комнатной температуре;
исключает взрывоопасность процесса синтеза; возможность автоматического контроля процесса синтеза.
| НСООН С, моль/л | NH4SCN С, г/л | i. А/см 2 | Q, А-ч | Выход | |
| По веществу, % | По току, % | ||||
| 0,2 | 0 | 0.1 | 1 | — | 23 |
| 0,2 | 1 | 0.1 | 1 | 40 | 52 |
| 0,5 | 1 | 0.1 | 2 | 47 | 56 |
| 1,0 | 1 | 0.1 | 3 | 60 | 70 |
| 1,5 | 1 | 0.1 | 4 | 58 | 72 |
| 2,0 | 1 | 0.1 | 5 | 49 | 65 |
| 2,5 | 1 | 0.1 | 5 | 35 | 48 |
| NaHCOO С, моль/л | NH4SCN С, г/л | i, А/см 2 | Q, А-ч | Выход | |
| По веществу, % | По току, % | ||||
| 0,2 | 0 | 0.1 | 1 | 10 | 22 |
| 0,2 | 1 | 0.1 | 1 | 67 | 70 |
| 0,5 | 1 | 0.1 | 2 | 70 | 75 |
| 1,0 | 1 | 0.1 | 3 | 78 | 81 |
| 1,5 | 1 | 0.1 | 4 | 80 | 85 |
| 2,0 | 1 | 0.1 | 5 | 75 | 81 |
| 2,5 | 1 | 0.1 | 5 | 42 | 51 |
| С, моль/л | NH4SCN С, г/л | i, А/см 2 | Q, А-ч | Выход | |
| По веществу, % | По току, % | ||||
| 1,0 NaHCOO | 1 | 0,005 | 3 | 27 | 31 |
| 1,0 NaHCOO | 1 | 0,01 | 3 | 46 | 55 |
| 1,0 КНСОО | 1 | 0,05 | 3 | 56 | 68 |
| 1,0 NaHCOO | 1 | 0,1 | 3 | 82 | 90 |
| 1,0 НСООН | 1 | 0,1 | 3 | 60 | 70 |
| 1,0 КНСОО | 1 | 0,25 | 3 | 76 | 80 |
| 1,0 КНСОО | 1 | 0,5 | 3 | 70 | 75 |
| 1,0 НСООН | 1 | 0,5 | 3 | 50 | 52 |
| 1,0 КНСОО | 1 | 0,8 | 3 | 52 | 60 |
| С, моль/л | NH4SCN С, г/л | i, А/см 2 | Q, A-ч | Выход | |
| По веществу, % | По току, % | ||||
| 1,0 NaHCOO | 0,5 | 0,1 | 2 | 28 | 36 |
| 1,0 НСООН | 0,5 | 0,1 | 2 | 13 | 20 |
| 1,0 NaHCOO | 0,1 | 0,1 | 2 | — | 32 |
| 1,0 КНСОО | 1,0 | 0,1 | 2 | 76 | 90 |
| 1,0 НСООН | 1,5 | 0,1 | 2 | 55 | 63 |
| 1,0 КНСОО | 1,5 | 0,1 | 2 | 65 | 75 |
| 1,0 NaHCOO | 2,0 | 0,1 | 2 | 35 | 41 |
| 1,0 НСООН | 2,0 | 0,1 | 2 | 16 | 23 |
1. Антоновский В.Л. Органические перекисные инициаторы. М., 1972, 341-361; Swern D., в кн. Organic peroxides, v.1, N.Y.-[a,o], 1970, p.313-474.
2. Патент РФ № 2216537, от 28.06.2002, бюл. № 32, 20.11.2003.
3. Смолин А.В., Подловченко Б.И., Максимов Ю.М. Электроокисление муравьиной кислоты в сернокислом электролите на электролитических осадках палладия. //Электрохимия. 1997. Т.33. № 4, с.477-484.
4. Перекись водорода и перекисные соединения. Под ред. проф. М.Е.Позина. ГНТИ ХЛ, М., 1951, с.482.
Способ получения пероксимуравьиной кислоты и ее солей, отличающийся тем, что проводят электролиз 0,5-2,0 М водного раствора муравьиной кислоты или ее солей щелочных металлов в диафрагменном электролизере на диоксидно-свинцовом аноде при плотностях тока 0,05-0,5 А/см 2 в присутствии роданида аммония при его концентрации 1,0-1,5 г/л.
💡 Видео
Электролиз. 10 класс.Скачать

Электролиз. Часть 2. Уравнения электролиза расплавов и растворов.Скачать

Электролиз растворов. 1 часть. 10 класс.Скачать

Электролиз раствора сульфата натрияСкачать

Электролиз раствора гидроксида натрияСкачать

Опыты по химии. Электролиз раствора йодида калияСкачать

Электролиз водного раствора хлорида натрияСкачать

Электролиз раствора KIСкачать

Опыты по химии. Электролиз раствора хлорида медиСкачать

Часть 3-2. Электролиз водных растворов. Примеры решений уравнений (подробно).Скачать

Металлы. Тема 39. Электролиз расплавов солей. Видеоопыт «Электролиз раствора хлорида меди»Скачать

ХИМИЯ 11 класс : Электролиз растворовСкачать

7. ЭлектролизСкачать

ЭлектролизСкачать

Электролиз раствора хлорида натрия | ЕГЭ по химииСкачать

Электролиз раствора нитрата калияСкачать

Делаю электролиз раствора нитрата калия при помощи модуля НПО УнитехСкачать

Электролиз. Часть 1. Процесс электролиза, основные закономерности.Скачать