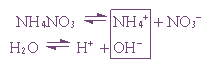
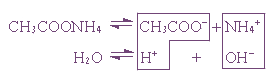
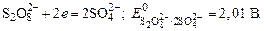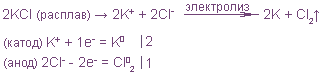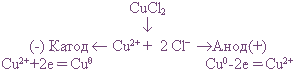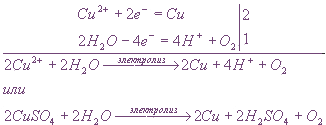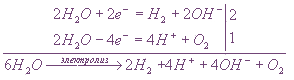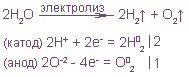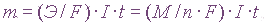Мы уже рассматривали электролиз растворов солей, теперь давайте разберем электролиз расплавов веществ.
В этой лекции мы рассмотрим электролиз расплавов трех видов веществ:
- электролиз расплавов оксидов;
- электролиз расплавов оснований;
- электролиз расплавов солей.
Для запоминания катодных и анодных процессов в электрохимии существует следующее мнемоническое правило:
- У анода анионыокисляются.
- На катоде катионы восстанавливаются.
В первой строке все слова начинаются с гласной буквы, во второй — с согласной.
КАТ од — КАТ ионы (ионы у кат ода)
АН од — АН ионы (ионы у ан ода)
- Электролиз расплавов оксидов
- Электролиз расплавов оснований
- Электролиз расплавов солей
- Электролиз. Законы Фарадея
- 1. Электролиз расплава хлорида меди (II).
- 2. Электролиз расплава хлорида калия:
- Электролиз растворов
- 1. На аноде могут образовываться следующие продукты:
- 2. На катоде могут образовываться следующие продукты:
- Пример: Электролиз водного раствора нитрата серебра на инертных электродах
- Пример: Электролиз водного раствора хлорида меди на инертных электродах
- Пример: Электролиз водного раствора хлорида магния на инертных электродах
- Пример: Электролиз водного раствора сульфата меди на инертных электродах
- Пример: Диссоциация сульфата калия в водном растворе:
- Электролиз расплава гидроксида натрия
- Закон Фарадея
- Гидролиз неорганических соединений
- Алгоритм написания уравнений реакций гидролиза соли слабой кислоты и силиного основания
- Алгоритм написания уравнений реакций гидролиза соли сильной кислоты и слабого основания
- Алгоритм написания уравнений реакций гидролиза соли слабой кислоты и слабого основания
- Алгоритм написания уравнений реакций гидролиза соли сильной кислоты и сильного основания
- 💡 Видео
Видео:Электролиз. 10 класс.Скачать

Электролиз расплавов оксидов
На катоде идет восстановление: Me n+ + ne — = Me 0 , т.е. на катоде выделяется металл.
На аноде окисляется кислород: O -2 -2e — = O2
Возьмем для примера электролиз расплава оксида калия: 2K2O -> 4K + O2
Видео:Опыты по химии. Электролиз раствора сульфата натрияСкачать

Электролиз расплавов оснований
На катоде традиционно восстанавливается металл:
На аноде будет окисляться кислород в составе гидроксид-группы:
Электролиз расплавов солей
1. Электролиз расплава бескислородной соли:
На катоде всегда восстанавливается металл: Me n+ +ne — = Me 0
На аноде окисляется бескислородный анион: A n- — ne — = A 0
Электролиз расплава NaCl: 2NaCl = 2Na + Cl2
2. Электролиз расплава кислородсодержащей соли (элемент аниона не в высшей степени окисления):
На катоде всегда восстанавливается металл: Me n+ +ne — = Me 0
На аноде будет окисляться элемент аниона: SO3 2- — 2e — = SO3
Например, электролиз расплава сульфита натрия:
S в сульфите имеет степень окисления +4, при электролизе она окисляется до +6 — SO3
3. Электролиз расплава кислородсодержащей соли (элемент аниона в высшей степени окисления):
На катоде все без изменений 🙂
На аноде — т.к. элемент уже в высшей степени окисления, то окисляться будет кислород:
Например, электролиз расплава карбоната натрия:
Важно понимать, что эти реакции не идут сами по себе. Их протекание возможно только при действии электрического тока.
Видео:Все об электролизе и задании 20 за 20 минут | Химия ЕГЭ 2023 | УмскулСкачать

Электролиз. Законы Фарадея
Пример 1. Напишите уравнения электродных процессов, протекающих при электролизе водного раствора MgSO4 с инертными электродами.
Решение. Стандартный электродный потенциал системы Mg 2+ + 2e ® Mg равен –2,363 В. Сульфат магния является солью, обра-зованной слабым основанием и сильной кислотой, поэтому вследствие гидролиза среда в его водном растворе будет слабокислотной (рН – ,
а ионы Мg 2+ будут накапливаться в прикатодном пространстве.
На аноде будет происходить электрохимическое окисление воды, приводящее к выделению кислорода:
поскольку отвечающий этой системе электродный потенциал кислородного электрода в слабокислотной среде
значительно меньше, чем стандартный потенциал, характеризующий систему:
Ионы 
Умножая уравнение катодного процесса на 2 для подведения баланса по электронам и складывая его с уравнением анодного процесса, получают суммарное уравнение процесса электролиза:
Принимая во внимание, что одновременно происходит накопление ионов магния в прикатодном пространстве и сульфат-ионов в прианодном пространстве, итоговое уравнение процесса можно записать так:
6 Н2О + 2MgSO4 = 2H2 + 2Mg(OH)2¯ + O2 + 4H + + 2
Следует учитывать, что гидроксид магния – малорастворимое соединение.
Пример 2. Написать уравнения процессов, протекающих при электролизе водного раствора, содержащего смесь солей Cu(NO3)2 и ZnBr2. Электроды графитовые.
Решение. На катоде возможно протекание следующих процессов:
Cu 2+ + 2e = Cu 
Zn 2+ + 2 e = Zn 
2H2O + 2e ® H2 + 2OH – 
Необходимо учитывать, что выделение водорода протекает со значительным перенапряжением.
Наибольший потенциал у первого процесса, поэтому на катоде будут восстанавливаться ионы меди:
На аноде возможно протекание следующих процессов:
2H2O – 4e = O2 + 4H + 
В прианодном пространстве накапливаются нитрат–ионы.
Суммарное уравнение процесса электролиза можно получить сложением уравнений катодного и анодного процессов:
Сu 2+ + 2Br – = Cu + Br2
Принимая во внимание, что одновременно происходит накопление ионов цинка в прикатодном пространстве и нитрат-ионов в прианодном, итоговое уравнение процесса можно записать так:
Сu(NO3)2 + ZnBr2 = Cu + Br2 + Zn 2+ + 2
Пример 3. Какие процессы будут протекать на железных электродах при электролизе водного раствора Al2(SO4)3 в атмосфере воздуха в нейтральной среде?
В атмосфере воздуха рН »7.
На катоде возможно протекание следующих процессов:
Fe 2+ + 2e = Fe 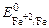
2H2O + 2e ® H2 + 2OH – 
Al 3+ + 3e = Al 
Вследствие того, что выделение водорода сопровождается перенапряжением, наибольший потенциал становится у первого процесса, поэтому на катоде будут восстанавливаться ионы железа: Fe 2+ + 2 e = Fe.
В прикатодном пространстве накапливаются ионы алюминия Al 3+ .
На железном аноде возможно протекание следующих процессов:
Fe – 2e = Fe 2+ 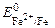


2H2O – 4e = O2 + 4H + 
При электролизе расплава хлорида натрия на электродах протекают процессы
Согласно первому закону Фарадея, время, необходимое для получения 150 г металлического натрия, определяем по формуле

где Mэк.(Na) – молярная масса эквивалента натрия, г/моль; z – число электронов, участвующих в электродном процессе; I – сила тока, А; F – постоянная Фарадея; h – выход по току.
Объем хлора образуется в количестве 1 моль и составляет
Пример 5. Серебрение изделий ведется в растворе азотнокислого электролита с плотностью тока 3 А/дм 3 . Рассчитать толщину серебряного слоя, образующегося за 2 мин, если выход по току h = 0,90. Плотность серебра r = 10 490 кг/м 3 .
Решение. Согласно закону Фарадея, масса выделившегося серебра

После преобразований находим толщину покрытия
где i = I/S – плотность тока; r – плотность металла.
Пример 6. Определите выход по току водорода, выделенного на электроде при нормальных условиях, если объем его составил 112 л при прохождении через электрод 1000 А×ч.
Решение. Объем моль эквивалента водорода при н.у. составляет 22,4/2 = 11,2 л. Для выделения такого объема водорода требуется количество электричества, равное 1F, или 26,8 А×ч., следовательно, для выделения 112 л потребуется 268 А×ч. Найдем выход по току водорода:

Пример 7. При электролизе водного раствора меди сульфата 
Решениезадачи следует начинать с описания объекта изучения – электрохимических реакций. До электролиза в растворе прошли реакции:
а) диссоциация
б) гидролиз
Электрохимическая система: (-) К С 
Процессы на катоде (–) и на аноде (+) А при электролизе:
Определим массу кислорода 
Молярная масса эквивалентов кислорода 
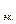
5,6 л 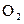
х =
На аноде выделилось 0,28/5,6 = 0,05 моль эквивалентов О2.
Вычислим массу меди 
Согласно второму закону Фарадея:
Пример 8. Через щелочной раствор, содержащий комплексные ионы двух- и четырехвалентного олова, 


Решение. Процессы диссоциации комплексных ионов в растворе:


Электрохимическая система: (–) К: Sn 
Примем, что электроосаждение происходит из ионов Sn 4+ и Sn 2+ :
(–) К: 

“Sn” (+) A: Sn
Масса олова 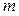
Масса олова 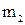
Общая масса выделившегося на катоде олова m:
Видео:Часть 3-1. Электролиз расплава. Решаем примеры уравнений (подробно).Скачать

1. Электролиз расплава хлорида меди (II).
Электродные процессы могут быть выражены полуреакциями:
на катоде K(-): Сu 2+ + 2e = Cu 0
на аноде A(+): 2Cl – — 2e = Cl2
Общая реакция электрохимического разложения вещества представляет собой сумму двух электродных полуреакций, и для хлорида меди она выразится уравнением:
Cu 2+ + 2 Cl – = Cu + Cl2
При электролизе щелочей и солей оксокислот на аноде выделяется кислород:
Видео:Электролиз раствора сульфата меди(II)Скачать

2. Электролиз расплава хлорида калия:
Электролиз растворов
Совокупность окислительно-восстановительных реакций, которые протекают на электродах в растворах или расплавах электролитов при пропускании через них электрического тока, называют электролизом.
источника тока происходит процесс передачи электронов катионам из раствора или расплава, поэтому катод является «восстановителем».
происходит отдача электронов анионами, поэтому анод является «окислителем».
При электролизе как на аноде, так и на катоде могут происходить конкурирующие процессы.
При проведении электролиза с использованием инертного (нерасходуемого)
анода (например, графита или платины), как правило, конкурирующими являются два окислительных и два восстановительных процесса:
— окисление анионов и гидроксид-ионов,
— восстановление катионов и ионов водорода.
При проведении электролиза с использованием активного (расходуемого)
анода процесс усложняется и конкурирующими реакциями на электродах являются:
— окисление анионов и гидроксид-ионов, анодное растворение металла — материала анода;
— восстановление катиона соли и ионов водорода, восстановление катионов металла, полученных при растворении анода.
При выборе наиболее вероятного процесса на аноде и катоде следует исходить из положения, что будет протекать та реакция, для которой требуется наименьшая затрата энергии. Кроме того, для выбора наиболее вероятного процесса на аноде и катоде при электролизе растворов солей с инертным электродом используют следующие правила:
Видео:ЭлектролизСкачать

1. На аноде могут образовываться следующие продукты:
а) при электролизе растворов, содержащих в своем составе анионы SO4 2- , NО — 3, РО4 3- , а также растворов щелочей на аноде окисляется вода и
б) при окислении анионов Сl — , Вr — , I — выделяются соответственно
А + Cl — +e — = Cl 0
Видео:ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

2. На катоде могут образовываться следующие продукты:
а) при электролизе растворов солей, содержащих ионы, расположенные в ряду напряжений левее Аl 3+ , на катоде восстанавливается вода и
б) если ион металла расположен в ряду напряжений правее водорода, то на катоде
К — Me n+ + ne — = Me 0
в) при электролизе растворов солей, содержащих ионы, расположенные в ряду напряжений между Al + и Н + , на катоде могут протекать конкурирующие процессы как
восстановления катионов, так и выделения водорода
Видео:Опыты по химии. Электролиз раствора хлорида медиСкачать

Пример: Электролиз водного раствора нитрата серебра на инертных электродах
Диссоциация нитрата серебра:
При электролизе водного раствора АgNО3 на катоде происходит восстановление ионов Аg + , а на аноде — окисление молекул воды:
Катод: Аg + + е = А g
Составьте схемы электролиза водных растворов: а) сульфата меди; б) хлорида магния; в) сульфата калия.
Во всех случаях электролиз проводится с использованием угольных электродов.
Видео:Электролиз. Часть 1. Процесс электролиза, основные закономерности.Скачать

Пример: Электролиз водного раствора хлорида меди на инертных электродах
Диссоциация хлорида меди:
В растворе находятся ионы Си 2+ и 2Сl — , которые под действием электрического тока направляются к соответствующим электродам:
Катод — Cu 2+ + 2e = Cu 0
Анод + 2Cl — — 2e = Cl2
На катоде выделяется металлическая медь, на аноде — газообразный хлор.
Если в рассмотренном примере электролиза раствора CuCl2 в качестве анода взять медную пластинку, то на катоде выделяется медь, а на аноде, где происходят процессы окисления, вместо разрядки ионов Сl 0 и выделения хлора протекает окисление анода (меди).
В этом случае происходит растворение самого анода, и в виде ионов Сu 2+ он переходит в раствор.
Электролиз CuCl2 с растворимым анодом можно записать так:
Электролиз растворов солей с растворимым анодом сводится к окислению материала анода (его растворению) и сопровождается переносом металла с анода на катод. Это свойство широко используется при рафинировании (очистке) металлов от загрязнений.
Видео:Электролиз. Получение хлора, получение свинца. Химия – ПростоСкачать

Пример: Электролиз водного раствора хлорида магния на инертных электродах
Диссоциация хлорида магния в водном растворе:
Ионы магния не могут восстанавливаться в водном растворе
(идет восстановление воды)
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Пример: Электролиз водного раствора сульфата меди на инертных электродах
В растворе сульфат меди диссоциирует на ионы:
Ионы меди могут восстанавливаться на катоде в водном растворе.
Сульфат-ионы в водном растворе не окисляются, поэтому на аноде будет протекать окисление воды.
Электролиз водного раствора соли активного металла и кислородсодержащей кислоты (К2SО4) на инертных электродах
Видео:Задание ЕГЭ №20. Электролиз расплавов и растворов.Скачать

Пример: Диссоциация сульфата калия в водном растворе:
Ионы калия и сульфат-ионы не могут разряжаться на электродах в водном растворе, следовательно,
на катоде будет протекать восстановление
аноде — окисление воды.
или, учитывая, что
(осуществляется при перемешивании),
H2O 
Если пропускать электрический ток через водный раствор соли активного металла и кислородсодержащей кислоты, то ни катионы металла, ни ионы кислотного остатка не разряжаются.
На катоде выделяется водород, а на аноде — кислород, и электролиз сводится к электролитическому разложению воды.
Видео:Электролиз. Часть 2. Уравнения электролиза расплавов и растворов.Скачать

Электролиз расплава гидроксида натрия
проводится всегда в присутствии инертного электролита (для увеличения электропроводности очень слабого электролита — воды):
Видео:7. ЭлектролизСкачать

Закон Фарадея
Зависимость количества вещества, образовавшегося под действием электрического тока, от времени, силы тока и природы электролита может быть установлена на основании обобщенного закона Фарадея:
— масса образовавшегося при электролизе вещества (г);
— эквивалентная масса вещества (г/моль);
— молярная масса вещества (г/моль);
— количество отдаваемых или принимаемых электронов;
— продолжительность процесса (с);
— константа Фарадея, характеризующая количество электричества, необходимое для выделения 1 эквивалентной массы вещества
(F = 96 500 Кл/моль = 26,8 Ач/моль).
Гидролиз неорганических соединений
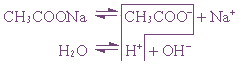
Взаимодействие ионов соли с водой, приводящее к образованию молекул слабого электролита, называют
Если рассматривать соль как продукт нейтрализации основания кислотой, то можно разделить соли на четыре группы, для каждой из которых гидролиз будет протекать по-своему.
1. Соль, образованная сильным основанием и сильной кислотой KBr, NaCl, NaNO3)
, гидролизу подвергаться не будет, так как в этом случае слабый электролит не образуется. Реакция среды остается нейтральной.
2. В соли, образованной слабым основанием и сильной кислотой FeCl2, NH4Cl, Al2(SO4)3, MgSO4)
гидролизу подвергается катион:
FeCl2 + HOH → Fe(OH)Cl + HCl
Fe 2+ + 2Cl — + H + + OH — → FeOH + + 2Cl — + Н +
В результате гидролиза образуется слабый электролит, ион H + и другие ионы. рН раствора
3. Соль, образованная сильным основанием и слабой кислотой (КClO, K2SiO3, Na2CO3, CH3COONa)
подвергается гидролизу по аниону, в результате чего образуется слабый электролит, гидроксид ион и другие ионы.
2K + +SiO3 2- + Н + + ОH — → НSiO3 — + 2K + + ОН —
рН таких растворов > 7 ( раствор приобретает щелочную реакцию).
гидролизуется и по катиону, и по аниону. В результате образуется малодиссоциирующие основание и кислота. рН растворов таких солей зависит от относительной силы кислоты и основания.
Алгоритм написания уравнений реакций гидролиза соли слабой кислоты и силиного основания
Различают несколько вариантов гидролиза солей:
1. Гидролиз соли слабой кислоты и сильного основания:
Пример 1. Гидролиз ацетата натрия.
или CH3COO – + Na + + H2O ↔ CH3COOH + Na + + OH –
Так как уксусная кислота слабо диссоциирует, ацетат-ион связывает ион H + , и равновесие диссоциации воды смещается вправо согласно принципу Ле Шателье.
В растворе накапливаются ионы OH — ( pH >7)
Если соль образована многоосновной кислотой, то гидролиз идет ступенчато.
Если соль образована многоосновной кислотой, то гидролиз идет ступенчато.
Например, гидролиз карбоната:
Практическое значение обычно имеет только процесс, идущий по первой ступени, которым, как правило, и ограничиваются при оценке гидролиза солей.
Равновесие гидролиза по второй ступени значительно смешено влево по сравнению с равновесием первой ступени, поскольку на первой ступени образуется более слабый электролит (HCO3 – ), чем на второй (H2CO3)
Пример 2 . Гидролиз ортофосфата рубидия.
1. Определяем тип гидролиза:
Рубидий – щелочной металл, его гидроксид — сильное основание, фосфорная кислота, особенно по своей третьей стадии диссоциации, отвечающей образованию фосфатов, — слабая кислота.
Идет гидролиз по аниону.
2. Пишем ионное уравнение гидролиза, определяем среду:
Продукты — гидрофосфат- и гидроксид-ионы, среда – щелочная.
3. Составляем молекулярное уравнение:
Получили кислую соль – гидрофосфат рубидия.
Алгоритм написания уравнений реакций гидролиза соли сильной кислоты и слабого основания
2. Гидролиз соли сильной кислоты и слабого основания:
Пример 1. Гидролиз нитрата аммония.
В случае многозарядного катиона гидролиз протекает ступенчато, например:
I ступень : Cu 2+ + HOH ↔ CuOH + + H +
II ступень : CuOH + + HOH ↔ Cu(OH)2 + H +
При этом концентрация ионов водорода и pH среды в растворе также определяются главным образом первой ступенью гидролиза.
Пример 2. Гидролиз сульфата меди(II)
1. Определяем тип гидролиза.
На этом этапе необходимо написать уравнение диссоциации соли:
Соль образована катионом слабого основания (подчеркиваем) и анионом сильной кислоты.
Идет гидролиз по катиону.
2. Пишем ионное уравнение гидролиза, определяем среду:
Cu 2+ + H-OH ↔ CuOH + + H + .
Образуется катион гидроксомеди(II) и ион водорода,
3. Составляем молекулярное уравнение.
Надо учитывать, что составление такого уравнения есть некоторая формальная задача. Из положительных и отрицательных частиц, находящихся в растворе, мы составляем нейтральные частицы, существующие только на бумаге. В данном случае мы можем составить формулу (CuOH)2SO4, но для этого наше ионное уравнение мы должны мысленно умножить на два.
Обращаем внимание, что продукт реакции относится к группе основных солей. Названия основных солей, как и названия средних, следует составлять из названий аниона и катиона, в данном случае соль назовем «сульфат гидроксомеди(II)».
Алгоритм написания уравнений реакций гидролиза соли слабой кислоты и слабого основания
3. Гидролиз соли слабой кислоты и слабого основания:
Пример 1. Гидролиз ацетата аммония.
В этом случае образуются два малодиссоциированных соединения, и pH раствора зависит от относительной силы кислоты и основания.
Если продукты гидролиза могут удаляться из раствора, например, в виде осадка или газообразного вещества, то гидролиз протекает до конца.
Пример 2. Гидролиз сульфида алюминия.
2А l 3+ + 3 S 2- + 6Н2О = 2Аl(OН)3(осадок) + ЗН2S (газ)
Пример 3. Гидролиз ацетата алюминия
1. Определяем тип гидролиза:
Соль образована катионом слабого основания и анионами слабой кислоты.
2. Пишем ионные уравнения гидролиза, определяем среду:
Al 3+ + H–OH ↔ AlOH 2+ + H + ,
Учитывая, что гидроксид алюминия очень слабое основание, предположим, что гидролиз по катиону будет протекать в большей степени, чем по аниону.
Следовательно, в растворе будет избыток ионов водорода, и среда будет кислая.
Не стоит пытаться составлять здесь суммарное уравнение реакции. Обе реакции обратимы, никак друг с другом не связаны, и такое суммирование бессмысленно.
3 . Составляем молекулярное уравнение:
Это тоже формальное упражнение, для тренировки в составлении формул солей и их номенклатуре. Полученную соль назовем ацетат гидроксоалюминия.
Алгоритм написания уравнений реакций гидролиза соли сильной кислоты и сильного основания
4. Соли, образованные сильной кислотой и сильным основанием
, гидролизу не подвергаются, т.к. единственным малодиссоциирующим соединением является H2O.
Соль сильной кислоты и сильного основания не подвергается гидролизу, и раствор нейтрален.
💡 Видео
Химия. 10 класс. Электролиз расплавов и растворов солей. Решение задач /25.11.2020/Скачать

Химия. Задачи на электролизСкачать

Часть 3-2. Электролиз водных растворов. Примеры решений уравнений (подробно).Скачать

Электролиз расплавов и растворов. 10 класс.Скачать

Гальванические элементы. 1 часть. 10 класс.Скачать

Электролиз растворов. 1 часть. 10 класс.Скачать