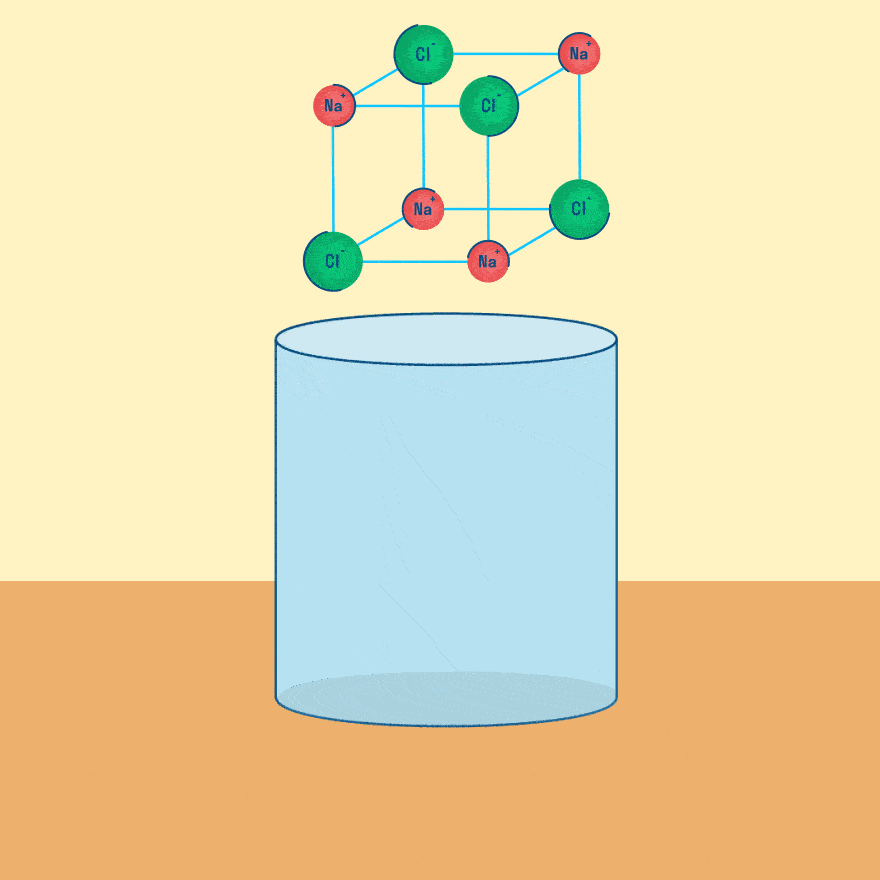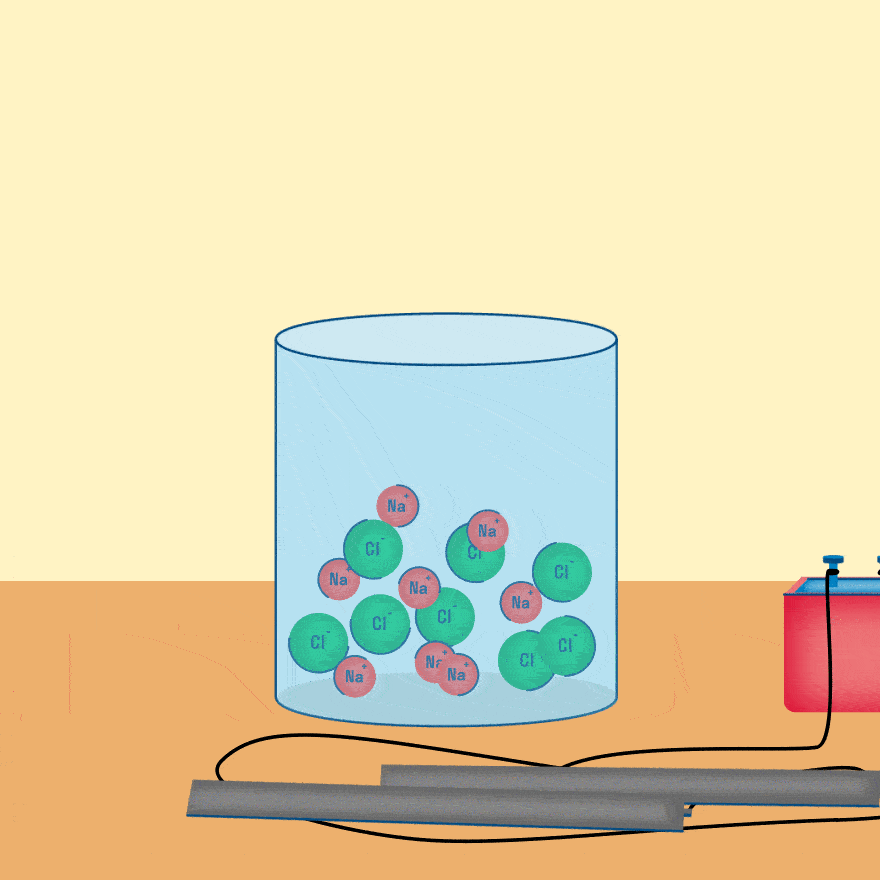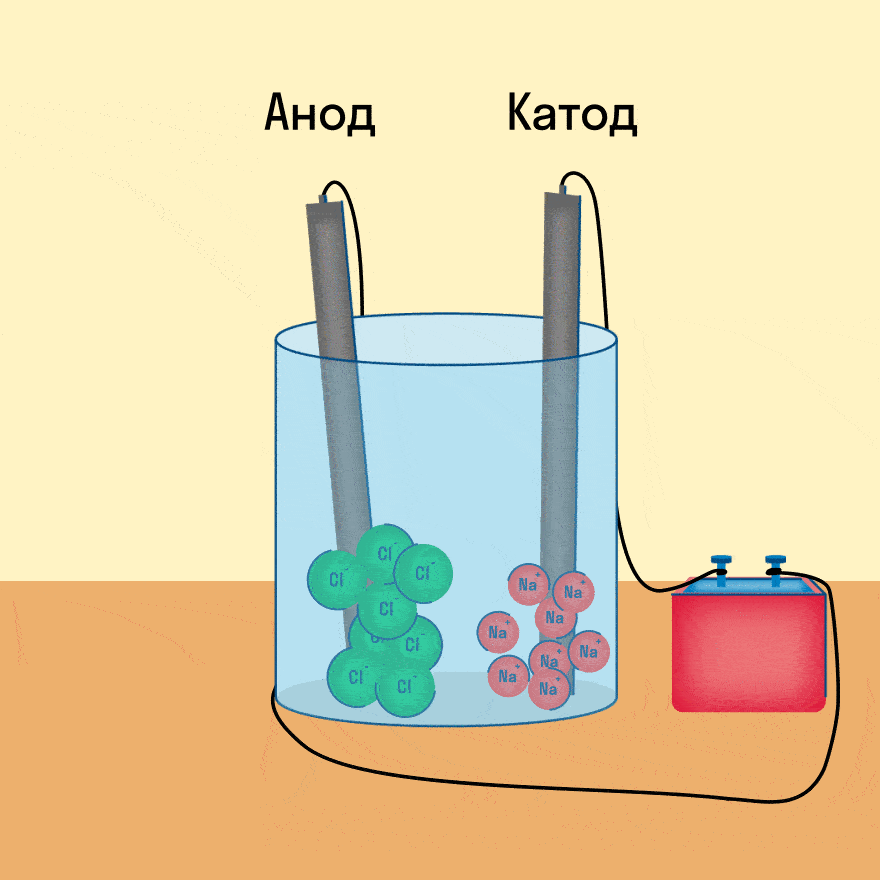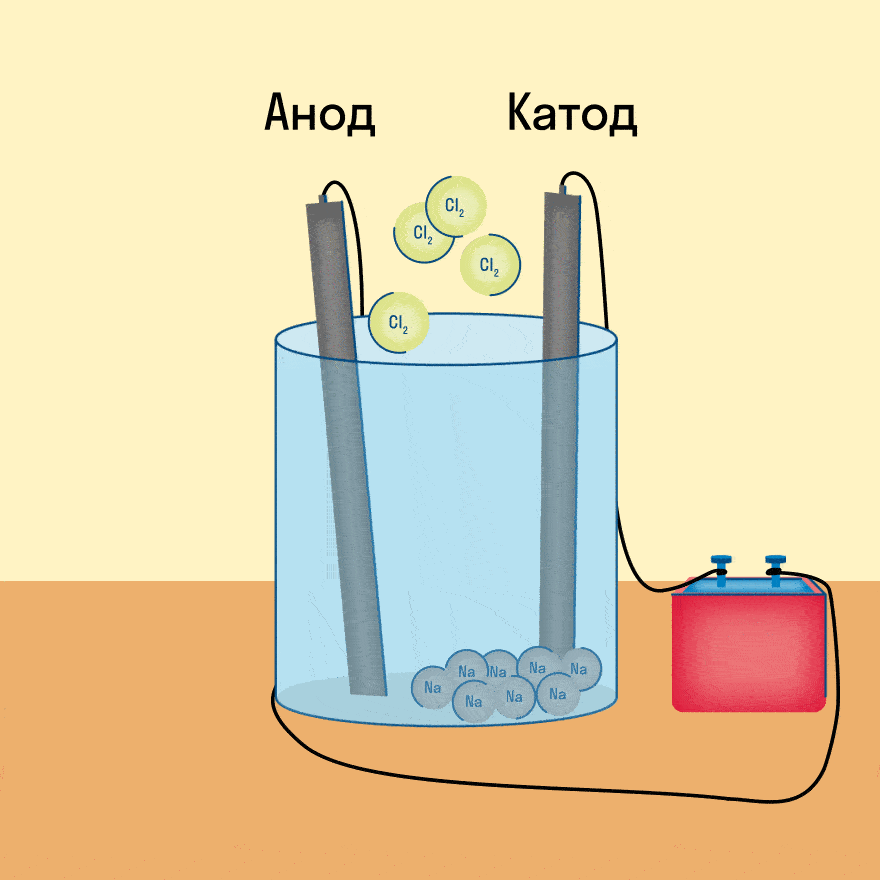
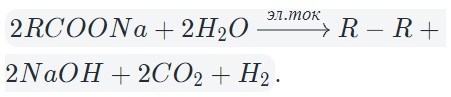Мы уже рассматривали электролиз растворов солей, теперь давайте разберем электролиз расплавов веществ.
В этой лекции мы рассмотрим электролиз расплавов трех видов веществ:
- электролиз расплавов оксидов;
- электролиз расплавов оснований;
- электролиз расплавов солей.
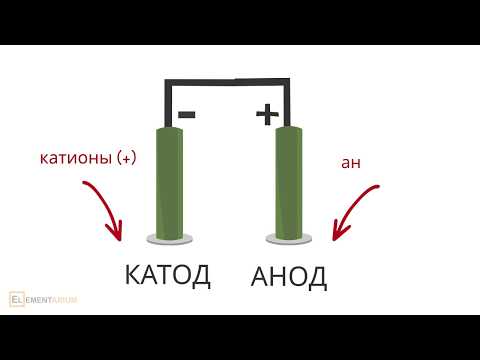
Для запоминания катодных и анодных процессов в электрохимии существует следующее мнемоническое правило:
- У анода анионыокисляются.
- На катоде катионы восстанавливаются.
В первой строке все слова начинаются с гласной буквы, во второй — с согласной.
КАТ од — КАТ ионы (ионы у кат ода)
АН од — АН ионы (ионы у ан ода)
- Электролиз расплавов оксидов
- Электролиз расплавов оснований
- Электролиз расплавов солей
- Please wait.
- We are checking your browser. gomolog.ru
- Why do I have to complete a CAPTCHA?
- What can I do to prevent this in the future?
- Электролиз расплавов и растворов
- Виды электролиза
- Электролиз расплава
- Электролиз раствора
- Применение электролиза
- Вопросы для самопроверки
- 🎥 Видео
Видео:Электролиз. 10 класс.Скачать

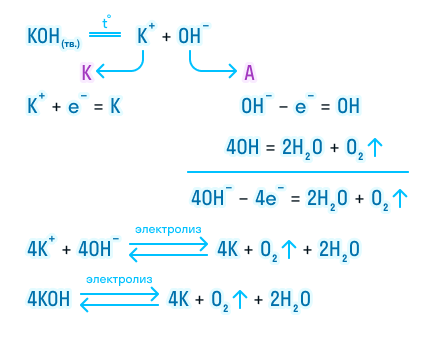
Электролиз расплавов оксидов
На катоде идет восстановление: Me n+ + ne — = Me 0 , т.е. на катоде выделяется металл.
На аноде окисляется кислород: O -2 -2e — = O2
Возьмем для примера электролиз расплава оксида калия: 2K2O -> 4K + O2
Видео:Электролиз. Часть 2. Уравнения электролиза расплавов и растворов.Скачать

Электролиз расплавов оснований
На катоде традиционно восстанавливается металл:
На аноде будет окисляться кислород в составе гидроксид-группы:
Электролиз расплавов солей
1. Электролиз расплава бескислородной соли:
На катоде всегда восстанавливается металл: Me n+ +ne — = Me 0
На аноде окисляется бескислородный анион: A n- — ne — = A 0
Электролиз расплава NaCl: 2NaCl = 2Na + Cl2
2. Электролиз расплава кислородсодержащей соли (элемент аниона не в высшей степени окисления):
На катоде всегда восстанавливается металл: Me n+ +ne — = Me 0
На аноде будет окисляться элемент аниона: SO3 2- — 2e — = SO3
Например, электролиз расплава сульфита натрия:
S в сульфите имеет степень окисления +4, при электролизе она окисляется до +6 — SO3
3. Электролиз расплава кислородсодержащей соли (элемент аниона в высшей степени окисления):
На катоде все без изменений 🙂
На аноде — т.к. элемент уже в высшей степени окисления, то окисляться будет кислород:
Например, электролиз расплава карбоната натрия:
Важно понимать, что эти реакции не идут сами по себе. Их протекание возможно только при действии электрического тока.
Видео:Все об электролизе и задании 20 за 20 минут | Химия ЕГЭ 2023 | УмскулСкачать

Please wait.
Видео:Часть 3-1. Электролиз расплава. Решаем примеры уравнений (подробно).Скачать

We are checking your browser. gomolog.ru
Видео:Электролиз растворов. 2 часть. 10 класс.Скачать

Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
Видео:уравнения электролизаСкачать

What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6de936f5df125953 • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Видео:Опыты по химии. Электролиз раствора сульфата натрияСкачать

Электролиз расплавов и растворов
О чем эта статья:
11 класс, ЕГЭ/ОГЭ
Электролиз — это окислительно-восстановительная реакция, которая протекает на электродах и основана на пропускании электрического тока через раствор или расплав.
Не менее важными участниками электролиза являются электроды: катод и анод. Если вы вдруг забыли, что такое катод и анод в химии, напомним.
Катод — это отрицательно заряженный электрод, который притягивает положительно заряженные ионы (катионы). А анод — это положительно заряженный электрод, который притягивает к себе отрицательно заряженные ионы (анионы). Таким образом, на катоде всегда происходит процесс восстановления, а на аноде всегда происходит процесс окисления.
Электроды бывают растворимые и инертные. Растворимые изготавливаются из металлов, например, меди и подвергаются химическим превращениям в ходе электролиза. А вот инертные или нерастворимые электроды не подвергаются химическим превращениям и остаются в неизменном виде как до реакции, так и после нее. Как правило, такие электроды изготавливают из графита или платины.
Видео:Электролиз расплавов и растворов. 10 класс.Скачать

Виды электролиза
Различают два вида электролиза:
Электролиз водного раствора.
Прежде чем мы рассмотрим каждый процесс отдельно, давай познакомимся с общими для двух видов процессами на электродах.
Процесс на катоде K (−)
Катион принимает электроны и восстанавливается:
Me +n + ne − → Me 0 (восстановление).
Процесс на аноде A (+)
Анион отдает электроны и окисляется:
неMe −n − ne − → неMe 0 (окисление).
Процессы, протекающие при электролизе в общем случае:
К − : Ме +n + ne − → Ме 0 ;
А + : неМе −n − ne − → неМе 0 .
Суммарное уравнение электролиза:
Видео:Электролиз раствора сульфата меди(II)Скачать

Электролиз расплава
Рассмотрим электролиз расплава пищевой соли — хлорида натрия. При сильном нагревании кристаллический твердый хлорид натрия плавится. Полученный расплав содержит подвижные ионы хлора и натрия, освободившиеся из кристаллической решетки, и проводит электрический ток.
К − : 2Na + + 2e − = 2Na 0
А + : 2Cl − − 2e − = Cl2
Суммарное уравнение электролиза:
При опускании в расплав угольных (инертных) электродов, присоединенных к источнику тока, ионы приобретают направленное движение: катионы движутся к отрицательно заряженному электроду (катоду), анионы — к положительно заряженному электроду (аноду) и отдают электроны.
Теперь давайте рассмотрим электролиз расплава гидроксида калия.
На катоде происходит восстановление калия за счет принятия электронов. А на аноде протекает более сложная реакция. Гидроксогруппы отдают свой электрон и становятся нейтральными, но такое состояние для них крайне невыгодно, так как неустойчиво, и они объединяются в группы, чтобы потом разложиться с выделением газообразного кислорода и воды
Итог электролиза расплава — металлический калий на катоде, газообразный кислород и пары воды на аноде.
Видео:Электролиз растворов. 1 часть. 10 класс.Скачать

Электролиз раствора
Основным отличием водного раствора от расплава является присутствие молекул воды и ионов H + и OH — как продуктов диссоциации воды. В связи с этим возле катода и анода скапливаются ионы, которые конкурируют как друг с другом, так и с молекулами воды. Рассмотрим электролиз на примере водного раствора KF:
К − : 4H2O + 4e − = 2H2 0 + 4OH −
Суммарное уравнение электролиза:
Как видно, ни калий, ни фтор не фигурируют в продуктах электролиза. Почему так происходит?
Наиболее активные металлы — сильные восстановители. Калий — как раз такой металл, поэтому обратный процесс восстановления активных металлов из соединений осуществить сложно. При электролизе водных растворов солей активных металлов на катоде протекает восстановление не катионов этих металлов, а воды с образованием водорода.
Разберем порядок восстановления катионов металлов на катоде в зависимости от их активности.
Последовательность разрядки катионов зависит от положения металла в электрохимическом ряду напряжения.
Если у катода накапливаются молекулы воды и катионы металла, который находится в ряду напряжения после водорода, то восстанавливаются ионы металла.
Если у катода накапливаются молекулы воды и катионы металла, который стоит в начале ряда напряжения от лития до алюминия включительно, то восстанавливаются ионы водорода из молекул воды. Катионы металла не восстанавливаются, остаются в растворе.
Если у катода накапливаются молекулы воды и катионы металла, который расположен в ряду напряжения между алюминием и водородом, то восстанавливаются и ионы металла, и частично ионы водорода из молекул воды.
Если в растворе находится смесь катионов разных металлов, то сначала восстанавливаются катионы менее активного металла.
При электролизе раствора кислоты на катоде восстанавливаются катионы водорода до газообразного водорода.
Для удобства мы собрали информацию об электролизе в таблице:
Теперь разберемся, что происходит с анионами в водных растворах при электролизе. Для начала познакомимся с последовательностью восстановления анионов на аноде:
Чем меньше выражена восстановительная активность, тем хуже анионы могут окисляться на аноде. К тому же процесс на аноде зависит от материала анода и от природы аниона.
Если анод инертный или нерастворимый, то на нем протекают следующие реакции:
При электролизе растворов солей бескислородных кислот (кроме фторидов!), на аноде происходит процесс окисления аниона.
При электролизе растворов солей кислородсодержащих кислот и фторидов на аноде выделяется газообразный кислород вследствие окисления молекул воды. Анион при этом не окисляется, оставаясь в растворе.
При электролизе растворов щелочей происходит окисление гидроксид-ионов.
Если анод растворимый, то на нем всегда происходит окисление металла анода — независимо от природы аниона.
Исключением является электролиз солей карбоновых кислот. Таблица выше не описывает происходящее на аноде. Давайте рассмотрим, что же там происходит.
В результате электролиза водных растворов солей щелочных металлов карбоновых кислот происходит образование углеводородов вследствие рекомбинации углеводородных радикалов.
В общем виде электролиз солей карбоновых кислот можно записать так:
На катоде образуется газообразный водород, а на аноде — углекислый газ, углеводород, полученный удвоением радикала. В катодном пространстве накапливается щелочь.
В случае разделения катодного и анодного пространства углекислый газ реагирует со щелочью с образованием гидрокарбоната.
Видео:ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Применение электролиза
А теперь самое главное: зачем вообще нужен электролиз? Рассмотрим применение этого вида ОВР:
С помощью электролиза расплавов природных соединений в металлургической промышленности получают активные металлы (калий, натрий, бериллий, кальций, барий). С помощью электролиза растворов солей — цинк, кадмий, кобальт и другие.
В химической промышленности электролиз используют для получения фтора, хлора, водорода, кислорода, щелочей, бертолетовой соли и других веществ.
Электролиз с растворимым анодом используют для нанесения металлических покрытий (из хрома, золота, никеля, серебра), что предохраняет металлические изделия от коррозии и придает им декоративный вид.
Видео:Задание ЕГЭ №20. Электролиз расплавов и растворов.Скачать

Вопросы для самопроверки
1. Выберите верное продолжение фразы «катод — это. »:
Положительно заряженный электрод, к которому притягиваются положительно заряженные ионы.
Положительно заряженный электрод, к которому притягиваются отрицательно заряженные ионы.
Отрицательно заряженный электрод, к которому притягиваются положительно заряженные ионы.
Отрицательно заряженный электрод, к которому притягиваются отрицательно заряженные ионы.
2. Продолжите фразу «электролиз — это…»:
ОВР с применением тока.
Реакция без изменения степеней окисления с применением тока.
ОВР с применением катализаторов.
3. Как заряжен анион?
Не имеет заряда.
4. Чем отличается электролиз раствора от электролиза расплава?
В расплаве плавится твердое.
Присутствием молекул воды и продуктов ее диссоциации.
5. Если металл стоит в ряду активности металлов между алюминием и водородом, что выделится на катоде?
Металл и водород.
При электролиза водного раствора фторида лития что на аноде выделится?
🎥 Видео
Электролиз раствора сульфата меди(II)Скачать

Электролиз раствора сульфата меди(II)Скачать

хлорид кальция ; электролизСкачать
Электролиз раствора нитрата калияСкачать

ЭлектролизСкачать

Электролиз расплавов и растворов солей.Теория для задания 22 ЕГЭ по химииСкачать
Электролиз. Часть 7. Электролиз с растворимым анодомСкачать

Часть 3-2. Электролиз водных растворов. Примеры решений уравнений (подробно).Скачать