Самопроизвольные окислительно-восстановительные реакции дают возможность создания гальванических элементов, в которых вырабатывается электрическая энергия. Если же реакция несамопроизвольна, то ее осуществление возможно при помощи электрической энергии. Подобные процессы осуществляют в электролизерах и называются они реакциями электролиза (электролиз солей).
- Электролизер
- Электролиз расплава NaCl
- Электролиз водного раствора NaCl
- Процесс на катоде
- Процесс на аноде
- Электролиз солей — количественные аспекты
- 1 закон Фарадея
- 2 закон Фарадея
- Please wait.
- We are checking your browser. gomolog.ru
- Why do I have to complete a CAPTCHA?
- What can I do to prevent this in the future?
- Электролиз растворов и расплавов солей (2 ч)
- 📺 Видео
Видео:Все об электролизе и задании 20 за 20 минут | Химия ЕГЭ 2023 | УмскулСкачать

Электролизер
Как видно на рисунке ниже, электролизер состоит из двух электродов, погруженных в расплав или водный раствор соли. Источник электрического тока передает электроны в один из электродов и удаляет их с другого электрода. При отдаче электронов электрод заряжается положительно, а при получении электронов – отрицательно.
Электролиз расплава NaCl
При электролизе расплава NaCl на отрицательном электроде (катоде) происходит присоединение электронов ионом натрия Na + и его восстановление. При этом вблизи электрода концентрация ионов Na + уменьшается и, вследствие этого, к электроду перемещается дополнительное количество ионов Na + .
Аналогично происходит миграция ионов Cl — к положительному электроду, где в результате отдачи электронов протекает процесс окисления. Таким образом, на электродах идет накопление продуктов окисления и восстановления.
Как и в гальваническом элементе, процесс восстановления протекает на катоде, а процесс окисления – на аноде.
При электролизе расплава NaCl протекают следующие реакции:
| Анод | 2Cl — -2e — → Cl2 0 |
| Катод | 2Na + + 2e — → 2Na 0 |
| 2Na + + 2Cl — → 2Na 0 + Cl2 0 |
В промышленности таким образом получают натрий, используя электролизер Даунса, представленный на рисунке ниже.
Сложнее протекает электролиз водных растворов электролитов.
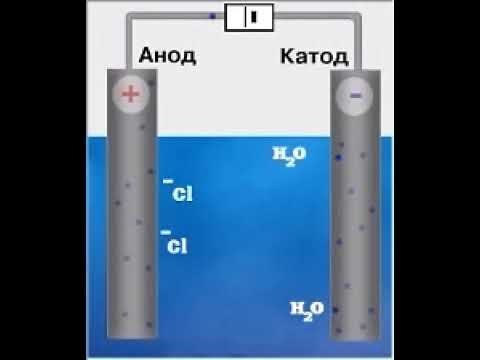
Электролиз водного раствора NaCl
Так, например, при электролизе водного раствора хлорида натрия, происходят иные процессы, нежели при электролизе его расплава. На катоде происходит восстановление воды, а не натрия; на аноде происходит окисление хлорид-ионов:
| Анод | 2Cl — -2e — → Cl2 0 |
| Катод | 2H 2 O + 2e — → H2 0 +2OH — |
| 2H2O + 2Cl — → H2 0 + Cl2 0 |
Таким образом, получить натрий путем электролиза водного раствора его соли не удастся: на катоде выделяется водород, а на аноде хлор.
При электролизе водных растворов солей окислительно-восстановительные процессы, протекающие на катоде и аноде зависят от природы катионов металлов и характера аниона соли.
Видео:Электролиз NaClСкачать

Процесс на катоде
Предсказать результат восстановительного процесса на катоде можно с помощью таблицы стандартных электродных потенциалов металлов:
- Катионы металлов, имеющие большую величину стандартного потенциала и расположенные в ряду после водорода полностью восстанавливаются на катоде и выделяются в виде металлов: Cu 2+ , Hg2 2+ , Ag + , Hg 2+ , Pt 2+ до Pt 4+
- Катионы металлов, имеющие малую величину стандартного потенциала не восстанавливаются на катоде, вместо этого происходит восстановление воды: от Li + , Na + … до Al 3+ включительно.
- Катионы металлов, имеющие среднюю величину стандартного потенциала будут восстанавливаться на катоде вместе с молекулами воды: от Mn 2+ , Zn 2+ … до H
Если имеется смесь катионов, то легче всего на катоде будут восстанавливаться катионы металла с наиболее положительным потенциалом, например, из смеси Cu 2+ , Ag + , Zn 2+ сначала восстановится Ag + (E = +0,79 В), затем Cu 2+ (E = +0,337 В) и только потом Zn 2+ (E = +0,76 В).
Видео:Получил ХЛОРАТ калия из поваренной солиСкачать

Процесс на аноде
Какие процессы будут протекать на аноде зависит от материала анода и самого электролита. Нерастворимые аноды в процессе электролиза не окисляются, тогда как растворимые аноды разрушаются и в виде ионов переходят в раствор.
Рассмотрим процессы, происходящие на инертном (нерастворимом) аноде:
- При электролизебескислородных кислот и их солей (исключение HF и фториды) на аноде окисляются их анионы.
2Cl — -2e — = Cl2
- При электролизекислородсодержащих кислот и их солей c максимальной степенью окисления на аноде происходит окисление воды, в связи с тем, что потенциал окисления воды меньше, чем для таких анионов.
2H2O -4e — = O2 + 4H +
- При электролизе кислородсодержащих кислот и их солей c промежуточной степенью окисления на аноде происходит окисление анионов кислот
SO3 2- + H2O -2e — = SO4 2- + 2H +
В таблице ниже представлены наиболее типичные случаи электролиза с химической точки зрения
| Водный раствор соли малоактивного металла и бескислородной кислоты с инертным анодом | CuBr2 + H2O = Cu + Br2 + H2O K: Cu 2+ + 2e — = Cu | ||||||||||||||||||||||||||||||||
| Водный раствор соли активного металла и кислородсодержащей кислоты с инертным анодом | K2SO4 + 2H2O = K2SO4 + 2H2 + O2 Т.е. происходит разложение воды | ||||||||||||||||||||||||||||||||
| Водный раствор соли активного металла и бескислородной кислоты с инертным анодом | KI + H2O = 2KOH + H2 + I2 | ||||||||||||||||||||||||||||||||
| Водный раствор соли малоактивного металла с анодом из того же металла | CuSO4 K: Cu 2+ + 2e — = Cu A: Cu — 2e — = Cu 2+ Видео:Очистка поваренной соли (практическая работа)Скачать  Электролиз солей — количественные аспектыСвязь между количеством вещества, выделившегося при электролизе соли и количеством прошедшего через него электричества отражена в законах Фарадея. 1 закон Фарадея
где k – коэффициент пропорциональности или электрохимический эквивалент, численно равный массе вещества, которое выделяется при прохождении 1 кулона электричества. 2 закон Фарадея
Т.е. чтобы выделился один химический эквивалент любого соединения необходимо приложить одинаковое количество электричества, которое равно 96484,56 Кл/моль. Это величина называется постоянной Фарадея. m – масса вещества, Э – электрохимический эквивалент, t – время электролиза. Законы Фарадея имеют большое значение при проведении расчетов, связанных с электролизом. Задачи с решениями на составление уравнений электродных реакций, протекающих при электролизе, а также на применение законов Фарадея приведены в разделе Задачи к разделу Электролиз солей Видео:Часть 3-2. Электролиз водных растворов. Примеры решений уравнений (подробно).Скачать  Please wait.Видео:Электролиз. 10 класс.Скачать  We are checking your browser. gomolog.ruВидео:Гидролиз солей. 9 класс.Скачать  Why do I have to complete a CAPTCHA?Completing the CAPTCHA proves you are a human and gives you temporary access to the web property. Видео:ЭлектролизСкачать  What can I do to prevent this in the future?If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware. If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices. Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store. Cloudflare Ray ID: 6de81fa798e0c49a • Your IP : 85.95.188.35 • Performance & security by Cloudflare Видео:Получение хлора из поваренной соли🍀Скачать  Электролиз растворов |
| Вариант | Вопрос 1 | Вопрос 2 | Вопрос 3 | Вопрос 4 | Вопрос 5 |
| 1 | а | б | б | а | б |
| 2 | б | б | а | а | б |
| 3 | а | в | а | в | а |
| 4 | б | в | а | а | а |

1. Для защиты металлических изделий от коррозии на их поверхность наносят тончайший слой другого металла: хрома, серебра, золота, никеля и т.д. Иногда, чтобы не расходовать дорогие металлы, производят многослойное покрытие. Например, внешние детали автомобиля сначала покрывают тонким слоем меди, на медь наносят тонкий слой никеля, а на него – слой хрома.
При нанесении покрытий на металл электролизом они получаются ровными по толщине, прочными. Таким способом можно покрывать изделия любой формы. Эту отрасль прикладной электрохимии называют гальваностегией.
2. Кроме защиты от коррозии гальванические покрытия придают красивый декоративный вид изделиям.
3. Другая отрасль электрохимии, близкая по принципу к гальваностегии, названа гальванопластикой. Это процесс получения точных копий различных предметов. Для этого предмет покрывают воском и получают матрицу. Все углубления копируемого предмета на матрице будут выпуклостями. Поверхность восковой матрицы покрывают тонким слоем графита, делая ее проводящей электрический ток.
Полученный графитовый электрод опускают в ванну с раствором сульфата меди. Анодом служит медь. При электролизе медный анод растворяется, а на графитовом катоде осаждается медь. Таким образом получается точная медная копия.
С помощью гальванопластики изготавливают клише для печати, грампластинки, металлизируют различные предметы. Гальванопластика открыта русским ученым Б.С.Якоби (1838).
Изготовление штампов для грампластинок включает нанесение тончайшего серебряного покрытия на пластмассовую пластинку, чтобы она стала электропроводной. Затем на пластинку наносят электролитическое никелевое покрытие.
Чем следует сделать пластинку в электролитической ванне – анодом или катодом?
(О т в е т. Катодом.)
4. Электролиз используют для получения многих металлов: щелочных, щелочно-земельных, алюминия, лантаноидов и др.
5. Для очистки некоторых металлов от примесей металл с примесями подключают к аноду. Металл растворяется в процессе электролиза и выделяется на металлическом катоде, а примесь остается в растворе.
6. Электролиз находит широкое применение для получения сложных веществ (щелочей, кислородсодержащих кислот), галогенов.
 |
 |

 Na + + Cl – ;
Na + + Cl – ; .
. + O2
+ O2 
 (Cu) = 8/64 = 0,125 моль,
(Cu) = 8/64 = 0,125 моль, Ag
Ag